
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Общие принципы химической стехиометрииСтр 1 из 6Следующая ⇒
Введение
Количественные соотношения между элементами и веществами играют огромную роль в химии. Именно поэтому расчетные задачи или их отдельные элементы составляют большую долю в олимпиадных заданиях. К сожалению, большинство школьников слабо владеет приемами решения таких задач. Причин тому несколько: 1) многие не любят и не умеют считать, даже с использованием калькулятора; 2) качественная химия для большинства намного интереснее количественной; 3) расчеты – это вообще не химия, а математика, как думают многие. Однако, умелое использование стехиометрии при решении олимпиадных задач дает большое преимущество. Хорошие задачи всегда составлены так, что их можно решить различными путями – либо на основе эмпирической информации и собственной химической эрудиции, либо логическим путем, используя приведенную в условии количественную информацию (о составе вещества, потере массы в реакции и т.д.). Стехиометрические расчеты в большей или меньшей степени присутствуют на всех этапах Всероссийской олимпиады. При этом даже сложные расчеты всегда можно разбить на несколько простых действий подобно тому, как сложная реакция состоит из нескольких элементарных стадий. В данной лекции мы подробно опишем эти элементарные действия, используя только стандартные задания, а в следующей – расскажем о том, как они применяются в комбинированных и олимпиадных заданиях. Для подготовки школьников к окружному этапу можно использовать задания для самостоятельного решения, которые приведены в конце этой и следующей лекций. В основе этого материала – цикл лекций по методике решения задач в школьном курсе химии, который автор вместе с А.А.Дроздовым опубликовал в газете «Химия. 1 сентября» в 2012 году.
Расчёты по уравнениям реакций
Расчёты по уравнениям и схемам химических реакций играют огромную роль не только в практических приложениях химии, но и в теориях, описывающих химические превращения, – термодинамике и кинетике. В основе всех расчётов лежат простые соотношения пропорции, задаваемые уравнениями реакций. В общем случае, для реакции вида a A + b B = c C + d D, где маленькие буквы обозначают коэффициенты, а большие – химические вещества, количества реагирующих веществ связаны соотношением:
n(A): n(B) n(C): n(D) = a: b: c: d, или
Эти два эквивалентных соотношения показывают, что
Расчёты по схемам реакций
Полное уравнение реакции со всеми коэффициентами отражает сохранение числа атомов каждого элемента. Если в расчёте участвуют не все участники реакции, а только некоторые из них, то нет необходимости составлять полное уравнение и находить все стехиометрические коэффициенты. Даже необязательно указывать все вещества, участвующие в реакции – достаточно ограничиться схемой, включающей необходимые вещества и коэффициенты.
Пример 18. Сколько килограммов фосфора теоретически можно получить из 62 кг фосфата кальция? Решение. При стандартном подходе необходимо записать полное уравнение получения фосфора из фосфата кальция: Ca3(PO4)2 + 3SiO2 + 5C = 2P + 5CO + 3CaSiO3 и выполнить расчёт по этому уравнению. Однако, в данной задаче нас интересует не конкретный способ получения фосфора, а только его общее количество. Это позволяет заменить уравнение на схему: Ca3(PO4)2 ® 2P Эта схема содержит только те вещества и те стехиометрические коэффициенты, которые непосредственно участвуют в расчёте. Так же, как и полное уравнение, она отражает закон сохранения массы, но не всех элементов, а только одного – фосфора. Дальнейшие действия аналогичны рассмотренным выше. Выполним расчёт по молям: n(Ca3(PO4)2) = m / M = 62 / 310 = 0,2 кмоль. Согласно схеме, количество фосфора в 2 раза превышает количество фосфата: n(P) = 2n(Ca3(PO4)2) = Масса фосфора: m (P) = n × M = 0,4 × 31 = 12,4 кг. Ответ. 12,4 кг P.
Принцип сохранения числа атомов конкретного элемента позволяет включать в расчётную схему не одно, а сразу несколько уравнений реакции и тем самым избегать всех промежуточных вычислений. Получается очень экономный и эффективный способ расчёта.
Пример 19. Рассчитайте массу серной кислоты, которую теоретически можно получить из 600 кг пирита (дисульфида железа (II)). Решение. Производство серной кислоты из пирита включает три основные стадии – обжиг пирита: 4FeS2 + 11O2 = 2Fe2O3 + 8SO2, окисление сернистого ангидрида до серного:
2SO2 + O2 = 2SO3 и гидратацию последнего: SO3 + H2O = H2SO4. Согласно этим уравнениям: n(H2SO4) = n(SO3) = n(SO2) = 8/4 n(FeS2). Тем самым, используя три уравнения, мы связали количества исходного сырья и целевого продукта реакции. Однако, мы могли бы это сделать сразу, записав суммарную схему процесса с коэффициентами, отражающими закон сохранения числа атомов серы: FeS2 ® 2H2SO4. В соответствии с этой схемой, n(H2SO4) = 2n(FeS2) = 2×(600/120) = 10 кмоль. Масса серной кислоты: m (H2SO4) = n × M = 10 × 98 = 980 кг. Разумеется, в практических расчётах необходимо принимать во внимание то, что многие реакции протекают не до конца, поэтому надо учитывать выход продукта на каждой стадии. Однако, если речь идёт только о максимально возможном количестве продукта, которое соответствует 100%-ному выходу, то можно ограничиться схемой с коэффициентами. Ответ. 980 кг H2SO4.
Задачи на смеси веществ
При решении задач на смеси веществ используют один из важнейших принципов химии – принцип независимости химических реакций. В контексте нашей статьи он гласит:
Литература
1. В.В. Еремин, Н.Е. Кузьменко, А.А. Дроздов, В.В. Лунин. Химия. 9 класс. Учебник для общеобразовательных учреждений. – М.: Дрофа, 2009. Гл. 1, 2. 2. В.В. Еремин, Н.Е. Кузьменко. Сборник задач и упражнений по химии. Школьный курс. 8-11 классы. – М.: Экзамен, 2007.
Введение
Количественные соотношения между элементами и веществами играют огромную роль в химии. Именно поэтому расчетные задачи или их отдельные элементы составляют большую долю в олимпиадных заданиях. К сожалению, большинство школьников слабо владеет приемами решения таких задач. Причин тому несколько: 1) многие не любят и не умеют считать, даже с использованием калькулятора; 2) качественная химия для большинства намного интереснее количественной; 3) расчеты – это вообще не химия, а математика, как думают многие. Однако, умелое использование стехиометрии при решении олимпиадных задач дает большое преимущество. Хорошие задачи всегда составлены так, что их можно решить различными путями – либо на основе эмпирической информации и собственной химической эрудиции, либо логическим путем, используя приведенную в условии количественную информацию (о составе вещества, потере массы в реакции и т.д.). Стехиометрические расчеты в большей или меньшей степени присутствуют на всех этапах Всероссийской олимпиады. При этом даже сложные расчеты всегда можно разбить на несколько простых действий подобно тому, как сложная реакция состоит из нескольких элементарных стадий. В данной лекции мы подробно опишем эти элементарные действия, используя только стандартные задания, а в следующей – расскажем о том, как они применяются в комбинированных и олимпиадных заданиях. Для подготовки школьников к окружному этапу можно использовать задания для самостоятельного решения, которые приведены в конце этой и следующей лекций. В основе этого материала – цикл лекций по методике решения задач в школьном курсе химии, который автор вместе с А.А.Дроздовым опубликовал в газете «Химия. 1 сентября» в 2012 году.
Общие принципы химической стехиометрии
Основные понятия химии – «вещество» и «реакция». Вещества описываются химическими формулами, а реакции – химическими уравнениями. И то, и другое можно использовать для количественных расчетов, которые играют важнейшую роль в практических приложениях химии. Правила для проведения расчетов по формулам и уравнениям устанавливает стехиометрия (от греч. "стойхеон" – "элемент" и "метрео" – измеряю) – раздел химии, который изучает количественные соотношения между элементами или веществами.
Принципы стехиометрии и правила стехиометрических расчетов очень просты – в их основе лежат закон сохранения массы, который используют для составления уравнений химических реакций, и математические соотношения пропорции. Различают стехиометрию состава и стехиометрию реакций. Первая рассматривает атомные или массовые соотношения элементов в химическом соединении, а вторая – молекулярные, массовые или объёмные соотношения веществ в химической реакции. Напомним, что вещества молекулярного строения (газы, жидкости и некоторые твёрдые вещества) характеризуются молекулярной формулой, указывающей число атомов каждого элемента в молекуле. В веществах ионного или атомного строения молекул нет, их формула указывает состав так называемой формульной единицы – наименьшего повторяющегося фрагмента вещества. Такую формулу называют эмпирической, а также простейшей или брутто-формулой, она характеризует соотношение между числом атомов разных элементов в веществе. Для последующего изложения удобно разделить все величины, используемые в химических расчётах, на два непересекающихся класса: экстенсивные и интенсивные. Экстенсивные величины прямо пропорциональны количеству вещества – к ним относятся масса m, объем V, число молекул N (молей n), энергия E, теплота Q и другие. Интенсивные величины не зависят от количества вещества – это важное свойство позволяет выбирать для расчётов удобное в конкретной ситуации количество вещества, например, 1 моль или 100 г. Интенсивными являются плотности – абсолютная r = m / V и относительная D = r2 / r1, а также все величины, выражающие состав смесей – мольная, объёмная и массовые доли, молярная концентрация. Обратим внимание на то, что все интенсивные величины являются относительными, то есть представляют собой отношения одной величины к другой. К интенсивным относят также все молярные величины, например молярную массу M = m / n и молярный объем V m = V / n. Наконец, химическую формулу также можно считать интенсивной величиной, поскольку она не зависит от количества вещества. Брутто-формула также имеет характер отношения – ведь она показывает отношение числа атомов одного элемента к числу атомов другого элемента.
Большинство расчётов с участием химических формул и уравнений удобно, используя соотношения пропорции, проводить в молях. Для расчёта количества вещества в молях можно использовать любую экстенсивную величину – массу, объем, число частиц и даже заряд (для электронов): n = F / F m, (1) где F – экстенсивная величина, F m – соответствующая ей молярная величина. Примерами служат общеизвестные формулы: n = m / M, (1.1) n = V / V m, (1.2) n = N / N A, (1.3) где N A = 6,02×1023 моль-1 – постоянная Авогадро, равная числу частиц в одном моле. Это – базовые формулы для всех стехиометрических расчётов; с их помощью удобно также связывать между собой различные экстенсивные свойства одного и того же вещества, например объем и число частиц. Из этих формул вытекают два важных, широко применимых следствия. 1) В формуле (1.2) знаменатель – молярный объем V m – оказывается одинаковым для всех газов, находящихся при одних и тех же условиях. Это следует из уравнения идеального газа, записанного для одного моля:
Здесь T и p одинаковы для двух газов, по условию, а R – универсальная постоянная, имеющая одно и то же значение для всех газов при любых условиях. Записав количества вещества двух газов через объем:
и поделив одно выражение на другое, найдём в силу постоянства V m, соотношение: выражающее закон Авогадро. 2) Действия, аналогичные п.1, можно проделать для числа частиц N, используя формулу (1.3). Найдём количества двух веществ через число молекул:
поделим одно выражение на другое и учтём то, что N A – постоянная величина: Отношение числа молекул (атомов) всегда равно отношению соответствующих количеств вещества, выраженных в молях. Это часто используется в расчётных задачах. Все расчёты по формулам и уравнениям можно проводить и без молей, просто составляя пропорции – этот способ для многих учащихся оказывается более простым. Неявно, при записи пропорций, предполагается что количество вещества составляет 1 моль. Везде, где это возможно, мы будем приводить оба способа.
|
||||||||
|
Последнее изменение этой страницы: 2021-05-27; просмотров: 70; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.227.0.192 (0.036 с.) |
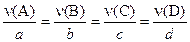
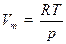 .
.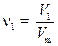 ,
, 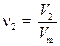 ,
,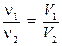 , (2)
, (2)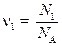 ,
, 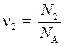 ,
,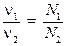 . (3)
. (3)


