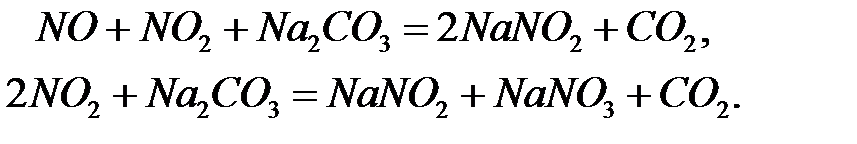Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Теоретические основы процесса. ⇐ ПредыдущаяСтр 4 из 4
Контактное окисление аммиака кислородом воздуха без катализатора не идет. На катализаторе между аммиаком и кислородом протекают следующие параллельные реакции:
Одновременно с этими реакциями могут протекать (параллельно и последовательно) побочные реакции:
Приведенные уравнения каталитического окисления аммиака являются суммарными и не отражают истинного механизма процесса. В качестве катализатора в основном используют платиноидный катализатор, представляющий собой сплав платины с палладием и родием. Этот катализатор является наиболее активным и селективным по сравнению с другими. Скорость каталитического окисления аммиака до NO очень высока. За десятитысячные доли секунды степень превращения аммиака в оксид азота (II) достигает 97-98% при атмосферном давлении и 95-96% под давлением до 0,88-0,98 МПа. Однако выход оксида азота (II) может быть различным на одном и том же катализаторе в зависимости от выбранных технологических параметров – температуры, давления, линейной скорости газа, содержания аммиака в аммиачно-воздушной смеси и т.д. Влияние температуры. Температура оказывает наибольшее влияние на выход оксида азота (II). Зависимость выхода NO от температуры на платиновом катализаторе показана на рис. 6.14. При повышении температуры выход NO возрастает, причем существует оптимальная температура (для чистой платины, 90-920°С) при которой достигается максимальный выход. Проведение процесса при высоких температурах помимо увеличения выхода оксида азота (II) имеет и другие преимущества: растет скорость реакции окисления аммиака и уменьшается время контакта.
Влияние давления. С ростом давления наблюдается снижение выхода оксида азота (II). Вместе с тем использование высокого давления при окислении аммиака позволяет повысить производительность агрегата, уменьшить размер аппаратов. На современных крупных агрегатах производства азотной кислоты процесс окисления аммиака осуществляется под давлением 0,41- 0,73МПа. Основным условием получения высоких выходов NO под давлением выше атмосферного является повышение температуры и времени контакта (увеличение числа сеток). Из рис. 6.15 видно, что для обеспечения выхода оксида азота (II) более 98% при давлениях 0,41 - 0,71 МПа необходимы температуры выше 950°С.
Повышением давления в процессе конверсии можно увеличить линейную скорость газа и напряженность катализатора, что в свою очередь связанно с увеличением числа катализаторных сеток. Увеличение числа сеток ведет к повышению степени конверсии аммиака и линейной скорости газа. Влияние концентрации аммиака. Для окисления аммиака, как уже указывалось, применяют воздух. Поэтому концентрация NH3 в аммиачно-воздушной в смеси определяется, в том числе, содержанием кислорода в воздухе. Согласно уравнению реакции Окисление окиси азота до двуокиси – обратимая реакция, протекающая с уменьшением объема и сопровождающаяся выделением тепла, поэтому понижение температуры нитрозных газов и повышение давления будет сдвигать равновесие реакции вправо, т.е. в сторону образования NO2. Константа равновесия этой реакции:
сильно зависит от температуры. Так при температуре 100°С Кр =1,8∙108, при 200°С Кр =7,4∙104, при 500°С Кр =0,85, при 800°С Кр =5,6∙10-3. Из приведенных данных следует, что в нитрозных газах, выходящих из реактора окисления аммиака при температуре 800°С, двуокись азота практически отсутствует. Чтобы перевести NO в NO2 нитрозные газы следует охладить ниже 100°С. Скорость реакции
Образование такого димера – процесс обратимый, он протекает с выделением тепла, поэтому его выход и, следовательно, концентрация в газовой смеси уменьшается при увеличении температуры. Таким образом, скорость реакции окисления NO понижается при увеличении температуры. Скорость реакции окисления NO в NO2 – самая медленная в процессе производства азотной кислоты, она определяет скорость всего процесса. При охлаждении происходит полимеризация NO2
Зависимость степени полимеризации NO2 от температуры характеризуется следующими данными:
Скорость полимеризации очень высока, поэтому в любой момент времени соотношение NO2:N2O4 определяется условиями равновесия, так как оно устанавливается практически мгновенно. Абсорбция двуокиси углерода протекает следующим образом. Двуокись азота взаимодействует с водой с образованием азотной и азотистой кислот
Азотистая кислота неустойчива и разлагается
Суммарное уравнение абсорбции двуокиси азота можно записать в виде
Механизм образования азотной кислоты из NO2 при абсорбции ее водой, а затем разбавленной азотной кислотой (по мере ее образования) можно представить следующим образом. Двуокись азота диффундирует через пограничный слой газа к поверхности жидкости и абсорбируется ею. При этом NO2 взаимодействует с водой. По сравнению с диффузией эта реакция протекает быстро. Азотистая кислота разлагается сравнительно медленно. Образующаяся при этом окись азота плохо растворима в водных растворах азотной кислоты, поэтому она выделяется в газовую фазу, где окисляется кислородом.
Концентрация получаемой азотной кислоты определяется условиями равновесия NO2 над азотной кислотой (рис. 6.16). Это объясняется тем, что количество NO2, абсорбируемой водным раствором азотной кислоты, зависит от движущей силы этого процесса
где С повышением температуры
Технологическое оформление производства разбавленной азотной кислоты. Технологическая схема производства азотной кислоты при атмосферном давлении приведена на рис. 6.17. Воздух поступает через заборную трубу, проходит водяной скруббер 1 и суконный фильтр 2. Очищенный воздух и аммиак подаются в улитку вентилятора 3, где происходит их смешение. Полученная газовая смесь, содержащая 10-12% NH3, вентилятором 3 направляется в картонный фильтр 4, а затем в конвертор (реактор) 5, в средней части которого размещены платино-родиевые сетки. Степень окисления NH3 до окиси азота, составляет ~ 97-98%. Температура нитрозных газов на выходе из реактора 800°С. Реактор монтируют непосредственно на котле-утилизаторе 6, в котором получают пар давлением до 4 МПа при температуре 450°С. Температура газов после котла-утилизатора составляет 160°С: дальнейшее охлаждение осуществляется в водяных холодильниках 7 и 8. Здесь же происходит частичная конденсация водяных паров и окисление окиси азота до двуокиси азота. Степень окисления NO в холодильнике 7 незначительна, поэтому в нем получается кислота, содержащая ~5% HNO3; в холодильнике 8 степень окисления NO более высокая, и в нем конденсируется кислота концентрацией ~ 30% HNO3.
Охлажденный газ вентилятором 9 направляется в абсорбционную систему, состоящую из шести-семи полых башен 10 (на рисунке показаны четыре башни), орошаемых азотной кислотой. В объеме этих башен продолжается процесс окисления NO до NO2; одновременно NO2 абсорбируется азотной кислотой и вступает во взаимодействие с водой, имеющейся в азотной кислоте. Для окончательного поглощения NO2 в последнюю по ходу газа башню подают воду; образующуюся азотную кислоты направляют последовательно противотоком газу от последней башни к первым. Продукционная кислота выводится из второй башни, ее концентрация 45-50% HNO3. Степень абсорбции нитрозных газов составляет 92-94%. Большое число башен объясняется тем, что скорость реакции окисления NO мала и, следовательно, мала общая скорость процесса. Кроме того по мере снижения концентрации окислов азота эта скорость уменьшается еще больше к концу процесса, поэтому для увеличения степени окисления окиси азота и степени абсорбции газов необходимо существенно увеличить время процесса, что достигается при введении большого числа абсорбционных башен. После абсорбционных башен газ направляют в окислительную башню 11 для полного окисления NO в NO2, а затем в башни щелочной абсорбции 12, орошаемые водным раствором соды. Окислы азота (NO и NO2) абсорбируются содовым раствором с образованием солей:
Получаемые растворы нитрата и нитрита натрия выводят из первой по ходу газа башни для дальнейшей переработки. Концентрирование азотной кислоты. Концентрирование разбавленной азотной кислоты осуществляется в тарельчатых барботажных колоннах или в колоннах с насадкой из колец. Так как путем упаривания воды из разбавленных растворов HNO3 можно получить азотную кислоту концентрацией не более 68,7% HNO3, процесс концентрирования ведут в присутствии концентрированной серной кислоты.
Серная кислота связывает воду, содержащуюся в разбавленной азотной кислоте, образуя гидраты серной кислоты, кипящей при температуре более высокой, чем 100%-ная HNO3. Поэтому необходимо подобрать условия, при которых в процессе нагревания смеси, содержащей азотную и серную кислоты, в парах будет содержаться почти исключительно азотная кислота. Схема установки для концентрирования разбавленной азотной кислоты приведена на рис. 6.18. Разбавленную азотную кислоту в виде двух потоков направляют в колонну концентрирования. Один из потоков вначале поступает в испаритель, где азотная кислота испаряется. Образующиеся пары подаются на десятую тарелку барботажной колонны 1. Второй поток разбавленной азотной кислоты направляется непосредственно в колонну (минуя испаритель) на тарелки, расположенные несколько выше ввода колонну паров из испарителя 2. Концентрированная серная кислота (~93%) подается на одну из верхних тарелок колонны 2. Для нагревания смеси в нижнюю часть колонны вводят острый пар (около 250°С). Пары азотной кислоты с незначительным содержанием паров воды и окислов азота, образовавшихся в результате разложения азотной кислоты, направляются из колонны в холодильник – конденсатор 3, где азотная кислота конденсируется, а нитрозные газы идут на дальнейшее улавливание. Часть окислов азота растворяется в азотной кислоте, поэтому из конденсатора она возвращается на верхние тарелки колонны, где продувается, и затем отводится в качестве продукционной после охлаждения в холодильнике 4. Отработанная разбавленная серная кислота (68%) вытекает из нижней части колонны и поступает без охлаждения на упаривание до ~93%-ной H2SO4. Рис. 6.18. Схема концентрирования разбавленной азотной кислоты в присутствии серной кислоты: 1 – концентрационная колонна; 2 – испаритель разбавленной азотной кислоты; 3 – холодильник-конденсатор; 4 – холодильник концентрированной азотной кислоты
Вопросы для самостоятельной проработки материала. 1. Составьте химическую и принципиальную схемы производства серной кислоты контактным методом. 2. Является ли реакция сжигания серы в промышленных печах гомогенной или гетерогенной? Ответ обоснуйте. 3. Приведите модель окисления колчедана кислородом воздуха. Объясните ее. 4. Составьте материальный баланс печи обжига колчедана КС-450. Производительность печи по колчедану 450 т/сут. Содержание серы в сухом колчедане 43%. содержание влаги в колчедане 1,5%. Содержание SO2 в сухом обжиговом газе 14,5%. Температура поступающего воздуха 20%, его относительная влажность 50% 5. Какие схемы аппаратов применяют для проведения процессов обжига флотационного колчедана? 6. Приведите схему очистного отделения в производстве серной кислоты из флотационного колчедана. 7. Опишите теоретические закономерности окисления сернистого ангидрида. 8. Назовите важнейшие области применения аммиака в современной экономике.
9.Составьте химическую и операторную схему производства аммиака. 10. Каковы основные физико-химические особенности реакции синтеза аммиака из азота и водорода? 11.Что является сырьем для производства азотной кислоты и какие требования к нему предъявляются? 12. Приведите химическую схему синтеза азотной кислоты. Какая реакция имеет наибольшую термодинамическую вероятность? 13. Опишите основные закономерности стадии окисления окиси азота до двуокиси азота.
|
|||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2021-05-27; просмотров: 111; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.116.118.198 (0.03 с.) |
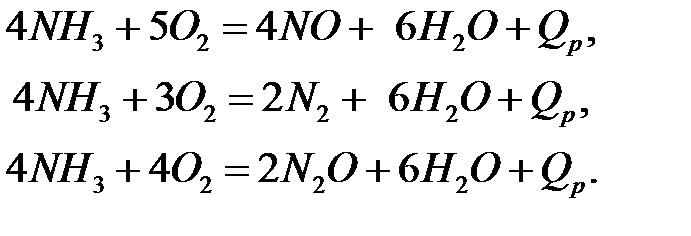
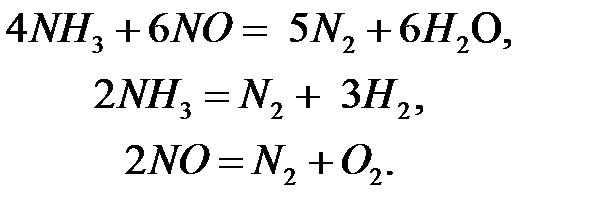
 Рис. 6.14. Зависимость выхода оксида азота (II) от температуры: 1 – одна сетка из платины; 2 – три сетки из сплава.
Рис. 6.14. Зависимость выхода оксида азота (II) от температуры: 1 – одна сетка из платины; 2 – три сетки из сплава.
 Рис. 6.15. Зависимость выхода оксида азота (II) от давления и температуры при τопт: 1 – 900°С; 2 – 950°С; 3 – 980°С; 4 –1010°С.
Рис. 6.15. Зависимость выхода оксида азота (II) от давления и температуры при τопт: 1 – 900°С; 2 – 950°С; 3 – 980°С; 4 –1010°С.
 для полного окисления 1 моль аммиака необходимо 1,25 моль кислорода. При этом соотношение содержания NH3 в аммиачно-воздушной смеси составляет 14,4% (объем.). Однако при соотношении О2:NH3 = 1,25 даже при атмосферном давлении выход оксида азота (II) не превышает 60-80%. Кроме этого при содержании в смеси 14,4% (объем.) NH3 пришлось бы работать в области взрывоопасных концентраций. Поэтому соотношение О2:NH3 поддерживают на уровне 1,7, что соответствует содержанию NH3 в аммиачно-воздушной смеси 11,0-11,5% и процесс ведут при температуре 870-920°С.
для полного окисления 1 моль аммиака необходимо 1,25 моль кислорода. При этом соотношение содержания NH3 в аммиачно-воздушной смеси составляет 14,4% (объем.). Однако при соотношении О2:NH3 = 1,25 даже при атмосферном давлении выход оксида азота (II) не превышает 60-80%. Кроме этого при содержании в смеси 14,4% (объем.) NH3 пришлось бы работать в области взрывоопасных концентраций. Поэтому соотношение О2:NH3 поддерживают на уровне 1,7, что соответствует содержанию NH3 в аммиачно-воздушной смеси 11,0-11,5% и процесс ведут при температуре 870-920°С.
 уменьшается при повышении температуры; таким образом, эта реакция представляет собой исключение из общего правила. В соответствии с одним из наиболее распространенных механизмов этого процесса окисление NO в NO2 проходит через образование промежуточного продукта – димера окиси азота.
уменьшается при повышении температуры; таким образом, эта реакция представляет собой исключение из общего правила. В соответствии с одним из наиболее распространенных механизмов этого процесса окисление NO в NO2 проходит через образование промежуточного продукта – димера окиси азота.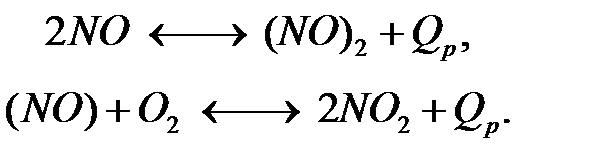
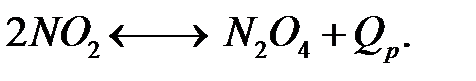
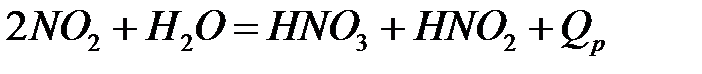 .
. .
. .
.
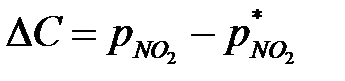 ,
,
 ,
, 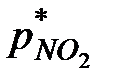 - парциальное давление NO2 в газовой фазе и равновесное давление NO2 у поверхности водного раствора азотной кислоты.
- парциальное давление NO2 в газовой фазе и равновесное давление NO2 у поверхности водного раствора азотной кислоты.