
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Слайд 3. 24до. Далее слайд 3. 25 от.Содержание книги
Поиск на нашем сайте
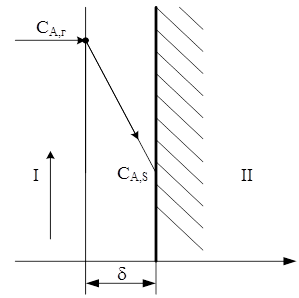
Подставив в уравнение (3.15) значение CA , S из уравнения (3.17) получим:
Из анализа уравнения (3.18), можно установить влияние отдельных параметров на общую скорость процесса. Если ks >> β г, из уравнения (3.18) следует:
Слайд 3.25 до. Далее Слайд 3.26 от. т.е. общая скорость процесса определяется скоростью диффузии. Для повышения скорости процесса необходимо увеличивать коэффициент β г. Обычно это осуществляют путем уменьшения толщины пограничного слоя газа. Для этого увеличивают скорость газового потока или усиливают его турбулизацию. Когда ks << β г из уравнения (3.18) следует, что
Следовательно, общая скорость процесса определяется скоростью химической реакции. Для увеличения ks и общей скорости процесса необходимо повышать температуру в соответствии с уравнением Аррениуса или применять катализаторы, снижающие энергию активации. Увеличение общей скорости химических процессов в системе газ(жидкость) – твердое тело также возможно путем увеличения поверхности контакта фаз. Это достигается путем измельчения твердой фазы.
Слайд 3.26 до. Далее Слайд 3.27 от. Гомогенные и гетерогенные каталитические процессы. Гомогенные каталитические процессы широко распространены в природе. Примером промышленных гомогенных каталитических процессов может служить реакция этерификации, омыления сложных эфиров и т.д. Механизм каталитического действия при гомогенном катализе заключается в образовании между реагирующими соединениями и катализатором промежуточных соединений, которые в некоторых случаях удается даже выделить. Ускорение реакции в большинстве случаев происходит за счет снижения энергии активации. При гомогенном катализе в растворах каталитическое действие могут оказывать ионы водорода, гидроксила, солей, а также веществ, способствующих образованию свободных радикалов. Катализ под действием ионов водорода или гидроксила называют кислотно-основным. Этот вид катализа наиболее распространён. Сущность его заключается в переходе протона от катализатора к реагирующему веществу ( катализ кислотами) или от реагирующего вещества к катализатору (катализ основаниями). В дальнейшем протон перемещается в обратном направлении и катализатор регенерируется.
Общая скорость гомогенных процессов, например, для реакции:
которая протекает через ряд стадий:
может быть описана уравнением:
|
|||||||||||||||
|
Последнее изменение этой страницы: 2021-05-27; просмотров: 78; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.145.156.17 (0.009 с.) |

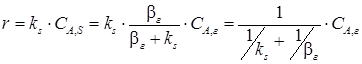 .
.
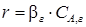 ,
,
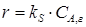 .
.
 .
.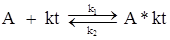 ,
,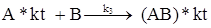 ,
,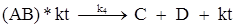 ,
,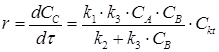 .
.



