
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Отношение металлов к кислороду (воде)Содержание книги Поиск на нашем сайте
Большинство металлов и изделия из них эксплуатируются в атмосферных условиях, т.е. на металл воздействует кислород, который выступает в роли окислителя. По отношению к кислороду все металлы можно разделить на 4 группы: Металлы, которые не выдерживаю контакта с воздухом, мгновенно окисляются (разрушаются). Это щелочные и щелочно – земельные металлы (Li, Na, K, Rb, Cs, Ca, Sr, Ba)
4Li + O2 = 2Li2O 2Na + O2 = Na2O2 (пероксид натрия) 2Сa + O2 = 2CaO
Эти металлы хранят под слоем керосина, вазелинового масла. Металлы, которые при стандартных условиях взаимодействуют с кислородом, однако на поверхности таких металлов образуются защитные оксидные пленки. Например:
4Al + 3O2 = 2Al2O3 4Fe + 3O2 = 2Fe2O3 2Ni + O2 = 2NiO
Металлы, которые взаимодействуют с кислородом при высоких температурах: Pb, Bi, Cu, Hg t 2Cu + O2 = 2CuO
Металлы, которые не могут быть окислены кислородом:
- Ag, Au, Pt.
В амфотерных условиях на металл часто воздействует сумма факторов, за счет чего металл разрушается. Например, медные изделия покрываются зеленным налетом основного карбоната меди
2Cu + O2 + H2O + CO2 = (CuOH)2CO3
или серебряные изделия чернеют при их эксплуатации за счет воздействия на металл одновременно кислорода и сероводорода.
4Ag + 2H2S + O2 = 2Ag2S + 2H2O
При свободном доступе кислорода, воды и двуокиси углерода сравнительно быстро разрушается свинец. Протекающие при этом реакции можно выразить следующим уравнениеми:
2Pb + O2 = 2PbO PbO + CO2 = PbCO3 PbCO3 + CO2 + H2O = Pb(HCO3)2
В сухом же кислороде свинец начинает окисляться только при температуре ≈ 130 оС.
Отношение металлов к воде
Реакция взаимодействия металла с водой может быть выражена следующей схемой: _ ne
Me + OH → Me(OH)x + H2
т.е. металл вытесняет водород из воды. Эта реакция возможна при условии, если потенциал металла
φMe/Men < - 0,0414B
Наиболее энергично эта реакция протекает при взаимодействии воды с щелочными и щелочноземельными металлами
2K + 2H2O = 2KOH + H2 Ko – e → K+ | 2 окисление 2H+ + 2e → H2|1 восстановление
2Na + 2H2O = 2NaOH + H2 Nao – e → Na+ | 2 окисление 2H+ + 2e → H2 | 1 восстановление
Ba + 2H2O = Ba(OH)2 + H2 Bao - 2e → Ba2+ | 1 2H+ + 2e → H2 | 1
Многие металлы, потенциал которых меньше – 0.414, не вытесняют водород из воды (магний, цинк, алюминий и т.д.). Это объясняется тем, что они образуют плохо растворимые в воде гидроксиды, которые оседают на поверхности и создают на ней прочные защитные пленки.
Mg + 2H2O = ↓ Mg(OH)2 + H2 Zn + 2H2O = ↓ Zn(OH)2 + H2
При действии водяных паров на раскаленное железо протекает процесс:
3Fe + 4H2O ↔ Fe3O4 + 4H2
Металлы, потенциал которых φ > - 0.414 не способны вытеснять водород из воды.
|
|||||
|
Последнее изменение этой страницы: 2021-04-20; просмотров: 101; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.15.182.201 (0.008 с.) |

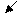
 e
e
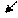 e
e



