
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Определение теплоты сгорания топлива
Теплоту сгорания можно определять двумя путями. Первый из них заключается в непосредственном измерении количества тепла, выделяющегося при сжигании определенного количества исследуемого горючего, т.е. путь экспериментальный. Второй путь (расчётный) основан на том, что эта характеристика вычисляется исходя из теплоты сгорания горючих составляющих топлива и, следовательно, определяется содержанием последних в топливе. Таким образом, во втором случае требуется знание точного состава топлива и тех тепловых эффектов, какими сопровождаются реакции окисления горючих составляющих.
5.2.1. Экспериментальный путь (калориметрическое определение теплоты сгорания топлива)
Первый путь – непосредственное определение количества тепла, выделяющегося при горении – является более надежным и точным, так как при этом устраняется влияние всякого рода ошибок в определении содержания отдельных компонентов горючего. Поэтому исследование топлива всегда включает экспериментальное определение его теплоты сгорания. Это определение выполняется в калориметрах. Сущность калориметрического метода заключается в том, что выделяющееся при горении навески горючего тепло поглощается средой, свойства которой хорошо изучены. При этом, согласно закону сохранения энергии:
где Если искомую теплоту сгорания обозначить через Q, а навеску горючего – через p, то
В поглощающей среде, масса которой M и теплоемкость C, температура повышается от t до
Выбирая в качестве поглощающей среды воду, имеем C = 1 для случая, если тепловой баланс записывается в калориях. Тепло, затраченное на нагревание частей прибора, также можно выразить через водяное число W. Водяным числом называется то количество воды, выраженное в граммах, для повышения температуры которой на 1º требуется столько же тепла, сколько нужно для повышения на 1º температуры всех частей прибора (т.е. теплоемкость частей прибора выражена через равновеликую ей по теплоемкости массу W воды). В результате
Водяное число определяют опытным путем, для чего в калориметре сжигают навеску химически чистого индивидуального вещества, теплота сгорания которого точно известна. В качестве такого вещества III Международный конгресс по чистой и прикладной химии (Лион, 1922) избрал бензойную кислоту и принял для нее значение теплоты сгорания, равное 26,5 кДж/г. Если теплота стандартного вещества – Q кДж; вес воды в калориметре M и повышение температуры - Δ t, то:
где q – тепло, поглощенное деталями калориметра.
Отсюда
Измерять W необходимо для каждого калориметра. Определять величину W необходимо заново, если в приборе сделаны какие-либо изменения. Таким образом, в калориметрической формуле известны: M и p - заданные, W – предварительно измеренное. Остается опытным путем измерить Δ t, что, однако, нельзя выполнить совершенно точно, вследствие потерь тепла на испарение воды, конвективный теплообмен и главным образом на радиацию. При сжигании твердого и жидкого топлива с Газообразное топливо и жидкое топливо, В соответствии с этим разработаны калориметры двух типов. Теплотворность твердого топлива определяют в калориметрических бомбах, предложенных в 1881 г. М.Бертело и претерпевших за истекшее время некоторые изменения, заключающиеся главным образом в замене дорогих материалов более дешевыми. Вопрос о постройке дешевого и надежного калориметра был решен в результате применения для изготовления бомбы кислотоупорной стали. Бомба представляет собой толстостенный стакан, изготовленный из кислотоупорной стали, объемом 300 см3. На наружной стороне дна симметрично расположены три ножки, обеспечивающие постоянство положения стакана при завинчивании крышки бомбы. Бомба устанавливается на подставку, в которой имеются углубления, соответствующие ножкам стакана. Благодаря наличию ножек при установке бомбы в калориметр между дном последнего и бомбой образуется пространство, в котором может свободно циркулировать вода, применяемая как поглощающая тепло среда.
Сверху стакан закрывается толстой крышкой, навинчиваемой на стакан. Для создания максимальной герметичности между стенками стакана и крышкой прокладывается свинцовое кольцо. В крышке бомбы имеется три отверстия, два из которых закрываются вентилями на резьбе. Первое служит для соединения бомбы с кислородным баллоном, второе – для удаления из бомбы продуктов сгорания. Через третье отверстие пропущен стержень, изолированный в месте соприкосновения с крышкой. Внутри бомбы на специальном кольце устанавливается платиновая чашечка с помещенной в нее навеской топлива. Над кольцом предусмотрены крючки для закрепления зажигательной проволочки, к которой подводится электрический ток. Уголь помещают в бомбу в виде брикетика, через который проходит зажигательная проволочка. Для изготовления брикетика отвешивают несколько больше 1 г угля и ровно 10 см тонкой железной проволоки. Брикетик кладут в платиновую чашку, в стакан наливают точно отмеренное (10 см3) количество воды. Крышку осторожно ставят на стакан и плотно завинчивают. Затем наполняют бомбу кислородом, пока давление в ней не достигнет 25 ати. Заряженную таким образом бомбу помещают в собственно калориметр, представляющий собой латунный никелированный сосуд, помещаемый (во избежание потерь тепла в окружающее пространство) на стеклянной подставке в латунный же цилиндрический сосуд с двойными стенками, между которыми налита вода. Калориметр снабжен мешалкой, работающей от маленького электродвигателя. Наружный сосуд закрывают эбонитовой крышкой, через которую проходят стержень мешалки, термометр для измерения температуры воды и электрические провода для воспламенения угля в бомбе. В калориметр наливают точно отвешенное (с точностью до 0,1 г) количество воды – около 3 кг. Далее приступают к проведению опыта. Пускают в ход мешалку и наблюдают при помощи лупы за температурой. Как только изменения температуры за одинаковые промежутки времени (30 сек.) станут приблизительно равными (обычно это наступает через 5 мин. после начала опыта), начинают записывать показания термометра. Десятой записью заканчивают так называемый начальный период и сейчас же зажигают уголь, замкнув ток, который размыкается автоматически, как только перегорит в бомбе запальная проволока. С момента воспламенения угля начинается главный период, в течение которого показания термометра регистрируются также каждые 30 сек. При первых записях главного периода отмечают температуру с точностью до 0,01º, так как более точные отсчеты в это время невозможны вследствие быстрого подъема температуры; последние же отсчеты должны быть сделаны точно (до 0,001º). Обычно после быстрого подъема рост показаний термометра замедляется, достигает максимума, на котором удерживается очень короткое время. Затем начинается падение температуры, заканчивается главный период и начинается конечный, который длится 5 мин. Показания термометра в этот период записывают через каждые 30 сек.
После этого останавливают мешалку, и опыт считается законченным. Бомбу вынимают из калориметра, обтирают, выпускают газ и отвинчивают крышку. Несгоревшую часть железной проволоки снимают и точно взвешивают для установления поправки к результатам опыта. Количество тепла, выделенное при горении проволоки, определяют из следующего равенства
где Второй поправкой к определяемой величине теплотворности является различие в теплоте сгорания азота и серы. В топке азот выделяется в элементарном состоянии, в то время как в бомбе он окисляется до азотного ангидрида. Сера в условиях топки сгорает только до SO2, а в бомбе она сгорает до сернистого ангидрида, который, соединяясь с водой, образует серную кислоту. Если теплотой окисления азота можно пренебречь из-за ее небольшой величины, то не учитывать теплоту, выделяемую при превращении SO2 в серную кислоту, нельзя, поскольку ошибка при этом может быть весьма значительной. На основании термохимических данных можно вычислить, что процесс:
SO2 + 1/2O2 + H2O = H2SO4+
сопровождается выделением 9,42 кДж/г на 1 г угля. Однако эта цифра не может быть принята в основу введения поправки, так как сера, присутствующая в угле в виде сульфата, в реакции образования серной кислоты участия не принимает. Обычные технические определения проводятся более просто. Жидкость из бомбы титруют децинормальным раствором (N /10) едкого натра по метилоранжу и считают всю кислотность на серную кислоту; ошибка при этом сравнительно невелика (если топливо не содержит серы, поправка делается на азотную кислоту). При помощи этих двух поправок учитывается влияние посторонних источников выделения энергии (проволока, образование серной и азотной кислот). Поправка на радиацию может быть вычислена по формуле проф. А.Н.Щукарева:
где δ – искомая поправка, ºС; v - среднее изменение температуры за полуминутный промежуток в начальном периоде, ºС;
В ГОСТ 147-54 для вычисления поправки на радиацию рекомендуется пользоваться формулой Бунте:
где Истинное повышение температуры жидкости в калориметре вычисляют путем вычитания последнего отсчета начального периода Наиболее распространенным прибором для определения теплоты сгорания газообразных топлив является калориметр системы проф. Юнкерса. Принцип его действия заключается в том, что теплота сгорания непрерывного тока испытуемого газа отводится непрерывным током воды. Теплота сгорания и в этом случае находится из количества и повышения температуры протекшей через прибор воды за время горения определенного количества газа. Теплота сгорания жидких топлив в зависимости от их физических свойств определяется в приборах для твердого или газообразного топлива.
5.2.2. Расчет теплоты сгорания топлива
Определение теплоты сгорания твёрдого топлива по данным элементарного химического анализа. Поскольку по закону Гесса теплота сгорания соединения равна разности между теплотами сгорания углерода, водорода и серы и теплотой образования молекулы, то для вычисления теплотворности топлива необходимо знать не только содержание в нем углерода, водорода и серы, но и природу тех соединений, в которых эти элементы присутствуют в топливе. Для топлива тех видов, анализом которых невозможно установить количество и вид соединений элементов горючей массы, построение рациональной формулы для определения теплотворности, естественно, наталкивается на непреодолимые затруднения, в результате чего можно говорить лишь о большей или меньшей степени приближения. В 1843 г., спустя пять лет после смерти известного французского химика П.Дюлонга (правильнее Дюлона), были опубликованы его материалы по подсчету теплоты сгорания твёрдых топлив. Они легли в основу многочисленных вариантов его формулы, построенной исходя из следующих предположений: 1) кислород, содержащийся в горючей массе топлива, полностью связан с водородом; 2) при сгорании водорода в воду (без испарения), не связанного с кислородом, или так называемого «свободного водорода», выделяется такое же количество тепла, как и при сгорании газообразного молекулярного водорода;
3) топливо рассматривается как механическая смесь углерода, свободного водорода и горючей серы, тепло распада молекул не учитывается. Формула Дюлонга предназначена для подсчета высшей теплоты сгорания.Для подсчета низшей теплоты сгорания Бунте в 1891 г. предложил формулу, отличающуюся от формулы Дюлонга тем, что в ней учитывается расход тепла на испарение воды, образующейся при сгорании свободного водорода и содержащейся в топливе влаги (около 2,51 МДж на1 кг влаги).К формуле Бунте близка формула Общества германских инженеров (1899 г.). В несколько измененном виде формулы Бунте и Общества германских инженеров до настоящего времени широко используются в странах Западной Европы. Ф.Шустер придал формулам Дюлонга и Общества германских инженеров следующий вид
Указанные формулы пригодны для подсчета лишь теплоты сгорания каменных углей и приводят к серьезной погрешности при определении теплоты сгорания других видов топлива. Д.И.Менделеев, изучая свойства топлива, убедился в неточности предлагаемых формул (5.11 и 5.12) и ошибочности многих принятых указанными выше авторами положений. Во-первых, теплота сгорания водорода, содержащегося в сложных органических соединениях, образующих твердое топливо, принята ими равной теплоте сгорания молекулярного газообразного водорода – около 142,4 МДж/кг. Во-вторых, совершенно необоснованно весь кислород, содержащийся в горючей массе топлива, признается ими находящимся в химической связи только с водородом. Главным возражением Д.И.Менделеева против общей применимости указанной расчётной модели служит то, «что она представляет топливо как механическую смесь горючих углеводорода и водорода и негорючей воды, не принимая вовсе во внимание того, что при акте образования всякого химического соединения выделяется или поглощается тепло, а потому при горении химических соединений не может выделяться столько же тепла, как и при горении составных начал, из которых они могут образоваться. Притом гипотеза о содержании в топливе всего кислорода в виде воды ни на чем не основана». Д.И.Менделеев задался целью разработать универсальную модель, пригодную для подсчета теплоты сгорания всех видов твердого и жидкого топлива. Теплоту сгорания водорода, входящего в состав органических соединений твердого и жидкого топлива, Д.И.Менделеев признал меньшей, чем газообразного молекулярного водорода, и равной не 142,4 МДж/кг, а 125,6 МДж/кг. Кроме того, он полагал, что кислород находится в химическом соединении не только с водородом, но и углеродом. В соответствии с этим он считал необходимым отказаться от понятия свободного, или “горючего”, водорода и вести подсчет теплоты сгорания топлива, исходя из содержания всего количества водорода в его горючей массе. Снижение теплоты сгорания вследствие содержания в горючей массе кислорода Д.И.Менделеев подсчитал на основании теплоты сгорания ряда видов топлива с различным содержанием кислорода, оно оказалось равным 10,9 МДж на 1 кг кислорода, или. 109,0 кДж на каждый процент его содержания в горючей массе топлива. Для подсчета высшей теплоты сгорания топлива Д.И.Менделеев предложил весьма простую формулу:
Применимость этой формулы была проверена Д.И.Менделеевым путем подсчета теплоты сгорания по данным элементарного состава различных видов горючих материалов, а именно: углерода, клетчатки, каменных углей и нефтепродуктов, теплота сгорания которых была определена экспериментальным путём сжигания в калориметрической бомбе. В результате он пришел к выводу, что предложенная формула дает достаточно точное совпадение с результатами калориметрических определений различных видов топлива. Свою формулу Д.И.Менделеев доложил 6 февраля 1897 г. на заседании Отделения химии Русского физико-химического общества; опубликована она была в том же году. На первый взгляд может показаться, что в формуле Менделеева не учтено содержание в топливе балласта, т.е. влаги, минеральных веществ и азота. В действительности это не так. Содержание балласта в топливе сказывается на понижении подсчитываемой по формуле Д.И.Менделеева теплоты сгорания топлива из-за соответствующего снижения содержания горючих компонентов в рабочей массе. При подсчете низшей теплоты сгорания топлива, т.е. с учетом тепла, расходуемого на испарение воды, образующейся при сгорании водорода и содержащейся в топливе, формула Д.И.Менделеева приобретает следующий вид:
или
Формула Менделеева широко применяется на протяжении свыше 100 лет. За это время было предложено много других формул, основанных на тех же принципах, т.е. на отказе от представления о том, что весь содержащийся в горючей массе топлива кислород связан с водородом. Они близки к формуле Менделеева не только по своему строению, но и по численному значению коэффициентов у углерода, водорода и кислорода. Однако ни авторы этих формул, ни авторы литературных обзоров не упоминают о формуле Менделеева. Для подсчета теплоты сгорания топлива по данным элементарного анализа был предложен также ряд более сложных по построению формул, (например, формула В.Штейера 1926 г.):
Подсчет теплоты сгорания газообразного топлива по компонентному составу. Высшую и низшую теплоту сгорания газообразного топлива посчитывают на основе реакций окисления компонентов и стандартных теплот образования веществ. Алгоритм расчёта указанных характеристик следующий. Составляются реакции окисления всех горючих компонентов газообразного топлива, например, природного газа.
1. СН4 + 2О2 = СО2 + 2Н2О + 2. С2Н6 + 3,5О2 = 2СО2 + 3Н2О + 3. С3Н8 + 5О2 = 3СО2 + 4Н2О +
Для каждого компонента с использованием стандартных теплот образования веществ находятся величины его высшей и низшей теплот сгорания. При этом важно помнить, что теплота сгорания компонента есть тепловой эффект реакции его окисления при условии образования в её продуктах воды соответственно в виде жидкости или газа (водяного пара). Эти величины для каждой реакции находятся с использованием закона Гесса по выражению:
Здесь
1)Для метана
2) для этана
3) для пропана
Таким образом, можно определить значения высшей и низшей теплоты сгорания каждого компонента рассматриваемого газа
Для пересчёта этих величин на 1 м3 рассматриваемого газа их нужно разделить на величину 0,0224, т.е. объём, занимаемый 1 молем любого газа. Указанные характеристики газообразного топлива также могут быть определены по следующим обобщённым формулам, при использовании которых вместо формулы соответствующего компонента нужно подставить его долю (процентное содержание) в 1 м3 рассматриваемого топлива.
+ 1,285 C4H10 + 1,578 C5H12 + 0,628 C2H4 + 0,921 C3H6 + 1,214 C4H8 + + 1,507 C5H10 + 1,465 C6H6 + 0,255 H2S, МДж/м3. (5.17)
+ 1,206 C4H10 + 1,461 C5H12 + 0,590 C2H4 + 0,858 C3H6 + 1,135 C4H8 + + 1,411 C5H10 + 1,403 C6H6 + 0,234 H2S, МДж/м3. (5.18)
Для природных и попутных нефтепромысловых газов с высоким содержанием CH4, включающих помимо метана его гомологи, а также углекислый газ, сероводород и азот, низшую теплоту сгорания можно подсчитать по формуле с округленными коэффициентами:
+ 1,465 C5H12 + 0,251 H2S, МДж/м3. (5.19)
Подсчет теплоты сгорания твердого топлива по данным технического анализа. Высшую и низшую теплоту сгорания твердого топлива можно приближенно подсчитать, не прибегая к определению элементарного состава топлива, на основе данных технического анализа, т.е. определения содержания в топливе влаги, золы, а также выхода кокса и летучих веществ в пересчете на горючую массу топлива. Для определения теплоты сгорания топлива по данным технического анализа предложен ряд формул, предназначенных большей частью для определения теплоты сгорания каменных углей с определенным выходом летучих веществ. В большинстве приведенных формул теплоту сгорания сухого беззольного кокса принимают равной от 33,9 до 34,3 МДж/кг, а теплоту сгорания сухих летучих веществ оценивают в зависимости от их выхода. М.Гуталь предложил для определения высшей теплоты сгорания каменных углей с выходом летучих веществ до 40% следующую формулу:
где K – выход кокса,%; V - выход летучих веществ в процентах на сухую и беззольную массу; a - теплота сгорания летучих веществ угля, МДж/кг. Величина a имеет следующие значения в зависимости от выхода летучих веществ (числитель – процент выхода летучих, знаменатель – теплота сгорания в кДж/кг): 5/607; 10/544; 15/490; 20/456; 25/431; 30/410; 35/394; 40/335. Ф.Шустер предложил для подсчета высшей теплоты сгорания горючей массы следующую формулу
|
|||||||||
|
Последнее изменение этой страницы: 2021-04-20; просмотров: 225; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.12.161.77 (0.097 с.) |
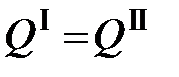 , (5.2)
, (5.2)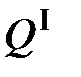 - выделившееся в результате процесса тепло, а
- выделившееся в результате процесса тепло, а 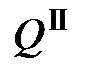 - поглощенное тепло.
- поглощенное тепло.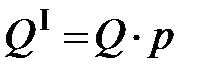 . (5.3)
. (5.3)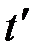 . Но одновременно нагреваются все части прибора калориметра (кожух массой M 1, мешалка массой M 2 и др.). Поэтому полученное тепло составляет
. Но одновременно нагреваются все части прибора калориметра (кожух массой M 1, мешалка массой M 2 и др.). Поэтому полученное тепло составляет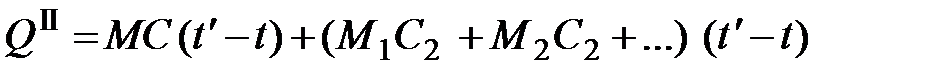 (5.4)
(5.4)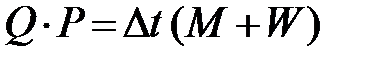 . (5.5)
. (5.5)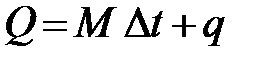 , (5.6)
, (5.6)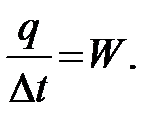 (5.7)
(5.7)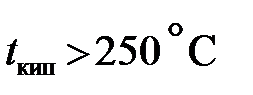 используют кислород и высокое давление, обеспечивающие полноту сжигания.
используют кислород и высокое давление, обеспечивающие полноту сжигания.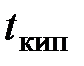 которого меньше
которого меньше 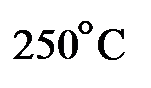 , сжигают в обычных условиях.
, сжигают в обычных условиях.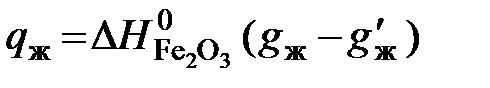 кДж, (5.8)
кДж, (5.8)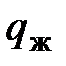 - искомое количество выделенного тепла;
- искомое количество выделенного тепла; 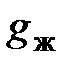 - начальный вес железной проволочки, г;
- начальный вес железной проволочки, г; 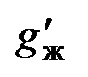 - вес несгоревшего остатка, г;
- вес несгоревшего остатка, г; 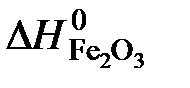 = 6,7 кДж/г – изменение энтальпии в реакции образования Fe2O3 (стандартная теплота образования Fe2O3).
= 6,7 кДж/г – изменение энтальпии в реакции образования Fe2O3 (стандартная теплота образования Fe2O3).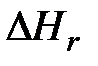
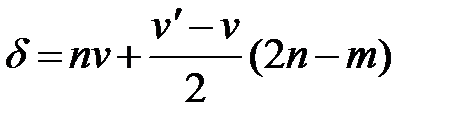 , (5.9)
, (5.9)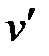 - среднее изменение температуры за полуминутный промежуток в конечном периоде, ºС; n – число промежутков главного периода; m – число интервалов главного периода с быстрым (более 0,33 ºС в сек) подъемом температур.
- среднее изменение температуры за полуминутный промежуток в конечном периоде, ºС; n – число промежутков главного периода; m – число интервалов главного периода с быстрым (более 0,33 ºС в сек) подъемом температур.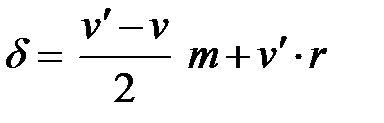 , (5.10)
, (5.10)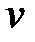 и
и 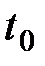 из последнего отсчета главного периода
из последнего отсчета главного периода 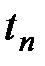 и прибавления к полученной разности вычисленной поправки на радиацию.
и прибавления к полученной разности вычисленной поправки на радиацию.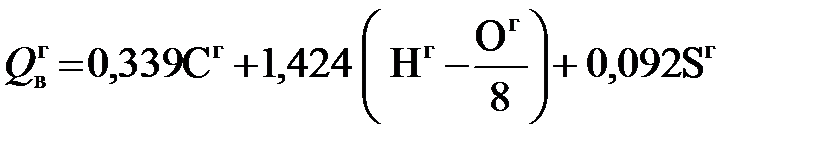 МДж/кг; (5.11)
МДж/кг; (5.11)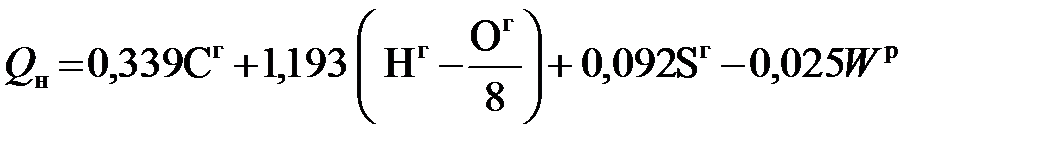 МДж/кг. (5.12)
МДж/кг. (5.12)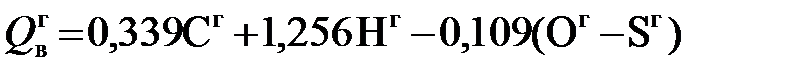 , МДж/кг. (5.13)
, МДж/кг. (5.13)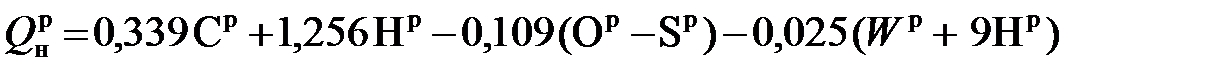 , МДж/кг, (5.14)
, МДж/кг, (5.14)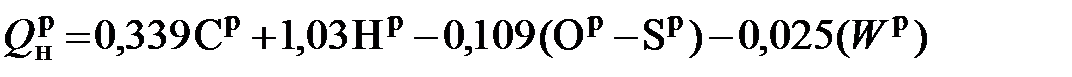 , МДж/кг. (5.15)
, МДж/кг. (5.15)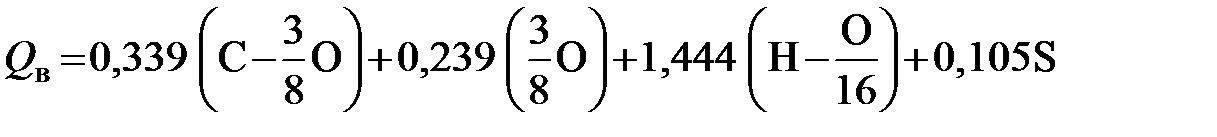 МДж/кг. (5.16)
МДж/кг. (5.16)
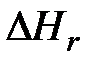 и др.
и др.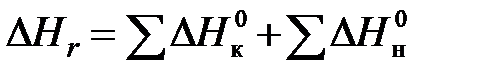 .
.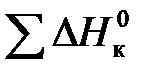 и
и 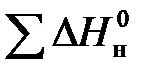 – соответственно стандартные теплоты образования конечных продуктов и начальных веществ реакции.
– соответственно стандартные теплоты образования конечных продуктов и начальных веществ реакции.
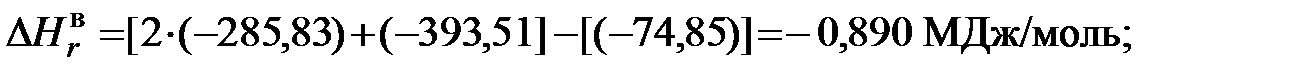
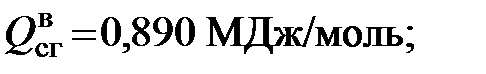
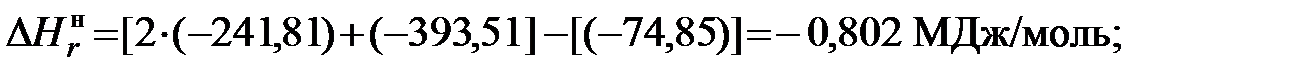
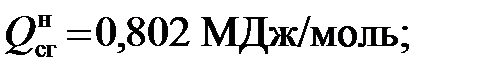
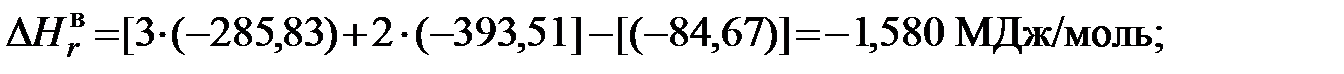
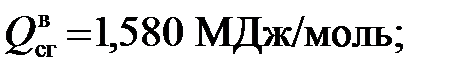
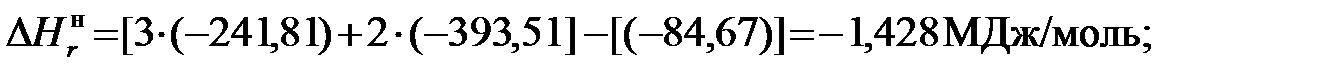
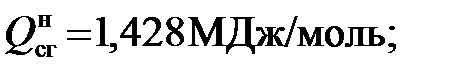
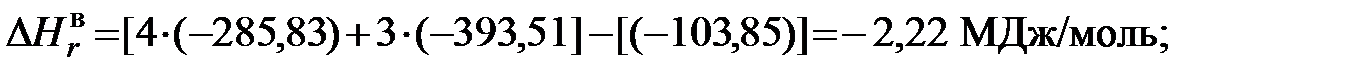
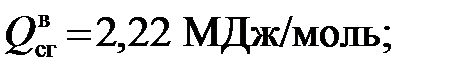
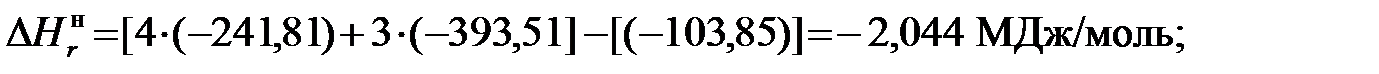
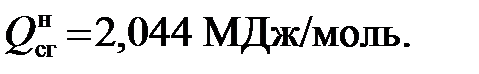
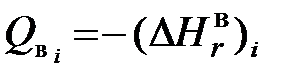 и
и 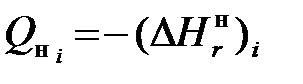 . Зная величины теплот сгорания каждого компонента и его долю в рассматриваемом газе
. Зная величины теплот сгорания каждого компонента и его долю в рассматриваемом газе 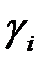 , несложно найти соответствующие характеристики на 1 моль для этого газа:
, несложно найти соответствующие характеристики на 1 моль для этого газа: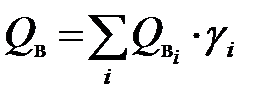 и
и 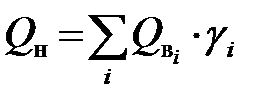 .
.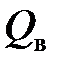 = 0,126 CO + 0,128 H2 + 0,398 CH4 + 0,695 C2H6 + 0,992 C3H8 +
= 0,126 CO + 0,128 H2 + 0,398 CH4 + 0,695 C2H6 + 0,992 C3H8 +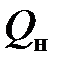 = 0,126 CO + 0,108 H2 + 0,358 CH4 + 0,636 C2H6 + 0,913 C3H8 +
= 0,126 CO + 0,108 H2 + 0,358 CH4 + 0,636 C2H6 + 0,913 C3H8 +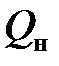 = 0,358 CH4 + 0,628C2H6 + 0,921 C3H8 + 1,172 C4H10 +
= 0,358 CH4 + 0,628C2H6 + 0,921 C3H8 + 1,172 C4H10 +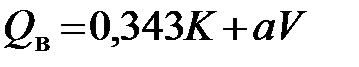 , МДж/кг,
, МДж/кг,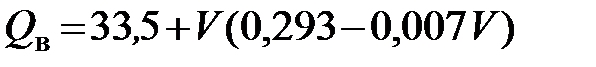 , МДж/кг. (5.20)
, МДж/кг. (5.20)


