Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Выполнение контрольных работСодержание книги
Поиск на нашем сайте
ХИМИЯ
Методическое пособие для студентов факультета лесного хозяйства
Н. Новгород 2018 г. Составитель: доц. Лелеков В.Е.
УДК 541.1:541.10 (075)
ХИМИЯ: Учебное пособие для студентов факультета лесного хозяйства/Нижегородская государственная сельскохозяйственная академия. - Н. Новгород, 2018. 71 с.
Пособие является учебным комплексом для проведения лабораторно-практических занятий по курсу химии и организации самостоятельной работы студентов и содержит: - описание лабораторных работ; - вопросы для самоподготовки к занятиям и зачетные вопросы для оформления отчетов по лабораторным работам; - программы ИРС (индивидуальной заботы студентов); - программы коллоквиумов; - методические рекомендации по написанию реферата. Пособие предназначено для студентов факультета лесного хозяйства. Печатается по решению редакционно-издательского совета НГСХА.
Рецензент: зав. кафедрой таксации НГСХА Логунов Д.В.
Ó Нижегородская государственная сельскохозяйственная академия
Лелеков В.Е.
ВВЕДЕНИЕ
В учебном плане подготовки бакалавров по направлению «Лесное дело» дисциплина «Химия» является базовой и входит в состав математического и естественнонаучного цикла. Она является предшествующей и необходимой для освоения других базовых и вариативных дисциплин естественнонаучного цикла (почвоведение, физиология растений, экология), а также многих дисциплин профессионального цикла (лесное товароведение, древесиноведение, недревесная продукция леса, технология подсочки леса и др.) Место дисциплины «Химия» в структуре ОПП ВО определяет содержание читаемого курса: он является интегрированным и включает в себя разделы общей, неорганической, органической, аналитической и физической химии. Целью и задачей читаемого курса является освоение системных знаний о свойствах, превращениях, анализе химических соединений, необходимых для формирования элементов общекультурных, общепрофессиональных и профессиональных компетенций в соответствии с ФГОС ВО и ООП ВО по направлению подготовки бакалавров 35.03.03. «Лесное дело», утвержденного приказом министерства образования и науки Российской Федерации от 1 октября 2015г № 1082.
При разработке содержания лабораторных работ, зачетных вопросов и программ ИРС авторы руководствовались следующими принципами: - содержание опытов, вопросов и заданий должно быть по возможности профессионально ориентированным и иллюстрировать студенту значение изучения химии в его образовательном процессе; - максимальная индивидуализация процесса обучения, выполнение лабораторных работ малыми группами и вариативность контрольных заданий; - содержание заданий должно стимулировать способности к обобщению и анализу материала; - типы заданий должны развивать навыки работы с учебной и научной литературой, обработки результатов исследования, оформления отчетов и рефератов по выполненной работе.
Пособие предназначено для студентов факультета лесного хозяйства при подготовке бакалавров по направлению «Лесное дело».
2. Принципы организации и проведения
2.1 Домашняя подготовка
Осмысленное выполнение эксперимента требует тщательной домашней подготовки. Она включает: - ознакомление с методикой эксперимента, беседу с преподавателем для определения цели лабораторной работы; - обязательное письменное представление методики в тетради; - письменные ответы на вопросы, заданные перед опытом.
Выполнение эксперимента После допуска к лабораторной работе студент проводит опыты согласно описанной методике и варианту. Химический эксперимент служит углублению и закреплению теоретических знаний, способствует приобретению практических навыков выполнения эксперимента. Результаты выполненных опытов предъявляются преподавателю.
2.3 Составление отчета: требования к оформлению
Представление отчета строго контролируется преподавателем. Обязательно аккуратное оформление. Отчет подписывается преподавателем. Порядок оформления отчета: - формулирование цели работы; - представление методики эксперимента; - таблицы результатов опытов; - уравнения протекающих реакций; - выводы.
Лабораторная работа Лабораторная работа
ПРОГРАММЫ ПК Лабораторная работа Лабораторная работа Свойства буферных растворов
1. Какие растворы называются буферными? 2. Приведите примеры искусственных и естественных буферных систем. 3. Сформулируйте механизм действия буферных растворов. 4. Представьте формулы для расчета рН буферных растворов. 5. Опыт 1 Приготовление буферных растворов Приготовьте по 4 мл буферных растворов: ацетатного (2 см3 раствора СН3СООН, С(СН3СООН) = 0,1 моль/л и 2 см3 раствора СН3СООNa, С(СН3СООNa) = 0,1 моль/л) аммонийного (2 см3 раствора NH4OH, С(NH4OH) = 0,1 моль/л и 2 см3 раствора NH4Cl, С(NH4Cl) = 0,1 моль/л)
1. Определите экспериментально рН обеих буферных смесей. 3. Рассчитайте значения рН указанных буферных растворов и сравните их с экспериментальными.
Опыт 2 Буферное действие В две пробирки налейте по 1 мл ацетатного и аммонийного буферов порознь. В первый буфер внесите 1 каплю одномолярного раствора соляной кислоты, во вторую – 1 каплю одномолярного раствора гидроксида натрия. Растворы перемешать стеклянной палочкой.
2. Изменится ли рН растворов? 3. Объясните механизм буферного действия.
Опыт 3 Влияние разбавления на рН буферного раствора Поместите в пробирку 5 капель приготовленного ацетатного буфера и разбавьте его в 25 раз (добавьте примерно 25 см3 воды). Затем разбавьте смесь еще в 10 раз.
1. Определите экспериментально рН после каждого разбавления и сравните с рН исходного буфера. 2. Используя формулы для расчета рН буферных смесей, объясните полученные результаты. Опыт 4 Потеря буферного действия Налейте в 4 пробирки по 0,5 см3 приготовленного аммонийного буферного раствора, затем добавьте соляной кислоты концентрацией 0,1 моль/л: в первую – 1 каплю, во вторую – 2 капли, в третью – 3 капли, в четвертую – 4 капли.
1. 2. Постройте график в координатах: объем кислоты – рН буферного раствора (объем капли принять равным 0,05 см3). 3. Что такое буферная емкость? 4. Как рассчитывается буферная емкость? 5. При каком объеме (концентрации) кислоты прекращается действие приготовленного буфера?
Лабораторная работа
1. За счет каких сил (типа) удерживают свою гидратную оболочку катионы? 2. Охарактеризуйте способность катионов к взаимодействию с молекулами воды в зависимости от заряда и размера катиона. 3. Используя значения констант ионизации гидроксидов, расположите соли в порядке возрастания склонности к гидролизу:
АlCl3 NH4Cl FeCl3 CuCl2 Al(OH)3 NH4OH Fe(OH)3 Cu(OH)2 1,4·10-9 1,76·10-5 1,82·10-11 3,410-7
Опыт 1 Гидролиз солей по катиону Налейте в две пробирки по 1-2 см3 воды, затем шпателем добавьте несколько кристалликов солей хлорида аммония, хлорида цинка. После перемешивания добавьте по 2-3 капли универсального индикатора или полоски индикаторной бумаги.
1. Определите рН растворов (используя шкалу-эталон). 2. В молекулярном и ионном виде представьте уравнения гидролиза этих солей. 3. Чем отличается процесс гидролиза этих солей? 4. Напишите выражение для расчета константы гидролиза солей по катиону.
Опыт 2 Гидролиз солей по аниону
1. За счет какого типа химической связи анионы удерживают свою гидратную оболочку? 2. Энергия водородной связи между анионом АnОхn- и молекулами воды возрастает в ряду SO42-, PO43-, SiO32- от 7,1 до 35,6 кДж. Какой анион в большей степени подвергается гидролизу?
В две пробирки налейте по 1-2 см3 воды, внесите в них по несколько кристаллов сульфида натрия и карбоната натрия. После растворения солей в пробирки налейте по 2-3 капли индикатора универсального.
1. Определите рН полученных растворов. 2. В молекулярном и ионном виде запишите уравнения гидролиза солей. 3. Какая соль гидролизуется в большей степени (примите во внимание константы диссоциации кислот, образующих соли)? 4. Напишите выражение для расчета константы гидролиза солей по аниону.
Опыт 3 Гидролиз солей по катиону и аниону (необратимый гидролиз) К 4-5 каплям раствора сульфата алюминия прибавьте столько же раствора сульфида натрия.
1. 2. Напишите уравнения реакций обмена между этими солями. 3. Докажите, что образовавшийся осадок не является солью сероводородной кислоты (подействуйте щелочью). 4. Какая же соль подверглась гидролизу?
Опыт 4 Отсутствие гидролиза солей Выберите на реактивной полке соли, не подвергающиеся гидролизу.
1. Экспериментально докажите это, определив рН каждого раствора. 2. Почему эти соли не подвергаются гидролизу?
Опыт 5 Смещение равновесия гидролиза а) Влияние одноименного иона: Кристаллический нитрат свинца растворите в воде. К раствору добавьте несколько капель концентрированной азотной кислоты.
1. Почему раствор мутный? 2. Почему раствор становится прозрачным? 3. В молекулярном и ионном виде представьте уравнения реакции гидролиза.
б) Влияние нагревания: К раствору ацетата натрия добавьте 1-2 капли фенолфталеина и нагрейте смесь до кипения.
2. Влияет ли нагревание на степень гидролиза соли? 3. Напишите уравнение гидролиза ацетата натрия. 4. Объясните различие окраски раствора при нагревании и охлаждении раствора?
Программы ПК Программа коллоквиума Растворы Основные понятия в учении о растворах. Классификация растворов и их роль в жизнедеятельности. Способы выражения концентрации растворов: массовая доля, молярность, молярная концентрация эквивалента вещества, титр, моляльность, мольная доля.
Основы количественного определения веществ в растворах. Метод объемного анализа, титрование. Сущность метода нейтрализации, определение точки эквивалентности, расчет результатов титрования. Коллигативные свойства растворов неэлектролитов и электролитов. Закон Рауля, его следствия. Осмос и его роль в биосистемах. Закон Вант-Гоффа. Теория электролитической диссоциации. Сильные и слабые электролиты. Закон Оствальда. Диссоциация воды. Реакция среды и водородный показатель. Расчет рН среды в растворах электролитов. Буферные растворы, механизм действия и их роль в биосистемах. Реакции обмена в растворах электролитов: условия необратимости и ионные уравнения. Гидролиз солей: типы и сущность гидролиза, реакция среды в растворах солей. Константа и степень гидролиза. Факторы, влияющие на гидролиз. Лабораторная работа Программы ПК Программы ПК Лабораторная работа Углеводороды 1. 2.Охарактеризуйте строение и реакционную способность непредельных углеводородов (алкенов, алкинов, диенов). 3.Сформулируйте отличия в свойствах предельных и непредельных соединений. Опыт 1. Получение и изучение свойств метана Метан получают из безводного уксуснокислого натрия прокаливанием с натронной известью:
СН3СООNa + NaОН → СН4 + Na2СО3
Вначале обезвоживают ацетат натрия, для чего около 3 г соли помещают в фарфоровую чашку и нагревают на сетке при перемешивании. Соль при нагревании переходит в жидкое состояние, растворяясь в своей кристаллизационной воде. Когда кристаллизационная вода испарится, и соль будет в виде порошка, ее охлаждают. Охлажденную соль переносят в ступку, добавляют двойное количество натронной извести и растирают пестиком. Смесь засыпают в сухую пробирку с газоотводной трубкой и прокаливают в пламени газовой горелки. Из газоотводной трубки начинает выделяться метан. - Полученный газ пропускают через: а) раствор перманганата калия КМnО4; б) раствор брома (бромную воду). Наблюдается ли обесцвечивание растворов? Почему? - Проводят реакцию горения метана, поджигая его на выходе из газоотводной трубки.
1. Составьте уравнения реакций всех превращений. 2. На основании проделанного эксперимента обобщите свойства предельных углеводородов. Опыт 2 Получение и изучение свойств этилена В колбу Вюрца помещают 3 мл этанола, 6 мл концентрированной серной кислоты и 0,3 г безводного CuSО4 в качестве катализатора. Закрывают колбу пробкой с газоотводной трубкой и нагревают через асбестовую сетку на пламени горелки. Выделяющийся этилен через газоотводную трубку пропускают: а) через раствор КМnО4 до обесцвечивания, б) через раствор бромной воды также до его полного обесцвечивания. Результаты наблюдений и уравнения реакций записывают в тетрадь.
1. Как будут реагировать с перманганатом калия и бромной водой 2-метилбутен-1 и бутин-1? Составьте уравнения реакций. 2. На основании опыта 2 и вопроса 1 обобщите свойства непредельных углеводородов. 3. Укажите типы реакций (и приведите их схемы), протекающих при действии газообразных Cl2 и HCl на углеводороды: пентан, пентен-2 и пентин-1. Опыт 3 Изучение свойств терпенов Скипидар является одним из важнейших продуктов лесохимии и характеризуется такими показателями качества, как внешний вид (прозрачная жидкость), плотность при 200С (0,855 - 0,863 г/мл), показатель преломления (1,467 – 1,472), температура начала кипения (153 – 1600С) и др. С точки зрения химии скипидар является смесью терпеновых углеводородов. Работа предусматривает изучение строения и свойств терпенов.
1. Дайте определение и классификацию терпеновых углеводородов. 2. Охарактеризуйте строение и свойства терпенов. Чем доказывается их непредельность? 3. Приведите формулы и названия основных компонентов живичного скипидара. Поясните их строение.
Реакции, доказывающие непредельность терпенов В 2 пробирки наливают по 0,5 - 1 мл скипидара и добавляют бромную воду в одну пробирку и КМnО4 в другую, содержимое хорошо встряхивают и наблюдают обесцвечивание реагентов.
1. Составьте уравнения реакций с бромной водой для моно- и бициклических терпенов. Чем отличается протекание этой реакции для лимонена, терпинена и пинена? 2. Составьте схемы реакций с КМnО4 для основных компонентов живичного скипидара. Какие из них наиболее легко окисляются? 3. Сделайте вывод о реакционной способности терпенов.
Лабораторная работа Спирты. Фенолы Представьте классификацию органических соединений с гидроксильной группой. Какие соединения называют спиртами, фенолами?
1. Какие типы превращений обусловлены наличием ОН группы в их составе? В чем отличие в свойствах спиртов и фенолов? 2. Какие представители одноатомных спиртов имеют товарное лесохимическое значение? Как их получают и где применяют? Приведите уравнения реакций. 3. Какой компонент древесной ткани имеет фенольную природу? Приведите формулы и названия структурных компонентов лигнина. 4. Какие многоатомные спирты имеют биологическое значение? В чем оно заключается? Опыт 1 Получение этилата натрия В сухую пробирку наливаем 2 мл этанола С2Н5ОН и помещаем 2-3 кусочка металлического натрия, высушенного в фильтровальной бумаге. Сверху пробирку закрывает второй сухой пробиркой такого же диаметра. Идет бурная реакция спирта с натрием, выделяется водород и собирается в верхней пробирке, образуя с воздухом гремучую смесь. Когда весь натрий прореагирует, закрываем верхнюю пробирку большим пальцем правой руки, подносим к пламени горелки, перевертываем у самого пламени и слышим взрыв. Водород сгорает, на стенках пробирки остаются капельки воды. В нижней пробирке получился раствор этилата натрия в спирте. Выливаем раствор в фарфоровую чашку. Ставим на сетку и осторожно испаряем спирт, чтобы не вспыхнул. Оставшийся осадок алкоголята натрия разлагаем водой, прибавляя ее 2-3 мл. От прибавления фенолфталеина раствор в чашке окрашивается в малиновый цвет, за счет щелочи, образующейся при разложении алкоголята. 2С2Н5ОН + 2Nа → 2С2Н5ОNа + Н2 С2Н5ОNа + Н2О → С2Н5ОН + NаОН Опыт 2 Получение уксусноэтилового эфира (реакция этерификации) В сухую пробирку наливаем 2 мл этанола, 3 мл 100%-ной уксусной кислоты и 1 мл конц. Н2SО4 (ρ = 1,84). Компоненты осторожно перемешиваем, нагреваем до кипения и затем охлаждаем. Доливаем в пробирку воды, при этом уксусноэтиловый эфир собирается сверху. Это бесцветная жидкость, легче воды, с характерным запахом. Н2SО4
О О Опыт 3 Окисление этанола В пробирку наливаем 2-3 мл этанола и 2-3 мл раствора КМnО4 или К2Сr2О7. При нагревании окислители КМnО4 и К2Сr2О7 окисляют этанол по схеме: (О)
а сами восстанавливаются: КМnО4 до бурого МnО2, а К2Сr2О7 до ионов Сr3+, имеющих зеленый цвет. Опыт 4 Получение глицерата меди В две пробирки наливаем по 1 мл 2%-ного раствора СuSО4, затем добавляем в каждую пробирку 10%-ного раствора NаОН дот появления голубого осадка Сu(ОН)2. В одну из пробирок добавляем глицерин, в другую этанол и перемешиваем. В случае с глицерином наблюдаем образование раствора глицерата меди ярко-синего цвета:
СН–ОН + Сu(ОН)2 → СН –О + 2Н2О
Опыт 5 Получение фенолята натрия В пробирку помещаем 2-3 кристалла фенола, прибавляем 0,5 мл воды, перемешиваем до получения эмульсии (фенол плохо растворяется в воде), затем по каплям добавляем 10%-ный раствор NаОН. Эмульсия пропадает, т.к. образуется раствор фенолята натрия: С6Н5ОН + NаОН → С6Н5ОNа + Н2О К полученному раствору фенолята натрия добавляем по каплям 10%-ный раствор НСl, вновь образуется мутность, т. к. фенол выделяется в свободном виде: С6Н5ОNа + НСl → С6Н5ОН + NаСl
Опыт 6 Образование трибромфенола
+ 3 Вr2 →
Опыт 7 Качественная реакция с FeCl 3 В пробирке растворяем 1-2 кристалла фенола в 1 мл воды и добавляем 1 каплю 1%-ного раствора FeCl3. Появляется интенсивная фиолетовая окраска.
Для изученных реакций фенола укажите тип превращений. Сформулируйте отличие химических свойств спиртов и фенолов. В каком процессе химической переработки древесины имеет значение способность фенолов растворяться в щелочах?
Лабораторная работа Смоляные кислоты 1. 2. Какие общие свойства карбоновых кислот проявляют смоляные кислоты? 3. Какие типы реакций придают смоляным кислотам двойные связи? Какое значение имеет сопряженность этих связей? 4. Какие товарные лесохимические продукты получают путем превращений смоляных кислот?
Опыт 1 Изучение растворимости смоляных кислот В сухую чистую пробирку помещают 0,5 г растертой живичной канифоли и добавляют 10 мл растворителя. Пробирку встряхивают в течение 5-10 минут, дают раствору отстояться и оценивают растворимость по следующим критериям: Рп – растворяется полностью; Рнп – растворяется не полностью; Рос – растворяется с образованием осадка. Результаты опыта заносят в таблицу и делают вывод о растворимости смоляных кислот (канифоли).
Опыт 2 Реакции, доказывающие непредельность смоляных кислот В две пробирки помещают по 0,5 г растертой живичной канифоли и растворяют ее в 5 мл гексана или серного эфира. В одну пробирку добавляют бромной воды, а во вторую раствора КМnО4 и энергично встряхивают. Происходит обесцвечивание реагентов.
1. Какая реакция протекает при добавлении бромной воды к смоляным кислотам? Составьте ее для левопимаровой кислоты при соотношении реагентов 1:1. 2. Какая реакция протекает при добавлении КМnО4 к смоляным кислотам? Составьте ее для абиетиновой кислоты.
Опыт 3 Получение канифольного мыла и изучение его свойств В пробирку помещают 0,5 г смоляных кислот растертой живичной канифоли, добавляют 5-6 мл 20%-ного раствора NаОН и нагревают на водяной бане при перемешивании до полного растворения. Полученный раствор взбалтывают несколько раз и наблюдают образование устойчивой пены. Полученный раствор канифольного мыла разливают в три пробирки и добавляют в одну пробирку раствор СаСl2, в другую – раствор Al2(SО4)3, в третью – раствор Н2SО4. Наблюдают выпадение осадков.
1. 2. Составьте уравнения проведенных с мылом реакций. Какое применение имеют резинаты смоляных кислот? Какие кислоты могут выделять смоляные кислоты из их солей?
Опыт 4 Цветные реакции на смоляные кислоты а) Реакция Шторха - Моравского: 0,1 г смоляных кислот живичной канифоли растворяют в пробирке при слабом нагревании в 1-1,5 мл уксусного ангидрида. Раствору дают охладиться, а затем осторожно по стенке пробирки вводят несколько капель Н2SО4 с плотностью 1,53. В случае присутствия смоляных кислот на границе раздела двух слоев жидкости (смоляной раствор уксусного ангидрида и серная кислота) образуется быстро исчезающее красновато-фиолетовое кольцо. б) Реакция Хатер - Сальковского: 0,02 г смоляных кислот растворяют в 2-3 мл хлороформа, вводят в пробирку с равным объемом концентрированной Н2SО4 и взбалтывают. После отстаивания хлороформовый слой окрашивается в кроваво-красный цвет, а затем в устойчивый пурпурный. Если хлороформовый раствор налить тонким слоем на стекло, то первоначальный красный цвет изменяется последовательно на синий, зеленый и желтый. в) Реакции образования резинатов меди и аммиака: 0,1 – 0,2 г смоляных кислот растворяют в 2-3 мл гексана и полученный раствор делят на 2 части. К одной добавляют 3%-ный водный раствор уксуснокислой меди и встряхивают. Органический слой окрашивается в зеленый цвет, а водный почти обесцвечивается за счет образования абиетата меди. Ко второй пробирке добавляют 1-2 капли раствора аммиака с плотностью 0,9 и встряхивают. Выделяется студенистый осадок абиетата аммония. Если концентрация не слишком слаба, то весь раствор затвердевает.
Лабораторная работа
1. Дайте определение и классификацию моносахаридов. 2. Перечислите и напишите таутомерные формы моносахаридов, встречающихся в составе углеводных компонентов древесной ткани. 3. Чем определяется реакционная способность моносахаридов? 4. Среди химических свойств моносахаридов выделите реакции, имеющие: - аналитическое значение; - биологическое значение; - техническое значение. Опыт 1 Доказательство наличия гидроксильных групп в глюкозе Взаимодействие растворов сахаров с гидроокисью меди в щелочном растворе с образованием интенсивно окрашенных в синий цвет хелатных алкоголятов меди доказывает наличие в молекулах сахаров несколько гидроксильных групп, расположенных, расположенных рядом (общая реакция на многотомные спирты). Помещают в пробирку 3-4 капли 0,5%-ного раствора глюкозы и 10 капель 2 н раствора NаОН, к полученной смеси добавляют 3-4 капли 0,2 н раствора СuSО4. Образующийся осадок Сu(ОН)2 растворяется, и получается прозрачный раствор сахарата меди синего цвета. Нагревают осторожно в пламени горелки верхнюю часть раствора до кипения (но не кипятить!), нижнюю часть оставляют для сравнения без нагрева. Через некоторое время нагретая часть раствора меняет синий цвет на оранжево-желтый или красный в результате восстановления глюкозой двухвалентной меди Сu2+ до СuОН и Сu2О.
Н сахарат меди
Описанная реакция называется пробой Троммера и часто применяется для обнаружения в растворе восстанавливающих сахаров.
Опыт 2 Образование сахаров при окислении многоатомных спиртов Глицерин при окислении бромной водой образует смесь простейших моносахаридов: глицеринового альдегида и диоксиацетона.
Глицериновый Диоксиацетон альдегид (кетотриоза) (альдотриоза)
Образование альдотриозы доказывается характерной для альдегидов реакцией восстановления гидроокиси меди Сu(ОН)2 (реакция медного зеркала).
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
| Поделиться: | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||





 1. Определите рН каждого раствора экспериментально.
1. Определите рН каждого раствора экспериментально.


 Определите рН каждого раствора.
Определите рН каждого раствора.
 Гидролиз солей
Гидролиз солей







 Определите рН среды.
Определите рН среды.



 1. Как влияет на состояние равновесия Н2О Н+ + ОН- температура?
1. Как влияет на состояние равновесия Н2О Н+ + ОН- температура?
 Охарактеризуйте строение и реакционную способность предельных углеводородов (по типам превращений).
Охарактеризуйте строение и реакционную способность предельных углеводородов (по типам превращений).













 С2Н5–ОН + НО–С–СН3 С2Н5–О–С–СН3 + Н2О
С2Н5–ОН + НО–С–СН3 С2Н5–О–С–СН3 + Н2О С2Н5ОН СН3–СН=О,
С2Н5ОН СН3–СН=О,
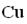 СН2–ОН СН2–О
СН2–ОН СН2–О 
 СН2–ОН СН2–ОН
СН2–ОН СН2–ОН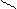
 Одноатомный спирт этанол с Сu(ОН)2 не реагирует.
Одноатомный спирт этанол с Сu(ОН)2 не реагирует.
 На основании опытов 1-4 обобщите свойства спиртов. Сформулируйте отличие одно- и много атомных спиртов по физическим и химическим свойствам. Какой из спиртов будет реагировать с Сu(ОН)2: пентанол-2, пентадиол-1,2, ксилит? Составьте уравнения реакций.
На основании опытов 1-4 обобщите свойства спиртов. Сформулируйте отличие одно- и много атомных спиртов по физическим и химическим свойствам. Какой из спиртов будет реагировать с Сu(ОН)2: пентанол-2, пентадиол-1,2, ксилит? Составьте уравнения реакций. В пробирку помещаем 2-3 кристалла фенола, растворяем в воде до образования прозрачного раствора. К раствору фенола добавляем по каплям бромную воду, выделяется обильный белый осадок трибромфенола с характерным запахом
В пробирку помещаем 2-3 кристалла фенола, растворяем в воде до образования прозрачного раствора. К раствору фенола добавляем по каплям бромную воду, выделяется обильный белый осадок трибромфенола с характерным запахом
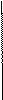

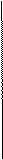
 Какие кислоты называются смоляными? Приведите формулы и название основных смоляных кислот живицы.
Какие кислоты называются смоляными? Приведите формулы и название основных смоляных кислот живицы.
 Составьте реакцию получения мыла и сделайте вывод о свойствах растворов канифольного мыла.
Составьте реакцию получения мыла и сделайте вывод о свойствах растворов канифольного мыла.
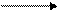 СuSО4 + 2 NаОН Сu(ОН)2 + Nа2SО4
СuSО4 + 2 NаОН Сu(ОН)2 + Nа2SО4


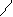
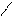

 Н О Н О Н О
Н О Н О Н О

 С С С
С С С
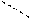




 2 СН–ОН + Сu(ОН)2 СН–ОН
2 СН–ОН + Сu(ОН)2 СН–ОН 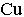 О СН
О СН

 К трем веществам: пентанол-1, ксилит и ксилоза добавили растворы NаОН, СuSО4, а затем смеси нагрели. Напишите схемы протекающих реакций. В каком случае имеет место проба Троммера?
К трем веществам: пентанол-1, ксилит и ксилоза добавили растворы NаОН, СuSО4, а затем смеси нагрели. Напишите схемы протекающих реакций. В каком случае имеет место проба Троммера?
 Вr2 + Н2О НОВr + НВr - бромная вода
Вr2 + Н2О НОВr + НВr - бромная вода
 СН2–ОН СН=О СН2–ОН
СН2–ОН СН=О СН2–ОН