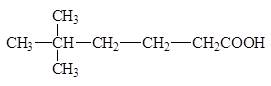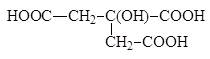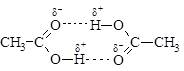Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Мая,группа№11, химия,урок№53.Стр 1 из 4Следующая ⇒
Мая,группа№11, химия,урок№53. Тепа программы: Альдегиды. Тема урока: Определение органического вещества по расчёту связанным с уравнением реакции, записанном в общем виле. Цель: Решение задач. План. Алгоритмы решения задач. Решние задач. Опорный конспект. Определение формулы вещества по продуктам сгорания. Алгоритм решения: 1.Определим молекулярную массу углеводорода:M(CxHy)=M(по газу)хД(газа) 2.Определим количество вещества воды: п (Н2О)= т (Н2О): М(Н2О) 3.Определим количество вещества водорода: п(Н)=2п(Н2О) 4. Определим количество вещества углекислого газа:: п (СО2)= т (СО2): М(СО2)или п (СО2)= V (СО2): Vm 5.Определим количество вещества углерода: п (С)= п (СО2) 6.Определим соотношение С:Н = п (С): п(Н)(оба числа делим на наименьшее из этих чисел) 7.простейшая формула (из пункта 6). 8.Молекулярную массу углеводорода (из первого пункта) делим на молекулярную массу простейшей формулы (из пункта 7): полученное целое число означает – во столько раз надо увеличить число атомов углерода и водорода в простейшей формуле. 9.Определить молекулярную массу истинной формулы (найденной в пункте 8). 10.Записываем ответ – найденную формулу. Решение задачи №1. При полном сгорании углеводорода образовалось 27г воды и 33,6г углекислого газа (н.у.). Относительная плотность углеводорода по аргону равна 1,05. Установите его молекулярную формулу. Дано: т(Н2О)=27г V(СО2)=33,6л Д(по Аr)=1,05 Найти СхНy Решение. 1. Определим молекулярную массу углеводорода: M(CxHy)=M(по газу)хД(газа) M(CxHy)=1,05х40г/моль=42 г/моль 2. Определим количество вещества воды: п (Н2О)= т (Н2О): М(Н2О) п (Н2О)=27г: 18г/моль=1,5моль 3. Определим количество вещества водорода: п(Н)=2п(Н2О) п(Н)=2х1,5моль=3моль 4. Определим количество вещества углекислого газа: п (СО2)= V (СО2): Vm п (СО2)=33,6л: 22,4л/моль=1,5моль 5. Определим количество вещества углерода: п (С)= п (СО2) п (С)= 1,5 моль 6. Соотношение С:Н = п (С): п(Н)=1,5моль:3моль=(1,5:1,5):(3:1,5)=1:2 7. Простейшая формула: СН2 8.42г/моль: 14=3 9. С3Н6 – истинная (М(С3Н6)=36+6=42г/моль 10. Ответ:. С3Н6. Определение формулы вещества, используя общую формулу и уравнения химической реакции.
. Алгоритм решения: 1.Определим количество известного вещества (азота, углекислого газа, водорода, хлороводорода, бромоводорода): п = т: М или п= V: Vm
2.По уравнению сравним количество вещества известного вещества с количеством вещества которое надо определить: 3.Определим молекулярную массу искомого вещества: М=т:п 4.Найдем молекулярную массу искомого вещества используя его общую формулу:(М(СпН2п)=12п+2п=14п) 5.Приравняем значение пункта 3 и пункта 4. 6.Решим уравнение с одним неизвестным, найдем п. 7.Подставим в общую формулу значение п. 8.Запишим ответ. Решение задачи.. При сгорании 1,8г первичного амина выделилось 0,448л азота. Определите молекулярную формулу этого амина. Дано: V(N2)=0,448л т(СпН2п+1NH2)=1,8г Найти СпН2п+1NH2. Решение. 1.Схема реакции: 2 СпН2п+1NH2=N2 (или) 2.Уравнение реакции: 2 СпН2п+1NH2+(6п+3)/2О2=2пСО2+ (2п+3)Н2О+N2 3.Определим количество вещества азота по формуле: п= V: Vm п(N2)=0,448л:22,4л/моль=0,02моль 4.Определим количество вещества амина (используя уравнения: коэффициент стоящий перед амином делим на коэффициент стоящий перед азотом) п(СпН2п+1NH2)=2п(N2)=2х0,02моль=0,04моль 5.Определим молярную массу амина по формуле: М=т:п М((СпН2п+1NH2)=1,8г:0,04моль=45 г/моль 6.Определаем молярную массу амина по общей формуле: М(СпН2п+1NH2)=12п+2п+1+14+2=14п+17г/моль 7.Приравниваем:14п+17=45(решаем уравнение) п=2 8.Подставляем в общую формулу: СпН2п+1NH2=С2Н5NН2 9.Ответ: С2Н5NН2
Решение задачи№11. Дано: т(эфира)=7,4г т(соли)=9,8г т(спирта)=3,2г Найти формулу эфира Решение. 1.Составим уравнения гидролиза сложного эфира: СпН2п+1СООСмН2м+1 +КОН=СпН2п+1СООК + СмН2м+1ОН 2.Находим массу (КОН)= т(соли)+т(спирта)-т(эфира)=(9,8г+3,2г)-7,4г=5,6г 3.Определим п(КОН)=т:М=5,6г:56г/моль=0,1моль 4.По уравнению:п(КОН)=п(соли)=п(спирта)=0,1моль 5.Определим молярную массу соли: М (СпН2п+1СООК)=т:п=9,8г:0,1моль=98г/моль 6.Определим молярную массу по общей формуле:М (СпН2п+1СООК)=12п+2п+1+12+32+39=14п+84 (г/моль) 7.Приравниваем: 14п+84=98 п=1 Формула соли СН3СООК 8.Определим молярную массу спирта: М(СмН2м+1ОН)=3,2г:0,01моль=32г/моль 9.Определим М(СмН2м+1ОН)=12м+2м+1+16+1=14м+18 (г/моль) 10.Приравниваем:14м+18=32 м=1 Формула спирта:СН3ОН 11.Формула эфира: СН3СООСН3-метилацетат.
4. Определение формулы вещества используя уравнения реакции, записанное с помощью общей формулы класса органических соединений.
13.Определите молекулярную формулу алкена, если известно, что одно и тоже количество его, взаимодействуя с различными галогеноводородами образует, соответственно, или 5,23г хлорпроизводного, или 8,2г бромпроизводного.
1.Записываем два уравнения реакций (формулу алкена в общем виде) 2.Находим молекулярные массы продуктов по общим формулам в уравнениях реакций (через п). 3.Находим количества вещества продуктов: n=m:M 4.Приравниваем найденные количества вещества и решаем уравнения. Найденное п подставляем в формулу. Решение задачи №13. Дано: т(СпН2п+1Cl)=5,23г т (СпН2п+1Br)=8,2г Найти СпН2п Решение. 1.Составим уравнения реакций: СпН2п+НСl= СпН2п+1Cl СпН2п + НВr= СпН2п+1Br 2.Определим М(СпН2п+1Cl)=12п+2п+1+35,5=14п+36,5(г/моль) 3.Определим п(СпН2п+1Cl)=т:М=5,23г:(14п+36,5)г/моль 4.Определим М(СпН2п+1Br)=12п+2п+1+80=14п+81(г/моль) 5.Определим п(СпН2п+1Br)=т:М=8,2г: (14п+81)г/моль 6.Приравниваем п(СпН2п+1Cl)= п(СпН2п+1Br) 5,23г:(14п+36,5)г/моль = 8,2г: (14п+81)г/моль (решаем уравнение) п=3 7.Формула алкена: С3Н6 Решение задачи №15. 1.Определяем молекулярную массу органического вещества: М(СхНyОz)=1,82х32г/моль=58г/моль 2.Определяем количество органического вещества: п (СхНyОz)= т:М п (СхНyОz)= 1,74г:58г/моль=0,03моль 3.Пусть Х-п(СО2) в смеси, тогда п(Н2О)-Хмоль(по условию) 4..Масса углекислого газа в смеси: т(СО2)=п(СО2)хМ(СО2)=44Х(г) 5.Масса воды в смеси: п(Н2О)=п(Н2О)хМ(Н2О)=18Х(г) 6.Составим и решим уравнение:44Х+18Х=5,58(масса смеси по условию) Х=0,09(моль) 7.Определим количество вещества углерода (С):п(С)=п(СО2):п(СхНyОz) п(С)=0,09:0,03=3(моль)-число атомов С в органическом веществе. 8.Определим количество вещества водорода (Н): п(Н)=2хп(Н2О): п(СхНyОz) п(Н)=2х0,09:0,03=6(моль)-число атомов водорода в органическом веществе 9.Проверяем наличие кислорода в органическом соединении: М(О)=М(СхНyОz)-М(С)-М(Н) М(О)=58г/моль-(3х12)-(6х1)=16(г/моль) 10.Определяем количество вещества (число атомов) кислорода: п(О)=М(О):Аr(О) п(О)=16:16=1(моль)-число атомов кислорода в органическом веществе. 11.Формула искомого вещества: (С3Н6О).
6. Определение формулы вещества по массовой доли одного из элементов, входящих в вещество. 17.Определите молекулярную формулу дибромалкана, содержащего 85,11% брома. Алгоритм решения задачи. 1. Используя формулу нахождения массовой доли элемента в сложном веществе определяем молекулярную массу вещества: W(элемента)=Ar(элемента)хп(элемента):Мr(вещества) Мr(вещества)=Аr(элемента)хп(элемента):W(элемента), где п(элемента)-число атомов данного элемента 2.Определяем молекулярную массу по общей формуле 3.Приравниваем пункт 1 и пункт 2. Решаем уравнение с одним неизвестным. 4.Записываем формулу, подставив значение п в общую формулу. Решение задачи №17. Дано: W(Br)=85,11% Найти СпН2пВr2 Решение 1.Определяем молекулярную массу дибромалкана: Мr( СпН2пВr2) =Аr(Вr)хп(Br):W(Br) Мr( СпН2пВr2 )=80х2:0,8511=188 2 Определяем молекулярную массу по общей формуле: Мr( СпН2пВr2 )=12п+2п+160=14п+160 3.Приравниваем и решаем уравнение: 14п+160=188 п=2 4.Формула: С2Н4Вr2 Решение задачи №21. Дано: т(эфира)=10,2г тт(СпН2п)=4,48л Найти СпН2п+1ОН Решение. 1.Записываем уравнения реакций: СпН2п+1ОН=СпН2п +Н2О 2СпН2п+1ОН=СпН2п+1ОСпН2п+1+Н2О 2.Определяем количество вещества алкена (газ): п= V: Vm п(СпН2п)=4,48л:22,4л/моль=0,2моль 3.По первому уравнению количество вещества алкена равно количеству вещества спирта. По второму уравнению количество вещества эфира в 2 раза меньше, чем количество вещества спирта т.е. п(СпН2п+1ОСпН2п+1)=0,1моль
4.Определяем молярную массу эфира: М=т:п М=10,2г:0,1моль=102г/моль 5.Определяем молярную массу по общей формуле: М(СпН2п+1ОСпН2п+1)=12п+2п+1+16+12п+2п+1=28п+18 6.Приравниваем и решаем уравнение: 28п+18=102 п=3 7.Формула спирта:С3Н7ОН
Список литературы 1. Габриелян О.С. Химия. Методическое пособие. 10-11 классы. М.: «Дрофа», 2005г. 2. Еремин В.В., Кузьменко Н.Е., Тренин В.И., химия. 10 класс: учебник для общеобразовательных учреждений(базовый уровень). – М.: Дрофа, 2009г. 3. Еремин В.В., Кузьменко Н.Е.,Дроздов А.А., химия. 11 класс: учебник для общеобразовательных учреждений базовый уровень). – М.: Дрофа, 2009г. 4. Рудзитис Г.Е., Фельдман Ф.Г, химия. 10 класс: учебник для общеобразовательных учреждений (базовый уровень). – М.: Просвещение, 2005 5. Рудзитис Г.Е., Фельдман Ф.Г, химия. 11 класс: учебник для общеобразовательных учреждений (базовый уровень). – М.: Просвещение, 2005 Перечень цифровых образовательных ресурсов и Web-сайтов Интернет 1. http://school-collection.edu.ru/. - единая коллекция цифровых образовательных ресурсов: План. Определение. Номенклатура. Физические свойства. Опорный конспект. Определение.
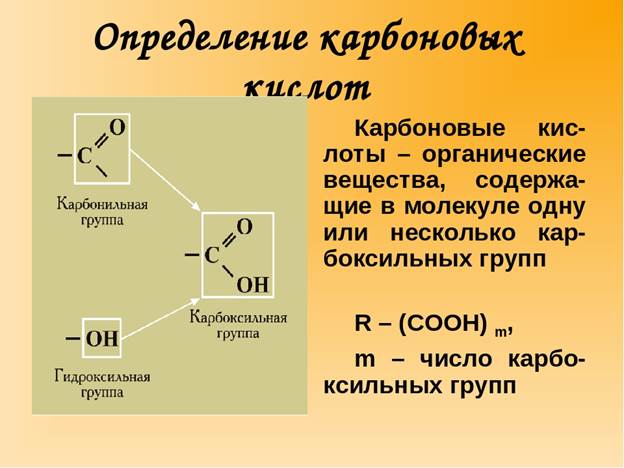
2. Классификация карбоновых кислот Карбоновые кислоты часто называют просто органическими кислотами за их кислотные свойства. Есть еще органические вещества, проявляющие кислотные свойства, например, фенолы. Но именно у карбоновых кислот – эти свойства выражены наиболее сильно. Свойства карбоновых кислот обусловлены наличием в них карбоксильной группы или карбоксила. Карбоксильная группа образована сочетанием двух групп: Карбоксильная группа – СООН – функциональная группа карбоновых кислот. Номенклатура Название кислот образуется так, что к названию предельного углеводорода прибавляется -овая кислота.
5,5-диметил гексан овая кислота
2-этил бутан овая кислота пентан-3-карбоновая кислота
3-карбокси-3-гидроксипентандиовая-1,5 кислота (лимонная) Физические свойства Водородные связи (прочнее, чем у молекул спиртов!) 1. температуры кипения и плавления карбоновых кислот намного выше, не только чем у соответствующих углеводородов, но и чем у спиртов;
2. хорошая растворимость в воде (с увеличением углеводородного радикала уменьшается). Водородные связи в карбоновых кислотах настолько сильны, что эти вещества образуют димеры:
Почему водородные связи между молекулами карбоновых кислот прочнее, чем между молекулами спиртов? Потому что в карбоксильной группе выше положительный заряд на атоме водорода в гидроксиле: электроотрицательный атом кислорода карбонильной группы стягивает электронную плотность с гидроксильной группы. Список литературы 1. Габриелян О.С. Химия. Методическое пособие. 10-11 классы. М.: «Дрофа», 2005г. 2. Еремин В.В., Кузьменко Н.Е., Тренин В.И., химия. 10 класс: учебник для общеобразовательных учреждений(базовый уровень). – М.: Дрофа, 2009г. 3. Еремин В.В., Кузьменко Н.Е.,Дроздов А.А., химия. 11 класс: учебник для общеобразовательных учреждений базовый уровень). – М.: Дрофа, 2009г. 4. Рудзитис Г.Е., Фельдман Ф.Г, химия. 10 класс: учебник для общеобразовательных учреждений (базовый уровень). – М.: Просвещение, 2005 5. Рудзитис Г.Е., Фельдман Ф.Г, химия. 11 класс: учебник для общеобразовательных учреждений (базовый уровень). – М.: Просвещение, 2005 Перечень цифровых образовательных ресурсов и Web-сайтов Интернет 1. http://school-collection.edu.ru/. - единая коллекция цифровых образовательных ресурсов: Мая,группа№11, химия,урок№53. Тепа программы: Альдегиды.
|
||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2021-04-20; просмотров: 66; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.145.44.174 (0.047 с.) |