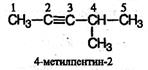Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Тема программы: Углеводороды. Группа№11, химия,урок№20.Стр 1 из 3Следующая ⇒
Группа№11, химия,урок№20. Тема программы: Углеводороды. Тема урока: Алкины. Номенклатура. Изомерия углеродного скелета и положение кратной связи в молекуле. Цель урока:Рассмотреть номенклатуру. Изомерию углеродного скелета и положение кратной связи в молекуле. План. Общая формула гомологического ряда. Структурная изомерия. Содержание темы.
Первый представитель этого класса – ацетилен НС≡СН, в связи с чем алкины также называют ацетиленовыми углеводородами. Ближайшие гомологи ацетилена:
В алкинах с неразветвленной углеродной цепью нумерацию начинают с того конца, ближе к которому находится тройная связь. В названии соответствующего алкана окончание - ан заменяется на - ин. В разветвленных алкинах выбирают главную цепь так, чтобы она содержала тройную связь, даже если она при этом и не будет самой длинной. Перед названием главной цепи указывают номер атома углерода, при котором находится заместитель, и название этого заместителя. Номер после названия главной цепи указывает положение тройной связи, например:
Атомы углерода при тройной связи находятся в состоянии sp-гибридизации. Две σ-связи, образованные гибридными орбиталями, располагаются по одной линии под углом 180° друг к другу; две π-связь образованы при перекрывании двух пар негибридных 2p-орбиталей соседних атомов углерода. Дополнительное связывание двух атомов углерода приводит к тому, что расстояние между ядрами уменьшается, поскольку тройная связь является сочетанием одной а- и двух π-связей. Длина тройной связи С≡С составляет 0,120 нм, что меньше длины как одинарной, так и двойной связи. Энергия тройной связи составляет 828 кДж/моль. Структурная изомерия алкинов обусловлена изомерией углеродного скелета (например, 3-метилбутин-1 и пентин-1) и изомерией положения тройной связи (бутин-1 и бутин-2). Пространственная изомерия для алкинов не характерна. Список литературы
1. Габриелян О.С. Химия. Методическое пособие. 10-11 классы. М.: «Дрофа», 2005г. 2. Еремин В.В., Кузьменко Н.Е., Тренин В.И., химия. 10 класс: учебник для общеобразовательных учреждений(базовый уровень). – М.: Дрофа, 2009г. 3. Еремин В.В., Кузьменко Н.Е.,Дроздов А.А., химия. 11 класс: учебник для общеобразовательных учреждений базовый уровень). – М.: Дрофа, 2009г. 4. Рудзитис Г.Е., Фельдман Ф.Г, химия. 10 класс: учебник для общеобразовательных учреждений (базовый уровень). – М.: Просвещение, 2005 5. Рудзитис Г.Е., Фельдман Ф.Г, химия. 11 класс: учебник для общеобразовательных учреждений (базовый уровень). – М.: Просвещение, 2005 Перечень цифровых образовательных ресурсов и Web-сайтов Интернет 1. http://school-collection.edu.ru/. - единая коллекция цифровых образовательных ресурсов: Структурная изомерия? Уважаемый студент сфотографируйте конспект и пришлите на электронный адрес (dima. levchenko 02@ ramler. ru
Группа№11, химия,урок№21. План. Содержание темы. Алкины – непредельные углеводороды, молекулы которых содержат одну тройную связь, в названии алкинов присутствует суффикс –ин. Общая формула алкинов CnH2n-2 Таблица 1. Гомологический ряд алкинов.
Химические свойства алкинов Для алкинов характерны реакции присоединения, протекающие по нуклеофильному механизму, такие как: — гидрирование – присоединение воды в присутствии 18%-й серной кислоты, сульфата ртути (II) и нагревании до 90С (реакция Кучерова), в результате чего образуются альдегиды СH≡CH +H2O → [CH2 = CH-OH] → CH3-CH = O — галогенирование – присоединение галогенов, протекающее в две стадии СH≡CH +Br2 →CHBr = CHBr + Br2 →CHBr2-CHBr2 — гидрогалогенирование – присоединение галогеноводородов, также, протекающее в две стадии и присоединение второй молекулы галогеноводорода протекает по правилу Марковникова (присоединение галогеноводородов к тройной связи протекает труднее, чем к двойной) СH≡CH +HСl → CH2 = CHCl + HCl → CH3-CHCl2
Для алкинов, имеющий концевую тройную связь, характерно наличие слабых кислотных свойств. Такие алкины способны образовывать соли при взаимодействии с активными металлами: 2R-C≡C-H +2Na →2R-C≡C-Na + H2 Ацетилинид серебра легко образуется и выпадает в осадок при пропускании ацетилена через аммиачный раствор оксида серебра: СH≡CH + Ag2O → Ag- С≡C-Ag↓ + H2O Ацетилен способен тримеризоваться – при пропускании ацетилена над активированным углем при 600С образуется бензол: 3C2H2 → C6H6 Для алкинов характерны реакции окисления и восстановления. Так, алкины легко окисляются перманганатом калия. В результате этой реакции образуются карбоновые кислоты: R- С≡C-R’ +[O] +H2O → R-COOH + R’-COOH В присутствии металлических катализаторов алкины присоединяют молекулы водорода: CH3-C≡CH + H2 → CH3-CH = CH2 + H2 → CH3-CH2-CH3 Качественными реакциями на тройную связь являются реакции обесцвечивания раствора бромной воды и перманганата калия, а также реакция с аммиачным раствором оксида серебра в случае концевого положения тройной связи. Физические свойства алкинов При обычных условиях C2-С4 – газы, С5-С16 – жидкости, начиная с С18 – твердые вещества. Температуры алкинов выше, чем у соответствующих алкенов. Список литературы
1. Габриелян О.С. Химия. Методическое пособие. 10-11 классы. М.: «Дрофа», 2005г. 2. Еремин В.В., Кузьменко Н.Е., Тренин В.И., химия. 10 класс: учебник для общеобразовательных учреждений(базовый уровень). – М.: Дрофа, 2009г. 3. Еремин В.В., Кузьменко Н.Е.,Дроздов А.А., химия. 11 класс: учебник для общеобразовательных учреждений базовый уровень). – М.: Дрофа, 2009г. 4. Рудзитис Г.Е., Фельдман Ф.Г, химия. 10 класс: учебник для общеобразовательных учреждений (базовый уровень). – М.: Просвещение, 2005 5. Рудзитис Г.Е., Фельдман Ф.Г, химия. 11 класс: учебник для общеобразовательных учреждений (базовый уровень). – М.: Просвещение, 2005 Перечень цифровых образовательных ресурсов и Web-сайтов Интернет 1. http://school-collection.edu.ru/. - единая коллекция цифровых образовательных ресурсов: Группа№11, химия,урок№20. Тема программы: Углеводороды.
|
||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2021-04-20; просмотров: 40; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.117.233.54 (0.014 с.) |