
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Лабораторная работа № 5 «обработка результатов химического анализа подземных вод»Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Цель: научиться обрабатывать результаты химического анализа подземных вод и оценивать пригодность подземных вод для питьевого водоснабжения. Задание: 1. Пересчитать результаты анализа из объемной формы выражения (мг/л) в миллиграмм-эквивалентную и процент-эквивалентную. 2. Определить общую жесткость воды и группу по жесткости. 3. Определить тип воды по величине минерализации. 4. Определить тип воды по величине рН. 5. Выразить химический состав формулой Курлова и расписать ее словесно до 25%-экв. 6. Оценить пригодность воды для питьевого водоснабжения. Методика пересчета данных химического анализа. Пересчет данных химического анализа, выраженных в ионной форме в миллиграмм-эквивалентную производится делением количества миллиграммов каждого иона на его эквивалентный вес. Эквивалентный вес химических элементов и соединений: Ca = 20; Mg = 12,18; Na = 23; SO4 = 48,46; Cl = 35,55; HCO3 = 61. Вычислить все виды жесткости: · Сумма всех солей кальция и магния – общая жесткость (Жоб). Она численна равна сумме всех концентраций кальция и магния в мг-экв; · Устранимая (временная) или карбонатная жесткость вызывается наличием в воде одних и тех же гидрокарбонатных и карбонатных солей кальция и магния. Устранимая жесткость – величина экспериментальная и определяется после длительного кипячения пробы. Карбонатная жесткость (Жк) – величина расчетная, вычисляемая по количеству гидрокарбонат- и карбонат- ионов в мг-экв/л, а когда она оказывается больше, чем общая жесткость, ее считают равной общей жесткости; · Некарбонатная (постоянная) жесткость (Жн) равна разности между общей жесткостью и карбонатной.
Жоб = rCa2+ + rMg2+ Жк = rHCO3- + rCO32- Жн = Жоб - Жк
Если используются данные в мг-экв/л, то в формуле катиона и аниона прибавляется r. Например: rCa2+ = 0,40 (размерность не ставится) Минерализация воды определяется содержанием расстворенных минеральных веществ и рассчитывается как арифметическая сумма весовых количеств всех ионов в дм3 воды. При подсчете минерализации суммарное содержание ионов, выраженное в миллиграммах на дм3 переводится в граммы, с округлением до первого знака после запятой. Пример: сумма ионов составляет 12754 миллиграмм, минерализация воды 12,8 г/дм3. Формула Курлова представляет собой дробь (ложную дробь, т.к. операция деления не производится), в числителе которой записывают анионный состав воды в процент-эквивалентах в убывающем порядке, а в знаменателе - катионный. В формулу Курлова не записывают ионы, содержание которых меньше 10 процент-эквивалентов. Перед дробью записывают содержание газов и специфических компонентов, если они имеются в воде и общую минерализацию в граммах на литр. После дроби указывают температуру воды, дебит источника или скважины и величину кислотно-щелочного показателя, если эти данные имеются. Название воды записывают через дефис: сначала анионный, а затем катионный составы, вошедшие в формулу, в порядке возрастания. Кроме того, дается характеристика воды по температуре, показателю рН, жесткости (сумма кальция и магния в миллиграмм-эквивалентах).
Например: Результаты пересчёта химического анализа подземных вод Фенол, мг/л | As3+ | pH |
T воды | Анионы мг-э % |
Жесткость | Катионы, мг-э % |
Минерализация г/л |
ОМЧ в 1 мл | |||||||||
| SO4 | Cl | HCO3 | Ca | Mg | Na | Fe2+ | Fe3+ | |||||||||||
| 0,03 | 0,09 | 7,3 | 12 | 5 | 8 | 87 | 3 | 56 | 19 | 25 | - | - | 1,0 | 20 | ||||
Формула Курлова
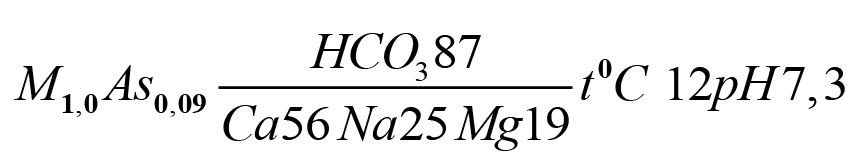
Вода собственно пресная, гидрокарбонатная натриево-кальциевая, холодная, слабощелочная, умеренно жесткая.
По СаНПину:
· общая жесткость воды 3 (норма до 7);
· содержание фенолов 0,03 (норма 0,001) - класс опасности 4. содержание мышьяка 0,09 (норма до 0,05) - класс опасности 2.
· Общее микробное число (ОМЧ) 20 (норма до 50).
Вывод: вода относится ко второму классу опасности (высоко опасная). Использовать ее для питьевого водоснабжения нельзя.
Таблица 5.1. Классификация подземных вод по величине общей минерализации
| Класс вод | Подкласс вод | Минерализация г/л |
| Пресные | Ультрапресные | < 0,2 |
| Умеренно пресные | 0,2-0,5 | |
| Собственно пресные | 0,5-1,0 | |
| Солоноватые | Слабосолоноватые | 1-3 |
| Умеренно солоноватые | 3-10 | |
| Соленые | Слабосоленые | 10-30 |
| Сильносоленые | 30-50 | |
| Рассолы | Слабые | 50-100 |
| Крепкие | 100-320 | |
| Сверхкрепкие | 320-500 | |
| Предельно насыщенные | > 500 |
Таблица 5.2. Классификация подземных вод по жесткости
| Наименование вод | Жесткость, мг-экв |
| Очень мягкие | до 1,5 |
| Мягкие | 1,5-3,0 |
| Умеренно жесткие | 3,0-6,0 |
| Жесткие | 6,0-9,0 |
| Очень жесткие | свыше 9,0 |
Таблица 5.3. Классификация подземных вод по запаху
| Характеристика запаха | Балл |
| Запаха нет | 0 |
| Запах очень слабый | 1 |
| Запах слабый | 2 |
| Запах заметный | 3 |
| Запах отчетливый | 4 |
| Запах очень сильный | 5 |
Таблица 5.4. Классификация подземных вод по температуре
| Наименование воды | Температура, 0С |
| Холодная | до 20 |
| Теплая | 20-37 |
| Горячая | 37-42 |
| Очень горячая | свыше 42 |
Таблица 5.5. Классификация вод по кислотно-щелочному показателю
| Тип воды | рН |
| Сильнокислые | <1,9 |
| Кислые | >1,9—4,1 |
| Слабокислые | >4,1—7,0 |
| Нейтральные | 7 |
| Слабощелочные | >7,0-8,3 |
| Щелочные | >8,3-10,3 |
| Сильнощелочные | >10,3 |
Таблица 5.6. Нормы оценки качества воды для питьевого водоснабжения
| Наименование показателей | Нормы | Показатель вредности | Класс опасности |
| 1. Органолептические показатели | |||
| Запах при 200С и при нагревании воды до 600С, баллы не более | 2 | ||
| Привкус при 200С, баллы не более | 2 | ||
| Цветность | 20-35 | ||
| Присутствие газа Н2S | 0,003 | орг. | 4 |
| Мутность по стандарт шкале мг/л, не более | 1,5 - 2 | ||
| Активная реакция рН | 6-9 | ||
| Сухой остаток мг/л | 1000 | ||
| Общая жесткость, мг экв/л | 7 | ||
| Сульфаты (SO4), мг/л | 500 | ||
| 2. Предельно допустимые концентрации ядохимикатов | |||
| Прометрин, мг/л | 3,0 | ||
| Далапон, мг/л | 2,0 | ||
| Гербициды группы 2,4Д, мг/л | 0,03 | орг. | 2 |
| Тиофос, мг/л | 0,003 | ||
| Метафос, мг/л | 0,02 | ||
| Карбафос, мг/л | 0,05 | ||
| Дихлорэтан, мг/л | 2,0 | ||
| Хлорофос, мг/л | 0,05 | ||
| Препарат М-81, мг/л | 0,001 | ||
| Полихлорпинен, мг/л | 0,2 | ||
| 3. Показатели токсичности органических веществ | |||
| Фенолы, мг/л | 0,001 | орг. | 4 |
| 4.Бактериологические и биохимические показатели | |||
| Общее микробное число в 1 мл | < 50 | ||
| Количество бактерий группы кишечной палочки | 3 | ||
| При использовании жидких сред накопления коли-титр, не менее ПК (полное) биохимическое потребление кислорода мг/л, не более Кислород раствор, мг/л не менее |
300
3,0-6,0 4,0 | ||
| 5. Показатели токсичных химических веществ воды | |||
| Содержание N2O5, мг/л | 29,0 | ||
| Содержание NO2, мг/л | 3,0 | орг. | 2 |
| Содержание NO3, мг/л | 45,0 | орг. | 3 |
| Содержание NH4, мг/л | 2,0 | с.т. | 3 |
| Окисляемость по О2, мг/л По КмnО4, мг/л | До 2,5-3,0 До 5,0 | ||
| Фтор (фториды), мг/л Климатические районы I и II III IV | 0,7-1,5 1,5 1,2 0,7 | с.т. с.т. | 2 2 |
| Хлориды, (Cl), мг/л | 350 | орг. | 4 |
| Сульфиды, мг/л | |||
| Сульфаты(S042-), мг/л | 500 | орг. | 4 |
| Железо (Fe2++Fe3+), мг/л | 0,3 | орг. | 3 |
| Марганец (Mn2+), мг/л | 0,1 | орг. | 3 |
| Медь (Cu2+), мг/л | 1,0 | орг. | 3 |
| Цинк (Zn2+), мг/л | 5,0 | орг. | 3 |
| Остаточный алюминий (Al3+), мг/л | 0,5 | с.т. | 2 |
| Гексаметофосфат (PO4), мг/л | 3,5 | полифосфаты | |
| Ориполифосфат (PO4), мг/л | 3,5 | остаточные | |
| Сурьма (Sb), мг/л | 0,05 | с.т. | 2 |
| Бериллий (Be2+), мг/л | 0,0002 | с.т. | 1 |
| Молибден (Mo2+), мг/л | 0,25 | с.т. | 2 |
| Ртуть (Hq2+), мг/л | 0,0005 | с.т. | 1 |
| Мышьяк (As3+,As5+), мг/л | 0,05 | с.т. | 2 |
| Нитраты (по N), мг/л | 45 | орг. | 3 |
| Свинец (Pb2+), мг/л | 0,03 | с.т. | 2 |
| Селен (Se6+), мг/л | 0,01 | с.т. | 2 |
| Стронций (Sr2+), мг/л | 7,0 | с.т. | 2 |
| Полиакриламид остаточный, мг/л | 2,0 | ||
Примечание:
с.т. - санитарно-токсикологический показатель
орг. - органолептический показатель Классы опасности:
1 - чрезвычайно опасный
2 - высоко опасный
3 - опасный
4 - умеренно опасный
|
| Поделиться: |




