
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Основные стехиометрические законы ⇐ ПредыдущаяСтр 7 из 7
ЗАКОН СОХРАНЕНИЯ МАССЫ. Масса веществ, вступающих в реакцию, равна массе продуктов реакции. ЗАКОН ПОСТОЯНСТВА СОСТАВА. Химическое соединение характеризуется постоянством состава независимо от способов его получения. ЗАКОН АВОГАДРО и следствия из него. В равных объемах газов при одинаковых условиях (температуре и давлении) содержится одинаковое число молекул. Моль любого газа занимает объем 22,4 л при нормальных условиях (0°С, 760 мм рт. ст.). Для приведения объема газа V, заданного при одних условиях (р, Т) к другим, в частности к нормальным (Vo, ро, То =273 К), следует пользоваться уравнением p 0 V 0 / T 0 = pV / T. Из закона постоянства состава следует, что элементы соединяются друг с другом в строго определенных количественных соотношениях. Поэтому в химии были введены понятия эквивалента и моль эквивалентной массы вещества. ЭКВИВАЛЕНТ вещества показывает, какое его количество в молях соединяется с 1 молем атомов водорода или замещает то же количество атомов водорода в химических реакциях. Например, в Н2О эквивалент кислорода равен 1/2 моля, а в CH4 - эквивалент углерода равен 1/4 моля. Моль эквивалентная масса вещества (МЭ) - это масса 1 моля эквивалента этого вещества (г/моль). Моль эквивалентные масса простых и сложных веществ зависят от стехиометрии реакций, в которых участвуют эти вещества. Нахождение эквивалента и моль эквивалентных масс сложных веществ: МЭпростого вещества = Аr/В, где Аr – относительная атомная масса элемента, В – валентность. МЭоксида= М/2·n, где 2 – валентность кислорода, n – количество атомов кислорода. МЭгидроксида = М/ n, где n – количество гидроксогрупп. МЭкислоты = М/ n, где n – количество атомов водорода, участвующих в реакции. МЭсоли= М/В·n, где В – валентность металла, n – количество атомов металла. Пример. Определите моль эквивалентную массу Al в соединении Al2O3. Решение. Атомная масса Al равна 27, а его валентность -3, по формуле получим: МЭAl =27/3 = 9. Ответ: Моль эквивалентную массу Al в соединении Al2O3 равна 9. ЗАКОН ЭКВИВАЛЕНТОВ. Все вещества реагируют в эквивалентных количествах. Существует следствие из закона эквивалентов: отношение массы реагента к величине его моль эквивалентной массы – величина постоянная для данной реакции. Для обобщенной реакции
aA + bB = cC + dD математическое выражение имеет вид:
где: mi – массы реагентов, МЭi – моль эквивалентные массы. Это отношение дает число моль эквивалентов, участвующих в данной реакции, т.е. количество моль эквивалентов любого реагента данной реакции.
Пример. Определите, какой объем кислорода при н.у. эквивалентен 79,5 граммам соды Na2CO3. Решение. Два вещества эквивалентны, если количество моль эквивалентов их одинаково. Задача решается так. Сначала находим моль эквивалентные массы обоих веществ. МЭ кислорода = 8 (г),
32 г занимают объем при н.у. 22,4 л 12 г занимают объем при н.у. x л х = 8,4 л Ответ: 12 г кислорода занимают объем при н.у. 8,4 л.
ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ
Пример 1. Чему равна масса, г, 2 атомов водорода? Какой объем, л, занимают 10 молекул водорода (н.у.)? Решение: 1. Найдем количество вещества: n = N/NA, n = 2/6,02·1023 = 0,33 · 10-23 моля 2. Определим массу 2 атомов водорода, зная, что 1 моль атомов водорода имеет массу 1 г: m = n · M = 0,33 · 10-23 · 1 = 0,33 · 10-23 г. Ответ: m = 0,33 · 10-23 г. 3. Найдем количество вещества: n = N/NA, n = 10/6,02·1023 = 1,66 · 10-23 моля 4. Найдем объем 10 молекул водорода: n = V/VM, V = n · VM = 1,66 · 10-23 · 22,4 = 37,2 ·10-23 л.
Ответ: V = 37,2 ·10-23 л. Пример 2. Исходя их значений квантовых чисел для электронов внешнего энергетического уровня (n=4, l=1, ml= -1; 0; +1; ms = ±1/2; ±1/2; +1/2), напишите электронную формулу этого элемента и укажите его название. Решение: Если n=4, это означает, что внешним энергетическим уровнем является 4-ый уровень. Ели l = 1, то заполнение электронами внешнего энергетического уровня заканчивается р-подуровнем, на котором располагается 5 электронов, так как ms имеет 5 значений: ±1/2; ±1/2; +1/2. Тогда электронная формула элемента принимает следующий вид: 1s22s22p63s23p63d104s2 4 p 5 Порядковый номер элемента равен: 2+2+6+2+6+10+2+5 = 35 Этот элемент Br (находим по таблице Менделеева в соответствии с порядковым номером). Ответ: Br, 1s22s22p63s23p63d104s24p5. Пример 3. Вычислите моль эквивалентную массу KHSO4 в следующих реакциях: 1) KHSO4 + BaCl2 = BaSO4 + KCl + HCl 2) KHSO4 + KOH = K2SO4 + H2O. Решение: Значение моль эквивалента вещества зависит от того, в какой конкретной реакции участвует это вещество. В первой реакции 1 моль KHSO4 взаимодействует с 1 молем BaCl2, а моль эквивалент KHSO4 – с моль эквивалентом BaCl2. Моль эквивалентная масса BaCl2 равна половине его молярной массы, следовательно, моль эквивалентная масса KHSO4 равна половине его молярной массы: Мэ(KHSO4) = ½ М (KHSO4) = 136/2 = 68 г/моль. Во второй реакции 1 моль KHSO4 взаимодействует с 1 молем КОН, а моль эквивалент KHSO4 – с моль эквивалентом КОН. Моль эквивалентная масса КОН равна его молярной массе, а, значит, моль эквивалентная масса KHSO4 равна его молярной массе, то есть 136 г/моль. Пример 4. На нейтрализацию 0,61 г кислоты в кислотных стоках идет 0,7 г гидроксида калия. Определите моль эквивалентную массу кислоты, содержащейся в стоках. Решение: По закону эквивалентов МКОН = 39 + 16 + 1 = 56 г/моль; МЭ КОН = 56/1 = 56 г/моль. Получаем:
Ответ: Моль эквивалентная масса кислоты равна 49 г/моль.
3.4. ИНДИВИДУАЛЬНЫЕ ЗАДАНИЯ К РАЗДЕЛУ “ХИМИЧЕСКАЯ КАРТИНА МИРА”
Вариант 1 1. Сколько молекул содержится в 1 мл водорода при нормальных условиях? 2. Растение в солнечный день поглощает около 5 г СО2 на каждый м2 своей листовой поверхности. Рассчитайте сколько граммов углерода накопит за день подсолнечник, листовая поверхность которого 1,8 м2. 3. Напишите электронную формулу элемента Si, назовите тип семейства (s, p, d), укажите электронные аналоги и чем этот элемент является по химическим свойствам (металл или неметалл). 4. Напишите электронную формулу элемента, исходя из значений квантовых чисел для электронов внешнего энергетического уровня (n=4, l=0, ml=0, ms=±1/2). Укажите название этого элемента. 5. Чему равна эквивалентная масса Fe(OH)2 в следующих реакциях: Fe(OH)2 + HCl = FeOHCl + H2O Fe(OH)2 + 2HCl = FeCl2 + 2H2O 6. Очистка газообразных выбросов от сероводорода производится, пропуская смесь через водный раствор щелочи (NaOH). Сколько NaOH, г, необходимо затратить для связывания 5 л H2S. 7. Вычислить атомную массу двухвалентного металла и определить, какой это металл, если 8,34 г металла окисляются 0,68 л кислорода. Вариант 2 1. Выразить в граммах массу одной молекулы диоксида серы. 2. Человек в сутки выдыхает до 1300 г СО2. Какой объем при н.у. занимает столько СО2? 3. Напишите электронную формулу элемента Cl, назовите тип семейства (s, p, d), укажите электронные аналоги и чем этот элемент является по химическим свойствам (металл или неметалл).
4. Напишите электронную формулу элемента, исходя из значений квантовых чисел для электронов внешнего энергетического уровня (n=3, l=1, ml = -1,0,+1, ms=±1/2). Укажите название этого элемента. 5. Вычислите массу эквивалента хлора, серы и азота в соединениях: HClO2, H2SO3, HNO2. 6. Во время грозы атмосферные электрические разряды из атмосферного азота и кислорода синтезируют оксиды азота, которые с дождевыми водами попадают в почву и накапливаются в форме селитры и азотной кислоты. Сколько азота и кислорода, г, пойдет на взаимодействие, если при этом образуется 500 г азотной кислоты (н.у.)? 7. Одно и то же количество металла соединяется с 0,2 г кислорода и с3,17 г одного из галогенов. Определить эквивалентную массу галогена. Вариант 3 1. Сопоставьте числа молекул, содержащихся в 1 г NH3 и в 1 г N2. В каком случае и во сколько раз число молекул больше? 2. Сколько молей и молекул кислорода содержится во вдыхаемом воздухе объемом 500 мл, если его объемное содержание составляет 21%. 3. Напишите электронную формулу элемента Se, назовите тип семейства (s, p, d), укажите электронные аналоги и чем этот элемент является по химическим свойствам (металл или неметалл). 4. Напишите электронную формулу элемента, исходя из значений квантовых чисел для электронов внешнего энергетического уровня (n=5, l=0, ml=0, ms=+1/2). Укажите название этого элемента. 5. Эквиваленты ли 98 г H2SO4 и 98 г H3PO4, если в результате химических реакций их со щелочью получаются средние соли? Приведите уравнения реакций, ответ подтвердите расчетом. 6. Фотосинтез – образование клетками высших растений, водорослей и некоторыми бактериями органических веществ из воды и углекислого газа атмосферы при участии энергии света с выделением кислорода. Рассчитать, сколько тонн кислорода высвобождается в результате фотосинтеза, если при образовании 1 т растительной продукции связывается 1,5 т углекислого газа. 7. Для растворения 16,8 г металла потребовалось 14,7 г серной кислоты. Определить эквивалентную массу металла и объем выделившегося водорода. Вариант 4 1. Какой объем при н.у. занимают 27∙1021 молекул газа? 2. В организме человека в состоянии покоя от тканей к легким каждую минуту переносится около 180 мл CO2. Сколько молей и молекул CO2 содержится в данном объеме? 3. Напишите электронную формулу элемента Sb, назовите тип семейства (s, p, d), укажите электронные аналоги и чем этот элемент является по химическим свойствам (металл или неметалл).
4. Напишите электронную формулу элемента, исходя из значений квантовых чисел для электронов внешнего энергетического уровня (n=4, l=1, ml= -1,0,+1, ms=±1/2, ±1/2, +1/2). Укажите название этого элемента. 5. Имеется 9 г H2O и 9 г H2O. Эквивалентны ли эти массы? Ответ подтвердите расчетом. 6. Существует группа микроорганизмов, которые способны окислять в среде, насыщенной атмосферным кислородом, закисное железо (например, FeCO3) в гидроксид железа (Fe(OH)3), который может засорять водопроводные трубы при водоснабжении глубинными водами. Сколько FeCO3, г, подвергнется окислению, если образуется 95 г Fe(OH)3. 7. 1 г некоторого металла соединяется с 8,89 г брома и с 1,78 г серы. Найти эквивалентные массы брома и металла, зная, что эквивалентная масса серы равна 16,0 г/моль. Вариант 5 1. Сколько молекул углекислого газа находится в 1 л воздуха, если объемное содержание СО2 составляет 0,03% (условия нормальные)? 2. Определить массу, г, 2 молей NH3, 0,5 моля SO3, 3 молей SO2. Сколько атомов содержится в 5,2 г хрома, 5,2 г алюминия, 10 г кальция? 3. Напишите электронную формулу элемента P, назовите тип семейства (s, p, d), укажите электронные аналоги и чем этот элемент является по химическим свойствам (металл или неметалл). 4. Напишите электронную формулу элемента, исходя из значений квантовых чисел для электронов внешнего энергетического уровня (n=4, l=2, ml= -2,-1,0,+1,+2, ms=+1/2,+1/2,+1/2). Укажите название этого элемента. 5. Во сколько раз масса оксида больше массы металла, если эквивалентная масса металла в 2 раза больше, чем эквивалентная масса кислорода. 6. Нитрифицирующие бактерии, обитающие в почве, получают энергию окислением аммиака, который образуется в почве в результате разложения белков (остатков растений и животных). Сколько кислорода, л, потребляют эти бактерии для окисления 1 л NH3 (н.у.)? 7. При сгорании 5 г металла образуется 9,44 г оксида металла. Определить эквивалентную массу металла. Вариант 6 1. Выразить в граммах массу одной молекулы СО2. 2. Сколько глюкозы (С6Н12О6) (г) израсходует студент на занятии в ВУЗе (90 мин), если за 1 мин расходует 8 кДж энергии. (1 моль глюкозы дает 1520 кДж энергии)? 3. Напишите электронную формулу элемента Br, назовите тип семейства (s, p, d), укажите электронные аналоги и чем этот элемент является по химическим свойствам (металл или неметалл). 4. Напишите электронную формулу элемента, исходя из значений квантовых чисел для электронов внешнего энергетического уровня (n=2, l=1, ml= -1,0,+1, ms=±1/2,+1/2,+1/2). Укажите название этого элемента. 5. Вычислите массу эквивалента марганца, хрома и меди в соединениях: KMnO4, K2Cr2O7, Cu (OH) 2. 6. При отравлениях сероводородом (H2S) необходимо вдыхание свежего воздуха или кислорода с примесью хлора, который реагирует с сероводородом, превращая его в безвредную серу. Сколько хлора, л уйдет на взаимодействие 0, 35 л H2S. 7. Определить эквивалентные массы металла и серы, если 3,24 г металла образует 3,48 г оксида и 3,72 г сульфида. Вариант 7 1. Сколько молей содержится в 1 м3 любого газа при нормальных условиях?
2. При выполнении вольных упражнений мышцы обеих рук за 1 минуту расходуют 12 кДж энергии. Сколько глюкозы (С6Н12О6), г израсходуют мышцы рук за 15 минут? (1 моль глюкозы дает 1520 кДж энергии) 3. Напишите электронную формулу элемента Sn, назовите тип семейства (s, p, d), укажите электронные аналоги и чем этот элемент является по химическим свойствам (металл или неметалл). 4. Напишите электронную формулу элемента, исходя из значений квантовых чисел для электронов внешнего энергетического уровня (n=3, l=1, ml= -1,0,+1, ms=+1/2). Укажите название этого элемента. 5. Эквивалентны ли 46 г натрия и 53 г Na2CO3? Если нет, то какие массы их будут эквивалентны? Если да, то сколько эквивалентов составляют эти массы? 6. Микробиологическое восстановление нитратов (KNO3) c образованием свободного азота (N2), поступающего в атмосферу, называется денитрификацией. Сколько N2, г, выделяется в атмосферу, если восстановлению подвергалось 60 г KNO3. 7. При взаимодействии 5,95 г некоторого вещества с 2,75 г хлороводорода получилось 4,40 г соли. Вычислить эквивалентные массы вещества и образовавшейся соли. Вариант 8 1. Определите массу, г, 3 молей атомов и 3 молей азота (N2). Сколько атомов содержится в 27 г алюминия? 2. Сколько молекул кислорода содержится в 1 л крови, если его содержание составляет 19% от общего объема крови. 3. Напишите электронную формулу элемента Sc, назовите тип семейства (s, p, d), укажите электронные аналоги и чем этот элемент является по химическим свойствам (металл или неметалл). 4. Напишите электронную формулу элемента, исходя из значений квантовых чисел для электронов внешнего энергетического уровня (n=2, l=0, ml=0, ms=±1/2). Укажите название этого элемента. 5. Эквивалентны ли 140 г KOH и 100 г NaOH? Если нет, то какие массы их будут эквивалентны? Если да, то сколько эквивалентов составляют эти массы? 6. Образование метана (СН4) на дне илистых водоемов может происходить за счет восстановления микроорганизмами углекислого газа молекулярным водородом, возникающие при разложении растительных остатков. Сколько метана, г, образуется при восстановлении 1 л CO2? 7. Определить массу гидросульфата натрия (NaHSO4), образующегося при нейтрализации серной кислотой раствора, содержащего 8 г NaOH. Вариант 9 1. Определите массу, г, 2 молей и двух молекул SO3. Сколько атомов содержится в 2 молях аммиака? 2. Сколько молекул азота находится в 1 л воздуха, если объемное содержание N2 составляет 78% (условия нормальные)? 3. Напишите электронную формулу элемента V, назовите тип семейства (s, p, d), укажите электронные аналоги и чем этот элемент является по химическим свойствам (металл или неметалл). 4. Напишите электронную формулу элемента, исходя из значений квантовых чисел для электронов внешнего энергетического уровня (n=2, l=1, ml= -1,0,+1, ms=±1/2,±1/2,+1/2). Укажите название этого элемента. 5. Вычислите эквивалентные массы H2SO4 в реакциях, выраженных уравнениями: H2SO4 + Mg = MgSO4 + H2 H2SO4 + KOH = KHSO4 + H2O 6. Серобактерии получают энергию, окисляя сероводород (H2S) с образованием свободной серы, которая накапливается в цитоплазме этих бактерий. Сколько свободной серы, г, образуется при окислении 10 г H2S. 7. На нейтрализацию 2,45 г кислоты идет 2 г гидроксида натрия. Определить эквивалентную массу кислоты. Вариант 10 1. В земной коре кислород – самый распространенный элемент. Он входит в состав большинства горных пород, а также воды и газообразных оксидов. Рассчитать сколько молей кислорода содержится в одной тонне земной коры, если на его долю приходится 49% от общей массы земной коры? 2. Определите массу, г, 2,5 молей аммиака при н.у. Сколько атомов содержится в 100 л аммиака при н.у.? 3. Напишите электронную формулу элемента Ti, назовите тип семейства (s, p, d), укажите электронные аналоги и чем этот элемент является по химическим свойствам (металл или неметалл). 4. Напишите электронную формулу элемента, исходя из значений квантовых чисел для электронов внешнего энергетического уровня (n=3, l=1, ml= -1,0,+1, ms=±1/2,±1/2,±1/2). Укажите название этого элемента. 5. Вычислите массу эквивалента, г, фосфора, серы и брома в соединениях: HPO3, Al2(SO4)3, HBr. 6. В основе клеточного дыхания лежит постепенное окисление органических соединений, находящихся в клетках живых организмов, которое сопровождается выделением углекислого газа и образованием воды. Сколько СO2, г, и H2O, г, образуется, если кислорода расходуется 2 л. 7. Некоторое количество металла, эквивалентная масса которого равна 28 г/моль, вытесняет из кислоты 700 мл водорода. Определить массу металла. Вариант 11 1. Определите массу, г, 5 молей атомов хлора и 0,5 моля хлора. Сколько атомов находится в 80 г кальция? 2. Сколько белка (г) подверглось окислению, если организм израсходовал на это 200 г О2 (на окисление 1 г белка идет 0,95 л кислорода)? 3. Напишите электронную формулу элемента Mn, назовите тип семейства (s, p, d), укажите электронные аналоги и чем этот элемент является по химическим свойствам (металл или неметалл). 4. Напишите электронную формулу элемента, исходя из значений квантовых чисел для электронов внешнего энергетического уровня (n=2, l=1, ml= -1,0,+1, ms=+1/2,+1/2,+1/2). Укажите название этого элемента. 5. Эквивалентны ли 28 г железа и 56 г FeSO4? Если нет, то какие массы их будут эквивалентны? Если да, то сколько эквивалентов составляют эти массы? 6. Для нейтрализации кислот, содержащихся в м3 сточной воды, требуется 80 г NaOH. Какую массу более дешевого Ca(OH)2 можно использовать для нейтрализации 500 м3 такой воды? 7. При окислении 2,81 г кадмия получено 3,21 г окиси кадмия. Определить эквивалент кадмия. Вариант 12 1. Чему равна масса, г, одного атома водорода? Какой объем, л, занимают 100 молекул водорода (н.у.)? 2. Сколько молей и молекул углекислого газа содержится в 500 мл выдыхаемого воздуха, если объемное содержание его составляет 4,5%. 3. Напишите электронную формулу элемента Mg, назовите тип семейства (s, p, d), укажите электронные аналоги и чем этот элемент является по химическим свойствам (металл или неметалл). 4. Напишите электронную формулу элемента, исходя из значений квантовых чисел для электронов внешнего энергетического уровня (n=5, l=0, ml=0, ms=+1/2). Укажите название этого элемента. 5. Вычислить массу эквивалента азота и марганца в соединениях: N2O5, KMnO4, K2MnO4. 6. В насыщенной атмосферным кислородом среде есть группа микроорганизмов, окисляющих закисное железо (FeCO3) в гидроксид железа (Fe(OH)3), засоряющий водопроводные трубы при водоснабжении глубинными водами. Сколько образуется Fe(OH)3, г, если окислению подвергаются 28 г FeCO3? 7. Масса 1 л кислорода равна 1,4 г. Сколько литров кислорода расходуется при сгорании 21 г магния, эквивалент которого равен 1/2 моля? Вариант 13 1. Сколько молей кислорода находится в 1 л воздуха, если объемное содержание О2 составляет 21% (условия нормальные)? 2. Вычислите массу, г, 4 молей сероводорода. Чему равна масса, г, 4 молекул сероводорода? 3. Напишите электронную формулу элемента Co, назовите тип семейства (s, p, d), укажите электронные аналоги и чем этот элемент является по химическим свойствам (металл или неметалл). 4. Напишите электронную формулу элемента, исходя из значений квантовых чисел для электронов внешнего энергетического уровня (n=3, l=1, ml= -1,0,+1, ms=+1/2). Укажите название этого элемента. 5. При взаимодействии ортофосфорной кислоты со щелочью образовалась соль Na2HPO4. Найти для этого случая значение эквивалентной массы ортофосфорной кислоты. 6. Применение питьевой соды (NaHCO3) в качестве антисептика основано на том, что в результате ее гидролиза (взаимодействия с водой) образуется гидроксид натрия, который губительно действует на микробы. Сколько необходимо взять NaHCO3. г, если образовалось 80 г NaOH. 7. На нейтрализацию 0,336 г кислоты расходуется 0,292 г NaOH. Вычислить эквивалент кислоты. Вариант 14 1. Выразите массу, г, 1 атома железа. Какова масса, г, 3 молей атомов железа? 2. Сколько глюкозы (г) расходует человек за 30 минут бега, учитывая, что мышцы ног человека при беге со средней скоростью расходуют за 1 мин. около 24 кДж энергии. (1 моль глюкозы дает 1520 кДж энергии)? 3. Напишите электронную формулу элемента Ge, назовите тип семейства (s, p, d), укажите электронные аналоги и чем этот элемент является по химическим свойствам (металл или неметалл). 4. Напишите электронную формулу элемента, исходя из значений квантовых чисел для электронов внешнего энергетического уровня (n=4, l=2, ml= -2,-1,0,+1,+2, ms=+1/2,+1/2,+1/2). Укажите название этого элемента. 5. Эквивалентны ли 160 г CuSO4 и 160 г FeSO4? Если нет, то какие массы их будут эквивалентны? Если да, то сколько эквивалентов составляют эти массы? 6. Очистка газообразных выбросов от сероводорода (H2S) производится, пропуская смесь газов через водный раствор щелочи (NaOH). Сколько H2S, г, пойдет на взаимодействие с 75 г NaOH. 7. Сколько хлорида бария BaCl2 требуется на реакцию с 3,55 г сульфата натрия Na2SO4? Вариант 15 1. Одинаково ли число молекул в 0,001 кг H2 и в 0,001 кг О2? В 1 моле H2 и в 1 моле О2? В 1 л H2 и в 1 л О2 при одинаковых условиях? 2. Сколько молей и молекул углекислого газа содержится во вдыхаемом воздухе объемом 300 мл, если его объемное содержание составляет 0,03%(н.у.)? 3. Напишите электронную формулу элемента S, назовите тип семейства (s, p, d), укажите электронные аналоги и чем этот элемент является по химическим свойствам (металл или неметалл). 4. Напишите электронную формулу элемента, исходя из значений квантовых чисел для электронов внешнего энергетического уровня (n=2, l=0, ml=0, ms=±1/2). Укажите название этого элемента. 5. Одинаков ли эквивалент хрома в соединениях CrCl3 и Cr2(SO4)3? Ответ подтвердите расчетом. 6. При отравлениях сероводородом (H2S) необходимо вдыхание свежего воздуха или кислорода с примесью хлора (Cl2), который реагирует с H2S, превращая его в безвредную серу. Сколько сероводорода, л, свяжется с 2,4 л Cl2. 7. К раствору хлорида алюминия прибавили раствор нитрата серебра AgNO3 в избытке. Выпал осадок AgCl, масса которого 2,870 г. Сколько хлорида алюминия содержалось в растворе. Вариант 16 1. Дыхательный объем – это количество воздуха, которое человек вдыхает и выдыхает при спокойном дыхании. Его объем составляет в среднем 500 мл. Рассчитать число молей и молекул кислорода в данном объеме выдыхаемого воздуха, если его объемное содержание составляет 16%. 2. Вычислите массу, г, 1 моля и 1 молекулы SO2? 3. Напишите электронную формулу элемента As, назовите тип семейства (s, p, d), укажите электронные аналоги и чем этот элемент является по химическим свойствам (металл или неметалл). 4. Напишите электронную формулу элемента, исходя из значений квантовых чисел для электронов внешнего энергетического уровня (n=2, l=1, ml= -1,0,+1, ms=±1/2,+1/2,+1/2). Укажите название этого элемента. 5. Чему равна эквивалентная масса H3PO4 в реакции: H3PO4 + NaOH = NaH2PO4 + H2O 6. В основе процесса денитрификации лежит микробиологическое восстановление нитратов (KNO3) с образованием свободного азота (N2), поступающего в атмосферу. Сколько KNO3, г, подвергнется восстановлению, если в атмосферу выделяется 2,6 л N2. 7. 1,6 г кальция и 2,6 г цинка вытесняют из кислоты одинаковые количества водорода. Вычислить эквивалентную массу цинка, зная, что эквивалентная масса кальция равна 20 г/моль.
Вариант 17 1. Чему равны массы, г, 200 л водорода и 200 л кислорода? Какова масса, г, 3 атомов и 3 молей атомов железа? 2. Хлор используется для обеззараживания воды. Рассчитайте, какая масса хлора, г, потребляется для хлорирования 500 г воды, если при хлорировании расходуется 0,002 мг хлора на 1 л воды. 3. Напишите электронную формулу элемента Be, назовите тип семейства (s, p, d), укажите электронные аналоги и чем этот элемент является по химическим свойствам (металл или неметалл). 4. Напишите электронную формулу элемента, исходя из значений квантовых чисел для электронов внешнего энергетического уровня (n=4, l=1, ml= -1,0,+1, ms=+1/2,+1/2,+1/2). Укажите название этого элемента. 5. Эквивалентны ли 100 г KOH и 140 г NaOH? Если нет, то какие массы их будут эквивалентны? Если да, то сколько эквивалентов составляют эти массы? 6. Серобактерии способны окислять сероводород (H2S) с образованием свободной серы (S), которая накапливается в цитоплазме этих бактерий. Сколько H2S, л, подвергнется окислению, если образуется 15 г серы? 7. 0,376 г алюминия при взаимодействии с кислотой вытеснили 0,468 л водорода, измеренного при нормальных условиях. Определить эквивалентный объем водорода, зная, что эквивалентная масса алюминия равна 9 г/моль.
Вариант 18 1. Сколько атомов и сколько молей содержится в 8 г кислорода? 2. За сезон 1 кг листьев поглощает в среднем 60 г SO2, 45 г Cl2. Какие объемы, л, занимают данные массы веществ? 3. Напишите электронную формулу элемента J, назовите тип семейства (s, p, d), укажите электронные аналоги и чем этот элемент является по химическим свойствам (металл или неметалл). 4. Напишите электронную формулу элемента, исходя из значений квантовых чисел для электронов внешнего энергетического уровня (n=2, l=0, ml=0, ms=±1/2). Укажите название этого элемента. 5. Эквиваленты ли 98 г H2SO4 и 98 г H3PO4, если в результате химических реакций их со щелочью получаются средние соли? Приведите уравнения реакций, ответ подтвердите расчетом. 6. Разложение растительных остатков на дне илистых водоемов сопровождается выделением углекислого газа и молекулярного водорода, которые способны при участии микроорганизмов вступать во взаимодействие с образованием метана (СН4). Сколько литров Н2 и СО2 израсходуется на образование 1 л метана? 7. Некоторое количество металла, эквивалентная масса которого равна 28 г/моль, вытесняет из кислоты 0,7 л водорода, измеренного при нормальных условиях. Определить массу металла.
Вариант 19 1. Во сколько раз масса атома углерода, г, больше массы атома водорода? 2. В условиях покоя организмом за 1 минуту потребляется в среднем 300 мл кислорода. Сколько молекул О2 содержится в данном объеме? 3. Напишите электронную формулу элемента Fe, назовите тип семейства (s, p, d), укажите электронные аналоги и чем этот элемент является по химическим свойствам (металл или неметалл). 4. Напишите электронную формулу элемента, исходя из значений квантовых чисел для электронов внешнего энергетического уровня (n=2, l=1, ml= -1,0,+1, ms=±1/2,±1/2,+1/2). Укажите название этого элемента. 5. Эквиваленты ли 53 г Na и 53 г Na2CO3? Если нет, то какие массы их будут эквивалентны? Если да, то сколько эквивалентов составляют эти массы? 6. Процесс усвоения в организме человека сахарозы сводится к ее окислению с образованием CO2 и H2O.Сколько CO2, л, и H2O, г, образуется, если кислорода расходуется 2,3 л? 7. При соединении 5,6 г железа с серой образовалось 8,8 г сульфида железа. Найти эквивалентную массу железа, если известно, что эквивалентная масса серы равна 16 г/моль.
Вариант 20 1. Сколько атомов и сколько молей содержится в 56 г железа и в 100 г FeO? 2. В человеческом организме содержится примерно 25 мг йода (входящего в состав различных соединений), причем половина всей массы йода находится в щитовидной железе. Подсчитайте, сколько атомов йода находится в щитовидной железе и человеческом организме в целом. 3. Напишите электронную формулу элемента кислорода, назовите тип семейства (s, p, d), укажите электронные аналоги и чем этот элемент является по химическим свойствам (металл или неметалл). 4. Напишите электронную формулу элемента, исходя из значений квантовых чисел для электронов внешнего энергетического уровня (n=3, l=1, ml= -1,0,+1, ms=+1/2). Укажите название этого элемента. 5. Эквивалентная масса хлора равна 35,5 г/моль, мольная масса атомов меди равна 64 г/моль. Эквивалентная масса хлорида меди равна 99,5 г/моль. Какова формула хлорида меди. 6. В замкнутых помещениях, например, подводных лодках, для поддержания на определенном уровне кислорода в воздухе используют твердое вещество – оксилит (Na2O2), который в замкнутом пространстве, содержащем большую концентрацию CO2 за счет процессов дыхания, взаимодействует с последним, образуя Na2CO3 и O2. Рассчитайте массу израсходанного оксилита, г, если образуется 12 л O2. 7. Для растворения 6,3 г металла потребовалось 34,3 г серной кислоты. Определить эквивалентную массу металла и объем выделившегося водорода.
Вариант 21 1. Сколько молей SO2 и сколько молей NН3 содержится в 60 г каждого из этих газов? Сколько атомов содержится в 1 г брома? 2. В желудочном соке человека содержание соляной кислоты составляет в среднем 0,5% от массы. Сколько моль НCl содержится в 500 г желудочного сока. 3. Напишите электронную формулу элемента F, назовите тип семейства (s, p, d), укажите электронные аналоги и чем этот элемент является по химическим свойствам (металл или неметалл). 4. Напишите электронную формулу элемента, исходя из значений квантовых чисел для электронов внешнего энергетического уровня (n=5, l=0, ml=0, ms=+1/2). Укажите название этого элемента. 5. Эквиваленты ли 100 г Ca и 100 г CaCO3? Если нет, то какие массы их будут эквивалентны? Если да, то сколько эквивалентов составляют эти массы? 6. Процесс фотосинтеза, происходящий у высших растений, водорослей и некоторых бактерий сводится к поглощению CO2 и выделению молекулярного кислорода (O2). Сколько выделяется O2, г, если поглощено растением 24 г CO2? 7. Определить эквивалентную массу металла, если при сгорании 4,08 г металла образуется 6,8 г оксида металла.
Вариант 22 1. Сколько молей азота находится в 1 л воздуха, если объемное содержание N2 составляет 78% (условия нормальные)? 2. Массовое содержание цинка, входящего в состав яда кобры (ценное лекарство!), равно 0,5%. Сколько атомов цинка потребуется кобре для производства 1 капли (30 мг) своего яда? 3. Напишите электронную формулу элемента Ar, назовите тип семейства (s, p, d), укажите электронные аналоги и чем этот элемент является по химическим свойствам (металл или неметалл). 4. Напишите электронную формулу элемента, исходя из значений квантовых чисел для электронов внешнего энергетического уровня (n=2, l=1, ml= -1,0,+1, ms=+1/2,+1/2,+1/2). Укажите название этого элемента. 5. Эквиваленты ли 128 г Cu и 128 г Cu(OH)2? Если нет, то какие массы их будут эквивалентны? Если да, то сколько эквивалентов составляют эти массы? 6. Во время грозы атмосферные электрические разряды из атмосферного азота и кислорода синтезируют оксиды азота, которые с дождевыми водами попадают в почву и накапливаются в форме селитры и азотной кислоты. Сколько образуется азотной кислоты, г, если израсходовано 35 г N2? 7. На нейтрализацию 9,125 г кислоты идет 10 г гидроксида натрия. Определить эквивалентную массу кислоты. Вариант 23 1. Одним из главных природообразующих минералов является кварц (SiO2). Сколько молей и молекул содержится в 500 г SiO2. 2. Определите число структурных единиц (молекул) в воде массой 36 г. 3. Напишите электронную формулу элемента Sc, назовите тип семейства (s, p, d), укажите электронные аналоги и чем этот элемент является по химическим свойствам (металл или неметалл). 4. Напишите электронную формулу элемента, исходя из значений квантовых чисел для электронов внешнего энергетического уровня (n=4, l=1, ml= -1,0,+1, ms=±1/2, ±1/2, ±1/2). Укажите его название. 5. Найдите моль эквивалентные массы HNO3 и H2S в следующих реакциях: HNO3 + Bi(OH)3 = Bi(OH)2NO3 + H2O H2S + NaOH = NaHS + H2O 6. При очистке газообразных выбросов от сероводорода смесь газов пропускается через водный раствор щелочи (NaOH). Сколько H2S, л, провзаимодействует со 120 г NaOH? 7. При сгорании магния массой 6 г образовалось 9,945 г оксида. Чему равна эквивалентная масса магния? Вариант 24 1. Для борьбы с гниением древесины и с целью ее консервирования применяют ZnSO4 и ZnCl2. Сколько молей и молекул содержится в 100 г каждого из этих веществ? 2. Сколько молей составляют 0,8 кг CuO; 212 кг Na2CO3; 8 г NaOH? 3. Напишите электронную формулу элемента Ni, назовите тип семейства (s, p, d), укажите электронные аналоги и чем этот элемент является по химическим свойствам (металл или неметалл). 4. Напишите электронную формулу элемента, исходя из значений квантовых чисел для электронов внешнего энергетического уровня (n=4, l=0, ml=0, ms=±1/2). Укажите его название. 5. Найдите моль экви
|
|||||||||
|
Последнее изменение этой страницы: 2021-04-12; просмотров: 167; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.223.196.59 (0.181 с.) |
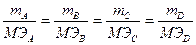
 , где nМЭ – количество моль эквивалентов, mi – масса i-го реагента, МЭi –моль эквивалентная масса i-го реагента.
, где nМЭ – количество моль эквивалентов, mi – масса i-го реагента, МЭi –моль эквивалентная масса i-го реагента. ; где М – молекулярная масса соды равная 106, n – число катионов равное 2, В – валентность (заряд) катиона равная 1. получим, что МЭ соды равен 53 (г). Затем найдем количество моль эквивалентов соды. Для этого нужно массу соды (79,5 г) разделить на величину моль эквивалентной массы (53 г). В результате получим, что соды имеется 1,5 моль эквивалента. Следовательно, кислорода тоже 1,5 моль эквивалента. Теперь найдем массу 1,5 моль эквивалента кислорода. Для этого нужно количество моль эквивалентов (1,5) умножить на величину моль эквивалентной массы (8). В результате получим, что кислорода должно быть 12 г, чтобы эти вещества были эквивалентны. Далее, пользуясь следствием из закона Авогадро, определим какой объем при н.у. занимают 12 г кислорода. Так как 1 моль кислорода при н.у. занимает объем 22,4 л и имеет массу 32 г, а у нас имеется 12 г. Составив пропорцию:
; где М – молекулярная масса соды равная 106, n – число катионов равное 2, В – валентность (заряд) катиона равная 1. получим, что МЭ соды равен 53 (г). Затем найдем количество моль эквивалентов соды. Для этого нужно массу соды (79,5 г) разделить на величину моль эквивалентной массы (53 г). В результате получим, что соды имеется 1,5 моль эквивалента. Следовательно, кислорода тоже 1,5 моль эквивалента. Теперь найдем массу 1,5 моль эквивалента кислорода. Для этого нужно количество моль эквивалентов (1,5) умножить на величину моль эквивалентной массы (8). В результате получим, что кислорода должно быть 12 г, чтобы эти вещества были эквивалентны. Далее, пользуясь следствием из закона Авогадро, определим какой объем при н.у. занимают 12 г кислорода. Так как 1 моль кислорода при н.у. занимает объем 22,4 л и имеет массу 32 г, а у нас имеется 12 г. Составив пропорцию: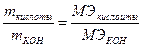
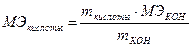 =
= 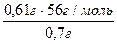 = 48,8 г/моль ≈ 49 г/моль.
= 48,8 г/моль ≈ 49 г/моль.


