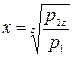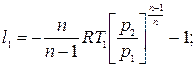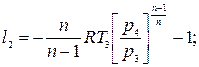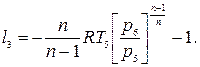Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Внутренняя энергия. ЭнтальпияСодержание книги
Поиск на нашем сайте
Л.В. Лифенцева ТЕПЛОТЕХНИКА
Учебное пособие
Для студентов вузов
Кемерово 2007 УДК 621.1(075)
Л 64 Рецензенты: Е.И. Харлампенков, зав.кафедрой организации и технологии коммерции Кемеровского института (филиала) Российского государственного торгово-экономического университета, доцент, канд. техн. наук; В.И. Петров, ведущий специалист ООО «Еврохолод», доцент, канд. техн. наук
Рекомендовано редакционно-издательским советом Кемеровского технологического института пищевой промышленности
Лифенцева Л.В. Л64 Теплотехника: учебное пособие /Л.В. Лифенцева, Кемеровский технологический институт пищевой промышленности. – Кемерово, 2007. –101 с.
В учебном пособии изложены положения технической термодинамики и теплообмена. Рассмотрены основные законы термодинамики, термодинамический процесс, реальные газы и пары. А также уделено внимание вопросам передачи теплоты в пространстве. Рассмотрены основные процессы холодильной технологии, принципы консервирования холодом. Большое внимание уделено вопросам охлаждения, замораживания, хранения, отепления и размораживание мясных и молочных продуктов. Предназначено для студентов вузов всех форм обучения специальности 270900 «Технология мяса и мясных продуктов», 271100 «Технология молока и молочных продуктов».
УДК 621.1(075)
ISBN
© КемТИПП, 2007 © Л.В. Лифенцева, 2007 ПРЕДИСЛОВИЕ
Предлагаемое учебное пособие построено в соответствии с рабочей программой по термодинамике, теплопередачи и холодильной технологии пищевых продуктов для студентов-технологов мясной и молочной промышленности. В первой части учебного пособия излагается основные законы термодинамики, термодинамические процессы, реальные газы и пары, рассматриваются циклы холодильных машин. В результате изучения теплопередачи студенты овладевают не только теорией, но и методами расчета основных процессов теплообмена. В связи с этим, отдельные вопросы теплопередачи сопровождаются рекомендацией расчетных формул, с помощью которых решаются основные задачи теплообмена. При этом будущий инженер должен достаточно глубоко понимать физические особенности рассматриваемых процессов и уметь математически описать исследуемое явление.
В настоящее время невозможно представить существование человечества без искусственного холода. Это относится и к сфере обитания человека, и ко многим производственным процессам. Искусственный холод, то есть температура ниже окружающей среды, находит все более широкое применение во многих отраслях народного хозяйства. Все сферы человеческой деятельности в этой или иной степени связаны с холодильной техникой. Поэтому вторая часть учебного пособия посвящена использованию искусственного холода в пищевой промышленности, что обеспечивает хранение скоропортящихся продуктов в охлажденном и замороженном виде. Особое внимание уделено видам холодильной обработки мясных и молочных продуктов. Широкое и возрастающее применение искусственного холода требует комплексного изучения и разработки вопросов холодильной технологии пищевых продуктов, а улучшение подготовки инженеров-технологов является одним из основных условий повышения научно-технического уровня применения холода во всех звеньях непрерывной холодильной цепи.
Глава 1. ОСНОВЫ ТЕХНИЧЕСКОЙ ТЕРМОДИНАМИКИ
1.1 Основные положения
Современная термодинамика изучает законы взаимных превращений различных видов энергии в тепловую. Данное название произошло от двух греческих слов: «термо» - теплота и «динамис» - сила, т.е. основа совершаемой работы. Термодинамика основывается на первом законе термодинамики – законе сохранения и превращения энергии. На втором законе термодинамики – законе, определяющем направление протекания термодинамического процесса. Эти законы были сформулированы в XIX веке великим русским ученым М.В.Ломоносовым. Наиболее важным направлением термодинамики является техническая термодинамика, которая занимается изучением процессов взаимного превращения теплоты и работы, а также макроскопические свойства рабочих тел. Зарождение технической термодинамики было связано с изобретением в конце XVIII века паровой машины, работа которой была основана на превращении тепловой энергии в механическую работу. Основы технической термодинамики были заложены французским физиком Сади Карно, учеными Клаузиусом, Майером, Джоулем и другими учеными.
Теплопередачей называется наука, изучающая закономерности самопроизвольных необратимых процессов переноса теплоты в пространстве, который осуществляется теплопроводностью, конвекцией, тепловым излучением или их совокупностью. Теплопередача – это сравнительно молодая наука, заложенная в середине XVIII века Ломоносовым. Особенно интенсивно теплопередача развивалась в XX веке. Большой вклад внесли советские ученые Кирпичев, Михеев,Кружилин…
1.2 Термодинамическая система и параметры состояния
Термодинамической системой называется совокупность материальных тел, которые способны энергетически взаимодействовать друг с другом и с окружающей средой, а также обмениваться с ней массой. Простейшей термодинамической системой является рабочее тело, в качестве которого рассматриваются различные газы, горючие смеси, пары и т.д. Термодинамическая системаназываетсяизолированной, если она не допускает обмена с окружающей средой как теплотой, так и работой. Системаназываетсяполуизолированной, если она допускает обмен либо теплотой, либо работой. Системаназываетсянеизолированной, если она допускает обмен со средой и теплотой, и работой. Система, имеющая во всех своих частях одинаковый состав и физические свойства, называется физически однородной. Однородная термодинамическая система, внутри которой нет поверхности раздела, называется гомогенной(лед, вода, пар), в противном случае – гетерогенной (лед и вода, вода и пар и др.). Состояние термодинамической системы может быть равновесным и не равновесным. Равновеснымназывают такое состояние системы, при котором во всех точках ее объема все параметры состояния (давление, температура, удельный объем и др.) и физические свойства одинаковы. Рабочее тело – тело, посредством которого производится взаимное превращение теплоты и работы. Например, в паровых турбинах рабочим телом является водяной пар, в газовых турбинах – газ, в холодильных установках – фреоны, аммиак, углекислоты и др. Газы и пары легко деформируются (сжимаются, расширяются). Совокупность непрерывно меняющихся состояний рабочего тела называют термодинамическим процессом. Состояние любого вещества в известном агрегатном состоянии (жидком, твердом, газообразном) характеризуется различными физическими величинами. Эти физические величины, поддающиеся непосредственному измерению, получили название параметров состояния. Для характеристики состояния системы (рабочего тела) достаточно трех основных параметров. К ним относятся удельный объем, абсолютное давление, абсолютная температура. У д е л ь н ы й о б ъ е м (v, м3/кг) – это объем единицы массы вещества
где V – полный объем вещества, м3; m – масса вещества, кг. Величина, обратная удельному объему, называется плотностью (ρ, кг/м3); или это есть масса вещества, содержащаяся в единице объема тела: ρ = 1/v Д а в л е н и е – определяется силой, действующей по нормали на единицу поверхности р = Fн/S где р – давление (Па = Н/м2), Fн – нормальная составляющая силы, н; S – площадь поверхности, нормальной к действующей силе, м2. Величина паскаль очень мала и удобнее использовать для практического применения 1 кПа =103 Па и 1 МПа=106 Па. Часто используют и внесистемную единицу – 1бар=105 Па.
До настоящего времени в технике используется также старая единица измерения удельного давления – техническая атмосфера (ат), представляющая собой силу в 1 кгс, действующую на 1см2 площади: 1 ат = 1 кгс/см2 = 104 кгс/м2 = 9,81 · 104 Па = 735,6 мм.рт.ст. Существует несколько систем измерения давлений, отличающихся началом отсчета. Земной шар окружен слоем воздуха толщиной приблизительно 80 км. Воздух имеет массу и под действием сил притяжения Земли (гравитационные силы) создает давление, называемое атмосферным или барометрическим. Это давление непостоянно и изменяется в зависимости от температуры воздуха, влажности и других параметров окружающей среды. Оно зависит также от высоты над уровнем земли, причем с увеличением высоты давление понижается. На уровне моря, принятом за нулевую отметку высоты, атмосферное давление составляет 101325 Па и называется нормальным атмосферным давлением. В разных системах для отсчета давления принимается абсолютный вакуум или атмосферное давление. Если давление измеряют от абсолютного вакуума, то такое давление получило название абсолютного давления. На практике чаще всего измеряют давление, превышающее атмосферное, т.е. за начало отсчета принято атмосферное давление, оно называется избыточным. Если давление жидкости или газа в сосуде будет ниже атмосферного, то такое давление называется вакуумметрическим, а сосуд находится под разрежением или вакуумом. Избыточное и вакуумное давление связаны с абсолютным соотношениями: Рабс = Ратм + Ризб; Рабс = Ратм – Рвак (1.1)
Т е м п е р а т у р а – величина, характеризующая степень нагретости тела. Из физики известно, что температура служит мерой энергии движения молекул вещества. Причем, чем больше энергия движущихся молекул, тем выше его температура. В конце ХVIII века Ломоносовым было предсказано, что должна существовать такая температура, при которой движение молекул полностью должно прекратиться. Причем эта температура должна быть минимально возможной и дальнейшее понижение температуры тела невозможно. Абсолютный нуль температур недостижим, так как тепловое движение молекул неотъемлемый атрибут материи, и прекращение этого движения приводит к нарушению закона сохранения материи. Впоследствии английский ученый Томсон (Кельвин) предложил назвать эту температуру «абсолютным нулем»и начинать от него отсчет температуры.
В настоящее время в отечественной и зарубежной практике используются три основных температурных шкалы: Кельвина, Цельсия и Фарингейта. Шкала Кельвинаявляется основной шкалой в системе СИ. Единицей измерения является Кельвин (К), величина которого равна 1/100 части температурного диапазона между температурой таяния водного льда (273,15 К) и температурой кипения воды (373,15 К). В шкале Кельвина отсутствуют отрицательные температуры. За начало отсчета в шкалеЦельсия (0C) принята температура таяния льда (t0=0 0C) и температура кипения воды tк=100оС. Для тройной точки воды температура равновесия трех фаз при давлении 610,8 Па установлена 273,16 К, или 0,01 0С. Между температурами, выраженными в Кельвинах и в градусах Цельсия, имеется следующее соотношение Т = t + 273,15. (1.2) Если все термодинамические параметры не изменяются во времени и одинаковы во всех точках системы, то такое состояние называется равновесным. Если между различными точками системы имеет место разность температур, давлений и других параметров, то она называется неравновесной.
1.3 Основное уравнение состояния идеального газа Для упрощения выводов в термодинамике введено понятие идеального газа. Идеальнымназывается газ, в котором отсутствуют силы взаимодействия между молекулами, а сами молекулы рассматриваются как материальные точки, не имеющие объема. Идеальный газ описывается уравнением состояния рv = RT (1.3) где R – удельная газовая постоянная, отнесенная к массе газа, равной 1 кг, Дж/(кг·К), представляет собой удельную работу изменения объема, совершаемую 1 кг рабочего тела при изменении его температуры на 1 К в изобарном процессе. Для М, кг газа уравнение состояния имеет вид РV = МRT (1.4) Для одного моля газа РVμ = μRT (1.5) где Vμ-объем киломоля газа, а μR-универсальная газовая постоянная, отнесенная к 1 кмолю - это работа изменения объема, совершаемая 1 кмолем газа при изменении его температуры на 1 К в изобарном процессе. В соответствии с законом Авогадро объем 1 кмоля, одинаковый в одних и тех же условиях для всех идеальных газов, при нормальных физических условиях равен 22,4136 м3, поэтому μR=8314 Дж/(кмоль · К). Газовая постоянная 1 кг газа составляет R=8314/μ.
1.4 Теплоемкость газов
Для того чтобы нагреть два различных вещества с одинаковой массой до одной и той же температуры, необходимо подвести различное количество теплоты. Таким образом, каждое тело по-своему воспринимает теплоту. Способность тела воспринимать теплоту характеризуется теплоемкостью, которая устанавливает соотношение между количеством подведенной к телу теплоты и увеличением температуры. Т е п л о е м к о с т ь ю газа называется количество теплоты, необходимое для изменения температуры тела на 1°С при незначительном изменении его состояния С = δQ/dT. Это полная теплоемкость тела в данном процессе. Теплоемкость не является постоянной величиной, она изменяется с изменением температуры и давления. В некоторых случаях эта зависимость может быть значительной, поэтому вводят понятие средней теплоемкости и истинной теплоемкости. То есть при нагревании на каждый градус изменения температуры расходуется разное количество тепла.
Если для нагревания 1 кг газа от t1 до t2 °С затрачивается q (кДж/кг) тепла, то величина называется средней теплоемкостью в пределах температур от t1 до t2°С: Сm = q/(t2 – t1) (1.6) Чем меньше разность температур t2 и t1 0С, тем более приближается значение средней теплоемкости к значению так называемой истинной теплоемкости. Выражение С = δq/dT определяет теплоемкость при данной температуре или истинную теплоемкость. Теплоемкость зависит от количества вещества: чем больше вещества содержит тело, чем больше теплоты необходимо подвести, чтобы нагреть его до определенной температуры. Численно теплоемкость изменяется в пределах от -∞ до +∞. Удельной теплоемкостью называется количество теплоты, необходимой для нагревания единичного количества вещества на один градус. Обозначается (С) и называется теплоемкостью. Количество вещества может быть измерено в кг, м3, и в кмолях. Поэтому различают: массовую, объемную и мольную теплоемкости. Обычно теплоемкость относят к единице количества вещества и в зависимости от этого различают: - удельную массовую теплоемкость (С) – кДж/кг×К – это количество теплоты, которое необходимо подвести к единице массы вещества (1 кг), чтобы нагреть его на один градус. - удельную объемную теплоемкость (С¢) - кДж/м3×К – это количество теплоты, которое необходимо подвести к 1 м3 вещества, чтобы нагреть его на один градус. - удельную мольную теплоемкость (mС) – кДж/кмоль×К - это количество теплоты, которое необходимо подвести к 1 кмолю вещества, чтобы нагреть его на один градус. Взаимную связь массовой, объемной и мольной теплоемкостей можно выразить следующими соотношениями:
где r - плотность газа. Изменение температуры тела при одинаковом количестве подводимой теплоты зависит от характера процесса. В термодинамических расчетах большое значение имеют теплоемкость при р = const ср = δqp/dT при υ = const сυ = δqυ/dT. Процесс нагревания и охлаждения может происходить при различных условиях. Рассмотрим процесс нагревания одного и того же количества газа (1 кг) в одинаковых цилиндрах при начальных параметрах р1, v1, T1. Поршень первого цилиндра закреплен и не может передвигаться. Второй поршень – подвижный. Начнем подводить теплоту, чтобы нагреть газ в обоих цилиндрах до одинаковой температуры T2. В первом случае теплота будет подводиться при постоянном объеме, т.е. процесс будет изохорным. Во втором цилиндре газ при подводе теплоты может расширяться от v1 до v2 при постоянном давлении, т.е. подвод теплоты будет изобарным. В первом цилиндре газ не расширяется и, следовательно, не совершает работу, вся подведенная теплота расходуется только на нагревание газа до температуры T2 и на повышение давления. Это количество теплоты можно определить по формуле: qv = cv(T2 – T1) (1.8) где qv – количество теплоты при постоянном объеме; cv- изохорная теплоемкость. Во втором цилиндре подведенная теплота расходуется на повышение температуры газа и на перемещение поршня (совершение работы). Количество подведенной теплоты в этом случае определяется: qp = cp(T2 – T1) (1.9) где qp – количество теплоты при постоянном давлении; cp – изобарная теплоемкость. Опыт показывает, что qp>qv, так как cp>cv. Это объясняется тем, что в первом случае теплота затрачивается только на нагревание газа, т.е. на повышение его температуры, а во втором случае газ не только нагревается, но и совершает внешнюю работу. Отсюда получается одно из основных соотношений изохорной и изобарной теплоемкости ср – сv = R (1.10) Уравнение (1.10) называется уравнением Майера. Вторым важным соотношением в теории теплоемкости является отношение теплоемкости при постоянном давлении сp к теплоемкости при постоянном объеме cv; к = ср/сv (1.11) где к – показатель адиабаты или коэффициент Пуассона. Так как cp и cv – величины переменные, зависящие от температуры, то и (к) зависит от температуры. Для одноатомного газа к = μср/μсv = 5/3 = 1,67 (1.11) для двухатомного газа к = μср/μсv = 7/5 = 1,4 (1.12) для трех- и многоатомного газа к = μср/μсv = 1,29 (1.13) Из уравнения Майера (1.10) найдем изобарную теплоемкость ср: ср = R + c (1.14) Подставим в уравнение (1.11): (R + cv)/cv = k (1.15) Разделим каждый член левой части данного выражения на изохорную теплоемкость cv получим:
Отсюда:
Теперь подставим это уравнение в (1.14): Мы получили выражения для определения изохорной и изобарной теплоемкости. Для практических расчетов теплоемкости всех веществ сводятся в таблице, где среднее их значения приводятся в интервале температур от 0 до t. Проще всего количество теплоты определяется в тех случаях, когда теплоемкость рассматривают как величину постоянную. Для 1 кг газа
Если количество тепла определяется его массой, то: и поэтому здесь берется массовая теплоемкость. Если количество вещества задано объемом при нормальных условиях, то: и поэтому здесь берется объемная теплоемкость.
Рис.1.6. Обратный обратимый цикл Карно
Из точки 1 с параметрами Р1, Т1, v1 рабочее тело адиабатно расширяется до состояния 2 (процесс 1-2) и соединяется с источником низкой температуры. Дальнейшее расширение (процесс 2-3) происходит с подводом теплоты q2 к рабочему телу. Протекает процесс изотермического расширения. В точке 3 тело вновь изолируется от источника теплоты и в процессе 3-4 адиабатно сжимается с повышением температуры от Т2 до Т1. В точке 4 рабочее тело соединяется с источником высокой температуры, и дальнейшее сжатие происходит по изотерме 4-1 с отводом теплоты q1 к высокотемпературному источнику. Рабочее тело возвращается в свое первоначальное состояние, цикл замыкается. Холодильный коэффициент обратного цикла Карно равен: Из анализа формулы (1.37) вытекает следующее: 1. Холодильный коэффициент цикла зависит от температур горячего и холодного источников и не зависит от природы вещества. 2. Значение холодильного коэффициента цикла тем больше, чем меньше разность температур горячего и холодного источников. 3. Значение холодильного коэффициента цикла меняется в пределах от 0 до бесконечности.
Сжатие газов и паров
Сжатые газы и пары широко используются в пищевой и перерабатывающей отраслях, строительстве, системах газоснабжения и др. Для их получения служат компрессоры объемного или центробежного сжатия. Компрессор паровой холодильной машины является одним из четырех основных элементов и предназначен для поддерживания в испарителе низкого давления кипения, сжатия хладагента от давления кипения до давления конденсации и последующего нагнетания хладагента в конденсатор. Компрессора различаются по следующим основным признакам: - по принципу действия компрессоры разделяют на поршневые, ротационные, винтовые, спиральные, центробежные. Компрессор, включенный в состав холодильной машины, обеспечивает ее холодопроизводительность. Компрессоры бывают малой холодопроизводительности до 12 кВт; средней от 12 до 90 кВт; большой холодопроизводительности, свыше 90 кВт; - по создаваемому давлению (низкого давления - до 10 бар, среднего - до 100 бар, высокого - до 1000 бар); - по числу степеней сжатия: одно и многоступенчатые; - по роду холодильного агента: аммиачные, хладоновые и универсальные; - по устройству кривошипно-шатунного механизма: простого действия и двойного действия; - по числу цилиндров: одно -, двух -, и многоцилиндровые (до 16 цилиндров). Компрессора отличаются друг от друга конструктивно, но с точки зрения термодинамики протекающие в компрессорах процессы совершенно одинаковы. Поэтому для наглядности рассмотрим принцип действия поршневого компрессора. При маркировке поршневых компрессоров применяют следующие обозначения: П-поршневой; Ф-хладоновый; А-аммиачный; В-вертикальный; V- v-образный; VV-веерообразный; Б-бессальниковый; О-опозитный, Г-герметичный. Цифры после букв обозначают холодопроизводительность (кВт). Компрессор состоит (рис. 2.1) из цилиндра 1, поршня 2, всасывающего клапана 3 и нагнетательного клапана 4. Рабочий процесс совершается за два хода поршня или за один оборот коленчатого вала. При движении поршня вправо через открытый всасывающий клапан газ поступает в цилиндр. При обратном движении поршня (влево) всасывающий клапан закрывается и происходит сжатие газа до определенного давления, при котором открывается нагнетательный клапан и производится нагнетание газа в резервуар. Компрессор называется идеальным, если сжатый в цилиндре газ полностью, без остатка, выталкивается поршнем; отсутствуют потери энергии в клапанах; отсутствуют утечки и перетечки газа через неплотности; отсутствуют силы трения поршня о цилиндр. Теоретическая индикаторная диаграмма идеального поршневого ком-рессора показана на рис. 2.1. На диаграмме линия 4 -1 - называется линией всасывания; 1-2 - процесс сжатия по изотерме; 1-2" - процесс сжатия по адиабате; 1-2' - политропный процесс сжатия; 2-3 - линия нагнетания; 3-4 -условная линия, замыкающая цикл. Следует отметить, что линии всасывания 4 -1 и нагнетания 2-3 не изображают термодинамические процессы, т.к. состояние рабочего тела здесь не меняется, а меняется лишь его количество.
Рис. 2.1.
Термодинамический расчет компрессора выполняется с целью определения работы, затрачиваемой на сжатие, что, в свою очередь, дает возможность определить мощность приводного двигателя.
при изотермическом сжатии при адиабатном сжатии По аналогии с последней формулой можно записать выражение для подсчета в случае политропного сжатия Таким образом, сжатие по изотерме дает наименьшую площадь и, следовательно, наименьшую затрату работы. Наибольшая затрата работы получается при адиабатном сжатии. Действительная индикаторная диаграмма одноступенчатого компрессора представлена на рис.2.2. На этой диаграмме процесс всасывания изображается линией 4-1, сжатие - 1-2, нагнетание - 2-3. Линия 3-4 характеризует процесс расширения газа, оставшегося во вредном пространстве. Вредным пространством называется некоторый свободный объем V0 между поршнем и крышкой цилиндра в момент нахождения поршня в крайнем верхнем положении. Его объем составляет 4-10 % от рабочего объема Vh, цилиндра. После нагнетания газ, оставшийся во вредном пространстве, имеет давление нагнетания p2. При обратном движении поршня происходит расширение газа, оставшегося во вредном пространстве. Всасывание новой порции газа начинается лишь тогда, когда давление расширяющегося в цилиндре газа станет меньше давления всасывания р1 (окружающей среды). При этом всасывание начинается только в точке 4 и в цилиндр поступит новая порция газа V = Vh - V0, объем которой меньше рабочего объема Vh.
Рис. 2.2.
Таким образом, отличие действительной индикаторной диаграммы одноступенчатого компрессора от теоретической (рис. 2.1) заключается в наличии вредного пространства в реальном компрессоре, а также наличием потерь на дросселирование во всасывающем и нагнетательном клапанах. Вследствие этого всасывание новой порции газа в цилиндр происходит при давлении, меньшем р1 а нагнетание - при давлении, большем давления р2 в нагнетательном трубопроводе. Вредное пространство уменьшает количество всасываемого газа и, следовательно, уменьшает производительность компрессора. Степень использования рабочего объема цилиндра оценивается объемным кпд компрессора
Объемный кпд уменьшается с увеличением объема вредного пространства, т.к. в этом случае уменьшается объем всасываемого в цилиндр газа и при которой величине V λv может стать равным нулю. Объемный к.п.д. уменьшается также и с повышением давления сжатия.
2.2 Мощность привода и коэффициенты полезного действия компрессора
В энергетике под кпд обычно понимают отношение полезно используемой энергии ко всей затраченной. И чем выше процент полезно используемой энергии из всего ее затраченного количества, тем выше кпд. В случае компрессорных машин такое определение кпд оказывается неприемлемым. Поэтому для оценки степени совершенства реальных компрессорных машин их сравнивают с идеальными. При этом для охлаждаемых компрессоров вводится изотермический кпд
где l из - работа на привод идеального компрессора при изотермическом сжатии; l д - действительная работа на привод реального охлаждаемого компрессора; Nиз = ml из, Nд - соответствующие мощности приводных двигателей; m - массовая производительность компрессора. При расходе газа G кг/с затраченная работа определяется по формуле Отсюда мощность приводного двигателя в ваттах (Вт) будет
Для неохлаждаемых машин вводится адиабатический кпд.
где l ад - работа на привод идеального компрессора при адиабатическом сжатии. Значения ηиз и ηад для различных типов компрессоров определяются из заводских испытаний и указываются в справочниках. Мощность двигателя для привода компрессора при изотермическом сжатии будет определяться по формуле
Адиабатный и изотермический процессы сжатия могут рассматриваться лишь как теоретические. В реальном компрессоре процесс сжатия происходит по политропе. Формула для определения эффективной мощности в политропном процессе сжатия с учетом потерь на трение, влияния вредного пространства, а также уменьшения подачи из-за нагрева газа имеет вид
где l п - работа на привод компрессора при политропном сжатии; ηп - кпд компрессора при политропном сжатии; ηм - механический кпд, учитывающий потери на трение. Работа l п определяется по формуле (2.3), где показатель политропы п находится, как правило, по параметрам газа в начале и конце процесса сжатия.
2.3 Многоступенчатый компрессор
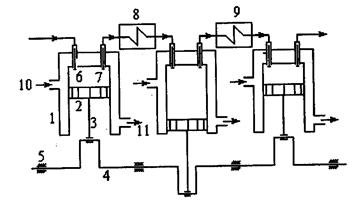
Для получения газов высокого давления применяют многоступенчатые компрессоры. В них сжатие газа осуществляется политропно в нескольких последовательно соединенных цилиндрах с промежуточным охлаждением газа после сжатия в каждом цилиндре. Принципиальная схема многоступенчатого компрессора, состоящего из трех ступеней, представлена на рис. 2.3. Здесь: 1 - цилиндр; 2 - поршень; 3 - шатун; 4 - коленчатый вал; 5 - подшипник; 6 - всасывающий клапан; 7 - нагнетательный клапан; 8, 9 - промежуточные охладители. В направлении стрелок 10, 11 осуществляется вход и выход охлаждающей воды.
Рис. 2.3
Принцип работы многоступенчатого компрессора состоит в следующем. Через клапан 6 первой ступени происходит всасывание газа. После сжатия газ через охладитель 8 направляется во вторую ступень компрессора. Причем всасывание газа во второй ступени происходит при давлении сжатия ступени. Всасывание газа в третьей ступени выполняется через промежуточный охладитель 9 при давлении сжатия во второй ступени. Через нагнетательный клапан третьей ступени осуществляется нагнетание газа в резервуар.
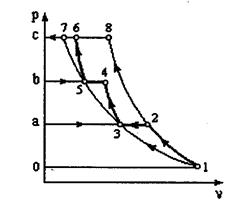
Рис.2.4
Диаграмма процессов сжатия в трехступенчатом компрессоре в р v - координатах представлена на рис. 2.4. Рассмотрим процессы: 0-1 - линия: всасывания газа в первой ступени компрессора (не является термодинамическим процессом, т.к. происходит лишь перемещение газа без изменения его термодинамических параметров); 1-2 - политропный процесс сжатия в первой ступени; 2-а - линия нагнетания газа в промежуточный охладитель 8; а-3 линия всасывания во второй ступени компрессора; 3-4 - политропный процесс сжатия во второй ступени; 4-b - линия нагнетания в промежуточный охладитель 9; b-5 - линия всасывания в третьей ступени компрессора; 5-6 - политропный процесс сжатия в третьей ступени; 6-с - линия нагнетания газа в резервуар. Отрезки 2-3 и 4-5 изображают уменьшение объема газа в процессе при постоянном давлении от охлаждения в охладителях 8 и 9. Охлаждение производится до одной температуры, равной температуре всасывания газа в первой ступени Т1. Поэтому температуры в точках 1, 3, 5 будут одинаковыми, и через них можно провести изотерму 1-7. Отношение давлений для каждой ступени обычно принимается одинаковым и равным некоторой величине х. В случае равенства начальных температур и показателей политропы конечные температуры также будут равны, т.е. Т2-Т4=Т6. Отсюда следует, что
Так как р2=р3 и р4 = р5 то
При z-ступенях компрессора для величины х получим следующую формулу
Ступенчатое сжатие с промежуточным охлаждением приближает рабочий процесс компрессора к наиболее экономичному изотермическому сжатию и чем больше число ступеней сжатия, тем больше процесс сжатия будет приближаться к изотермическому процессу. При равенстве температур газа на входе в каждую ступень и равенстве отношений давлений затраты работы на сжатие во всех ступенях будут одинаковыми l 1= l 2= l 3, где
Отсюда l к = 3 l 1. Или при z-ступенях l к = z l 1. Работа на привод трехступенчатого компрессора при политропном сжатии во всех ступенях в рv-координатах может быть определена площадь фигуры 0-1-2-3-4-5-6-С-0.
|
|||||||||||||||||
|
Последнее изменение этой страницы: 2021-04-05; просмотров: 101; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.19.238.155 (0.015 с.) |

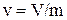
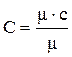 ;
; 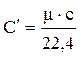 ;
; 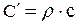 (1.7)
(1.7)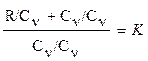 (1.16)
(1.16)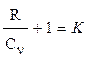 или
или 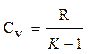
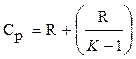 (1.17)
(1.17)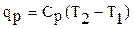 ;
; 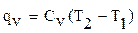
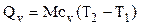 ;
; 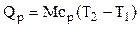
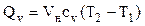 ;
; 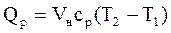
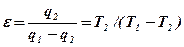 (1.37)
(1.37)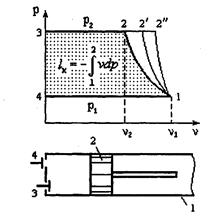
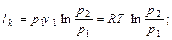 (2.1)
(2.1)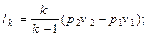 (2.2)
(2.2) (2.3)
(2.3)

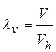 .
.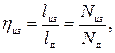
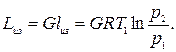
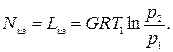
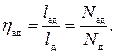
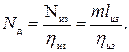
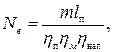
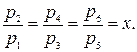
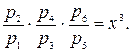
 .
.