
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Качественные реакции гомофункциональных органических соединений
СПИРТЫ Для спиртов характерна реакция этерификации – взаимодействие с карбоновыми кислотами (качественная реакция на спиртовый гидроксил):
Н2 S О4 конц.,Т* С2Н5ОН + СН3- СООН -------------------- > СН3 – СО-ОС2Н5 + Н2О этанол уксусная этиловый эфир кислота уксусной кислоты (фруктовый запах)
В результате реакции этерификации образуются сложные эфиры, которые имеют приятный запах фруктов Первичные спирты окисляются в альдегиды, вторичные спирты окисляются в кетоны, третичные спирты более устойчивы к окислению. Окисление спиртов обычно проводят сильными окислителями. Этанол окисляют раствором дихромата калия (К2Сг2О7) в сернокислой среде, при нагревании ощущается запах уксусного альдегида (запах свежих яблок): Т 3 С2Н5ОН + К2Сг2О7 +4Н2 S О4 ---- > 3 СН3 – С (О) Н + Сг2(S О4)3 + К2 S О4 + 7Н2О 2Сг+6 + 6е ----> 2 Сг+3 1 окислитель С- - 2е ---- > С+ 3 восстановитель
Подлинность этилового спирта устанавливают по реакции образования йодоформа (желтый осадок и характерный запах) – йодоформная проба.
С2Н5ОН + 4 I 2 + 6 N аОН ---- > СН I 3 ↓+ 5 N а I + Н-СОО N а + 5Н2О I2 + 2е ---> 2I- 4 окислитель 2С-2 – 8е ---> 2 С+2 1 восстановитель
Многоатомные спирты при взаимодействии со свежеприготовленным раствором гидроксида меди (+2) в щелочной среде образуют комплексное соединение синего цвета. Этой реакцией часто пользуются для качественного обнаружения соединений, имеющих в молекуле диольный фрагмент (глицерин, глюкоза, фруктоза, винная кислота и др.) - СН(ОН)СН(ОН)-.
раствор ярко – синего цвета
Это реакция отличия многоатомных спиртов от одноатомных спиртов. Этиловый спирт (этанол, С2Н5ОН) в зависимости от концентрации применяют по-разному: 96,6% - для лабораторных целей; 95% - для приготовления спиртовых растворов, настоек, экстрактов; 70% - для обработки инъекционного поля, в любой концентрации - для компрессов. Глицерин (пропантриол – 1,1,1) применяют в качестве растворителя (раствор Люголя), наружно для смягчения кожи, в промышленности для получения нитроглицерина.
Многие лекарственные препараты содержат спиртовый гидроксил в своем составе: глюкоза, адреналин, эфедрин, ментол, терпингидрат и т.д.
ПРОСТЫЕ ЭФИРЫ
Способность простых эфиров к окислению необходимо учитывать при работе с этими веществами, т.к. некоторые из них, например, диэтиловый эфир, используются в фармацевтической и медицинской практике. Эфир окисляется кислородом воздуха в пероксид. Учитывая взрывоопасность пероксидов и гидропероксидов, необходимо при работе с простыми эфирами всегда проверять их на наличие пероксидных соединений. Проба на наличие пероксидных соединений проводится с раствором йодида калия (КI) в сернокислой среде. Если в эфире содержатся пероксидные соединения, то они окисляют йодид калия до свободного йода (I2), окрашивающего раствор в бурый цвет. Образование небольших количеств йода можно легко обнаружить, добавляя в пробу раствор крахмала, который дает при взаимодействии с йодом синее окрашивание.
Наиболее характерной для дифенгидрамина гидрохлорида (димедрола) является реакция образования окрашенной оксониевой соли с концентрированной серной кислотой (образуется окрашивание от ярко-желтого до желто-бурого). При добавлении воды окраска исчезает, что связано с разложением этой соли.
дифенгидрамин
дифенгидрамина гидросульфат
Диэтиловый эфир (медицинский эфир) применяют в анализе в качестве растворителя; дифенгидрамина гидрохлорид (димедрол) применяют в медицине как гистаминное средство. Бутилвиниловый эфир (С4Н9 – О – СН = СН2) является исходным веществом для препарата «Винилин» (бальзам Шостаковского), который применяют наружно для лечения долго незаживающих ран. Дифенгидрамина гидрохлорид - антигистаминное, успокаивающее, снотворное.
АЛИФАТИЧЕСКИЕ АМИНЫ
Реакция с азотистой кислотой позволяет отличить первичные, вторичные и третичные амины. Первичные амины при взаимодействии с азотистой кислотой вступают в реакцию дезаминирования с образованием спирта.
С2Н5- N Н2 + НО- N О ---- > С2Н5ОН + N 2 ↑ + Н2О этиламин этанол (характерный запах)
Вторичные амины превращаются в нитрозамины (окрашенные соединения).
СН3- N Н-СН3 + НО- N О ----- > (СН3)2- N - N = О + Н2О диметиламин диметилнитрозамин
Третичные амины под действием азотистой кислоты практически не изменяются.
Первичные амины при температуре с хлороформом и спиртовой щелочью образуют изонитрилы – вещества с сильным тошнотворным запахом. Данная реакция используется для открытия первичных аминов в фармацевтическом анализе.
СН3 – N Н2 + СНС13 + 3 N аОН ---- > СН3- N ≡ С + 3 N аОН +3Н2О метиламин метилизонитрил (запах)
Амины встречаются в природе повсеместно в виде витаминов, гормонов, промежуточных продуктов обмена, есть они и в организме животных и в растениях. Кроме того, при гниении живых организмов также получаются средние амины, которые в жидком состоянии распространяют неприятный запах селедочного рассола.
АЛЬДЕГИДЫ
Альдегиды легко окисляются в соответствующие карбоновые кислоты. Для их окисления можно использовать различные окислители. Одной из качественных реакций для обнаружения альдегидной группы является реакция «серебряного зеркала» - окисление реактивом Толленса. Катион серебра восстанавливается в свободное серебро. На стенках пробирки появляется налет металлического серебра в виде зеркала. Т* СН3-С(О)Н + 2А g (N Н3)2ОН ------- > СН3СОО N Н4 + 2А g ↓ + 3 N Н3 + Н2О уксусный ацетат альдегид аммония
Аg + +1е ---> Аg 2 окислитель С+ - 2е ---> С+3 1 восстановитель
Другая качественная реакция на альдегиды заключается в окислении их гидроксидом меди (+2). При окислении альдегида гидроксид меди (+2), имеющий светло-голубой цвет, восстанавливается в гидроксид меди (+1) желтого цвета. Этот процесс протекает при комнатной температуре. Если подогреть испытуемый раствор, то гидроксид меди (+1) желтого цвета превращается в оксид меди (+1) кирпично-красного цвета, который плохо растворим в воде и выпадает в осадок. Т* СН3- С(О)Н + 2С u (ОН)2 ------ > СН3 - СООН + 2С u ОН↓ + Н2О
С+1 -2е ---> С+3 1 восстановитель Сu+2 + 1е ---> Сu+1 2 окислитель
Т* 2С u ОН↓------- > С u 2 О↓ + Н2О
С реактивом Несслера в щелочной среде из альдегида образуется соответствующая карбоновая кислота, в результате этой реакции выпадает в осадок восстановленная ртуть серо-черного цвета.
СН3- С (О) Н + [К2Н g ] I 4 +3 КОН --- > СН3СООК + Н g ↓ + 4К I +2Н2О
С+1 – 2е ---> С+3 1 восстановитель Нg+2 +2е---> Нg 1 окислитель
Также проводят реакцию с реактивом Фелинг а, при нагревании реакционной смеси постепенно выпадает осадок оксида меди (+1) кирпично –красного цвета.
СН3-С(О)Н+2 NаООС-СН-СН-СООК+3Н2О--- >СН3СООН + 2 NаООС-СН- СН-СООК+ | | | | О О ОН ОН \ / С u сегнетова соль (тартрат калия-натрия) + С u2О↓ + Н2О
С+1 – 2е ---> С+3 1 восстановитель Сu+2 +1е ---> Сu+1 2 окислитель
Для альдегидов (и кетонов) можно предложить качественную реакцию – реакцию образования оснований Шиффа, окрашенных соединений. Реакцию проводят с аммиаком и производными аммиака (гидразин, фенилгидразин, гидроксиламин, амины).
СН3 –С (О) Н + N Н3 ------- > СН3- СН= N Н + Н2О уксусный имин этаналя, альдегид, основание Шиффа этаналь
СН3 –С (О) Н + N Н2- N Н2 ----- > СН3- СН= N - N Н2 + Н2О гидразин гидразон этаналя, основание Шиффа
СН3- С (О) Н + N Н2- N Н-С6Н5 ----- > СН3 –СН= N - N Н-С6Н5 + Н2О фенилгидразин фенилгидразон этаналя, основание Шиффа
СН3- С (О) Н + N Н2-С2Н5 ---- > СН3- С= N -С2Н5 + Н2О этиламин этилимин этаналя, основание Шиффа
СН3 –С (О) Н + N Н2-ОН ----- > СН3- СН= N -ОН + Н2О гидроксиламин оксим этаналя, основание Шиффа
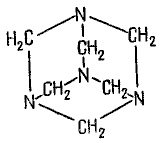
Многие лекарственные препараты и биологические соединения содержат оксогруппу. Формальдегид (формалин) – применяют для дезинфекции. Так как формалин предотвращает разложение, он используется в качестве бальзамирующего средства для длительного хранения биологических препаратов. Из формальдегида получают метенамин (гексаметилентетрамин, уротропин).
Метенамин применяют как противовоспалительное средство при заболевании мочевой системы. Широкое применение в медицине имеет глюкоза – общеукрепляющее, в составе растворов кровезамещающих, плазмозамещающих, дезинтоксикационных электролитов, а также для улучшения вкуса препаратов.
Камфора (1,7,7-триметилбицикло-[2.2.1]-гептан-2-он) распространена в природе, входит в состав многих эфирных масел. Особенно много её в масле камфорного лавра, базилика, полыней, розмарина. В медицине применяют d- и L- камфору; рацемическую камфору допускают лишь для наружного применения из-за повышенной токсичности ввиду химического загрязнения. При введении под кожу растворы камфоры в растительном масле тонизируют дыхательный центр, стимулируют сосудодвигательный центр. Оказывает также непосредственное действие на сердечную мышцу, усиливая обменные процессы в ней и повышая её чувствительность к влиянию симпатических нервов. Под влиянием камфоры суживаются периферические кровеносные сосуды. Способствует отделению мокроты. Возможно, что камфора ингибирует агрегацию тромбоцитов, в связи с чем она рекомендована к применению для улучшения микроциркуляции. Противозудное действие камфоры, возможно, связано с тем, что она, как и ментол, избирательно активирует холодовые рецепторы.
КАРБОНОВЫЕ КИСЛОТЫ
Все карбоновые кислоты в водном растворе диссоциируют на ионы, окрашивают лакмус в красный цвет и метиловый оранжевый в розовый цвет (рН < 7), фенолфталеин и тимолфталеин окраску не изменяют в кислой среде. Для всех карбоновых кислот характерна реакция этерификации - взаимодействие со спиртами.
Т*, Н2 SО4 конц. СН3-СООН + С2Н5ОН--------------------------- > СН3- С (О)-ОС2Н5 + Н2О уксусная этанол этиловый эфир кислота уксусной кислоты (фруктовый запах)
Муравьиная кислота обладает восстановительными свойствами, что и используют в качественном анализе. Реакцию проводят с реактивом Толленса при нагревании, в результате реакции появляется восстановленное серебро (на стенках пробирки металлическое серебро в виде зеркала). Т* НСООН +2А g (N Н3)2ОН -------- > 2А g ↓+4 N Н3↑ +СО2↑ + 2Н2О
Аg+ + 1е ----> Аg 2 окислитель С+2 – 2 е ----> С+4 1 восстановитель
Уксусную кислоту и ее соли определяют раствором хлорида железа (III). В результате реакции образуется ацетат железа (+3) – раствор красно-бурого цвета.
3 СН 3 – СОО Na + FeC13 ----- > (CH3 –COO)3 Fe + 3NaC1 ацетат железа (+3)
Качественную реакцию на бензойную кислоту проводят в слабощелочной среде, в результате образуется основной бензоат железа (+3) - осадок розово-желтого цвета.
С6Н5-СООН + N аОН ---- > С6Н5 –СОО N а + Н2О 1 кап.
6С6Н5- СОО Na + 2 FeC 13 + 10 H 2 O ---- > (C 6 H 5 – COO)3 Fe Fe (OH)3 *7 H 2 O ↓ основной бензоат железа (III) + 3 C 6 H 5 - COOH + 6 N аС1
Реакцию нельзя проводить в щелочной среде (образуется бурый осадок гидроксид железа (+3)), нельзя проводить в кислой среде (в осадок белого цвета выпадает бензойная кислота). Щавелевую кислоту и ее соли определяют с помощью хлорида кальция, образуется белый осадок оксалат кальция.
Н2С2О4 + СаС12 ---- > СаС2О4 ↓ + 2НС1 щавелевая оксалат кислота кальция
Данную реакцию используют в аналитической химии и в фармацевтическом анализе для определения ионов Са+2. В количественном анализе используют восстановительные свойства щавелевой кислоты: Т* 5Н2С2О4+ 2КмпО4 +3Н2 S О4 ------ > 10СО2 ↑+2Мп SO 4 + K 2 SO 4 +8 Н2О
С2О4-2 – 2е ---> 2СО2 5 восстановитель Мп+7 +5е ---> Мп+2 2 окислитель
Муравьиная кислота впервые выделена из рыжих лесных муравьев (брюшных желез) английским натуралистом Джоном Рэйему в 17 веке. Кроме этих насекомых, от которых она и получила свое название, муравьиная кислота в природе находится в некоторых растениях (крапива, хвоя), фруктах, а также в едких выделениях пчел. Муравьиный спирт – спиртовой раствор муравьиной кислоты, которая в медицине применяется в качестве бактерицидного, противовоспалительного средства. Уксусная кислота является консервантом, производным для получения лекарственных препаратов (ацетилсалициловая кислота, ретинола ацетат и др.) В природе уксусная кислота распространена в свободном виде или в виде солей и сложных эфиров в растениях (в зеленых листьях), в выделениях животных (моче, желчи), образуется при гниении и брожении (в кислом молоке, сыре, вине). Брожение происходит под влиянием специфических бактерий "уксусного грибка". Ацетат натрия является инертным по отношению к организму, т.к. не всасывается при приёме внутрь. Бензойная кислота применяется как противогрибковое и противомикробное средство. Бензойная кислота содержится в ягодах клюквы, брусники и т.д. Бензоат натрия оказывает сильное угнетающее действие на дрожжи и плесневые грибы, подавляет в клетках активность ферментов, ответственных за окислительно-восстановительные реакции, а также ферментов, расщепляющих жиры и крахмал. В натуральных продуктах он содержится в небольших дозах в яблоках, изюме и клюкве, корице, гвоздике и горчице. Щавелевая кислотаи ее соль являются исходным веществом в методе перманганатометрии, и реагентом для обнаружения катиона кальция. В чистом виде щавелевая кислота содержится в грибах тутовиках. В природе встречаются лишь соли щавелевой кислоты. Соли щавелевой кислоты содержатся в кислых овощах и ягодах: щавель, ревень, смородина и т.д.
|
|||||||||
|
Последнее изменение этой страницы: 2021-04-05; просмотров: 156; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.147.205.154 (0.074 с.) |

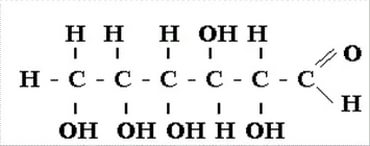 глюкоза
глюкоза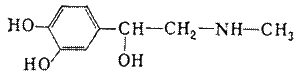 адреналин
адреналин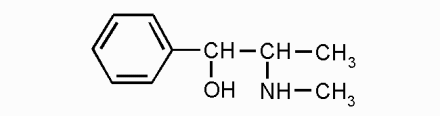 эфедрин
эфедрин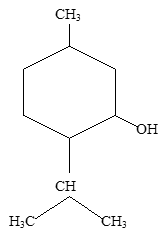 Ментол ((2R)-(2-пропил)-(5S)-метил-(1R)-циклогексанол) - органическое вещество, важный вторичный метаболит растений семейства яснотковые, получают синтетически или выделяют из мятного эфирного масла. Обладает слабыми местноанестизирующими свойствами, стимулирует холодовые рецепторы кожи и слизистых, слабый антисептик. Левовращающий изомер ментола обладает противоспалительными свойствами, используют для лечения слизистой оболочки носа, горла. Является основной составляющей рефлекторного сосудорасширяющего средства валидол.
Ментол ((2R)-(2-пропил)-(5S)-метил-(1R)-циклогексанол) - органическое вещество, важный вторичный метаболит растений семейства яснотковые, получают синтетически или выделяют из мятного эфирного масла. Обладает слабыми местноанестизирующими свойствами, стимулирует холодовые рецепторы кожи и слизистых, слабый антисептик. Левовращающий изомер ментола обладает противоспалительными свойствами, используют для лечения слизистой оболочки носа, горла. Является основной составляющей рефлекторного сосудорасширяющего средства валидол.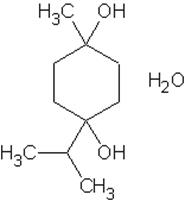 Терпингидрат (п-Ментандиол-1,8-гидрат) -лекарственное средство отхаркивающего действия. Терпингидрат входит в состав некоторых комбинированных противокашлевых лекарственных средств. Так, вместе с декстрометорфаном и левоментолом он входит в препарат «Гликодин», с кодеином и гидрокарбонатом натрия — в препараты «Кодтерпин», «Теркодин» и «Терпинкод».
Терпингидрат (п-Ментандиол-1,8-гидрат) -лекарственное средство отхаркивающего действия. Терпингидрат входит в состав некоторых комбинированных противокашлевых лекарственных средств. Так, вместе с декстрометорфаном и левоментолом он входит в препарат «Гликодин», с кодеином и гидрокарбонатом натрия — в препараты «Кодтерпин», «Теркодин» и «Терпинкод». + H2 SO4(конц) →
+ H2 SO4(конц) →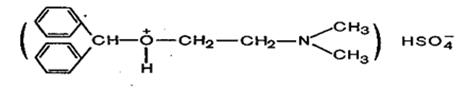
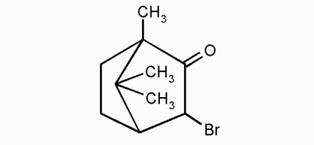 Бромкамфора (2-бромо-4,7,7-триметилбицикло[2.2.1]гептан-3-он) – синтетический препарат, основное действующее вещество которого — камфора бромистая. Оказывает успокаивающее действие на центральную нервную систему, благоприятно влияет на функции сердечно-сосудистой системы, улучшает сердечную деятельность.
Бромкамфора (2-бромо-4,7,7-триметилбицикло[2.2.1]гептан-3-он) – синтетический препарат, основное действующее вещество которого — камфора бромистая. Оказывает успокаивающее действие на центральную нервную систему, благоприятно влияет на функции сердечно-сосудистой системы, улучшает сердечную деятельность.


