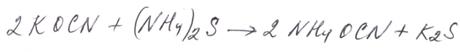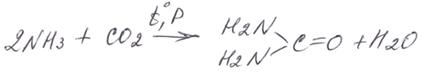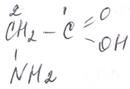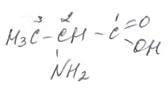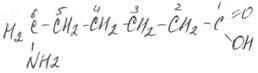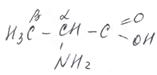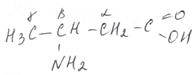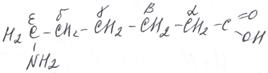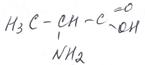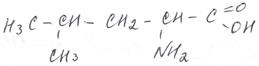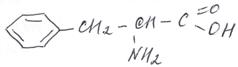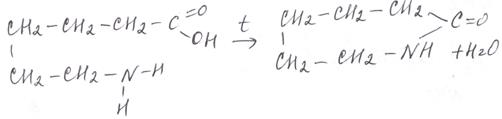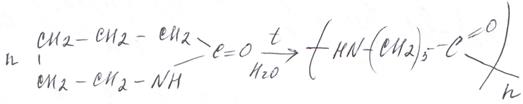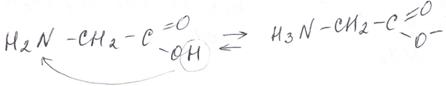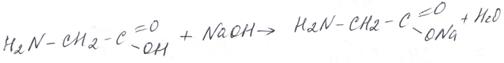Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Азотсодержащие органические соединенияСтр 1 из 3Следующая ⇒
Тема 24. Углеводы Углеводы – органические соединения, содержащие карбонильную группу и несколько гидроксильных групп. Большинство углеводов имеют формулу С n (H2O) m, где n и m ³ 3. Важнейшие представители углеводов (названия знать, все встречаются в ЕГЭ, формулы можно не запоминать): рибоза (компонент РНК) C5H10O5; глюкоза (виноградный сахар) С6Н12О6; фруктоза (фруктовый сахар) С6Н12О6; сахароза (тростниковый, свекловичный сахар) С12Н22О11; мальтоза (солодовый сахар) С12Н22О11; лактоза (молочный сахар) С12H22O11; крахмал и целлюлоза (С6Н10О5) n.
Углеводы являются неотъемлемым компонентом клеток и тканей всех живых организмов представителей растительного и животного мира, составляя (по массе) основную часть органического вещества на Земле. Источником углеводов для всех живых организмов является процесс фотосинтеза, осуществляемый растениями. Упрощенно фотосинтез можно выразить реакцией:
n СO2 + m H2O При функционировании живых организмов идет обратный процесс, с выделением энергии: С n (H2O) m + n O2 ® n СO2 + m H2O
Все углеводы состоят из отдельных «единиц», которыми являются сахариды. По способности к гидролизу на мономеры углеводы делятся на две группы: простые и сложные. Углеводы, содержащие одну единицу, называются моносахариды, две единицы – дисахариды, от двух до десяти единиц – олигосахариды, а более десяти – полисахариды. Низкомолекулярные углеводы: моносахариды, дисахариды и олигосахариды называются сахара.
Моносахариды Моносахариды (монозы) – это простейшие углеводы, именно они являются мономерами для всех более сложных углеводов – ди-, олиго- и полисахаридов. В молекуле любого моносахарида присутствует одна карбонильная группа (альдегидная или кетонная) и несколько гидроксильных групп. Если моносахарид содержит альдегидную группу – его называют альдоза, если кетонную – кетоза. Наиболее распространены моносахариды, содержащие 5 и 6 атомов углерода – пентозы и гексозы. В ЕГЭ встречаются три моносахарида: рибоза, глюкоза и фруктоза. Рибоза и глюкоза содержат альдегидную группировку, фруктоза – кетонную:
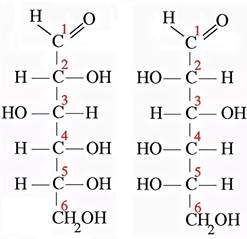
Молекулы моносахаридов достаточно сложны, поэтому возможны различные пространственные изомеры (или стереоизомеры). Рассмотрим кратко на примере глюкозы. В молекуле любой альдогексозы 4 атома углерода содержат один –Н и одну группу –ОН, т.е. могут существовать 24 = 16 стереоизомерных альдогексоз с различным взаимным положением этих заместителей. Глюкозой являются два из них, D -глюкоза и L -глюкоза, которые являются зеркальным отображением друг друга – т.е. оптическими изомерами:
D -глюкоза L -глюкоза
В природе встречается почти исключительно D -моносахариды, например D -глюкоза, D - – это форма, у которой ОН-группа располагается справа от предпоследнего атома углерода (у глюкозы – 5). На рисунке глюкоза изображена в форме линейной молекулы, в действительности глюкоза, как и другие сахара, образует циклические полуацетали. Вспомним свойства альдегидов: альдегиды со спиртами взаимодействуют по схеме
В молекуле D -глюкозы альдегидная группа реагирует с –ОН группой у 5 углерода. И при образовании цикла возможно 2 варианта! В зависимости от положения –Н и =О в альдегидной группе цикл может замкнутся по разному:
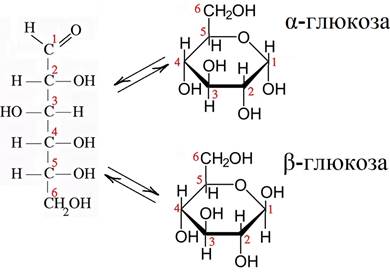
Итог – могут существовать циклы с разным положением вновь образованной группы –ОН – или под кольцом (a-изомер) или над кольцом (b-изомер). Обычно циклические формы углеводов изображают в виде проекций правильных многоугольников с заместителями над и под плоскостью цикла. Циклическую форму D -глюкозы правильно называть D -глюкопиранозой. В растворах α-D-глюкопираноза и β-D-глюкопираноза (хотя чаще их называют просто α-глюкоза и β-глюкоза)существуют в равновесии и переходят друг в друга через образование открытой формы:
Химические свойства моносахаридов определяются присутствующими в них функциональными группами: гидроксильными, альдегидной или кетонной. Причем последние 2 могут проявлять себя только в растворе, и то не в полной мере, так как моносахариды преимущественно существуют в циклической форме. Глюкоза и рибоза – альдегидоспирты, поэтому они проявляют свойства и альдегидов, и спиртов: – по альдегидной группе глюкоза и рибоза способны восстанавливаться (например, реагировать с водородом) с образованием спирта. Глюкоза, например, восстанавливается до шестиатомного спирта сорбита:
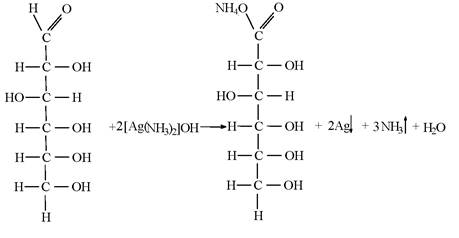
– по альдегидной группе глюкоза и рибоза способны окисляться даже в мягких условиях (например, реагируют с аммиачным раствором Ag2O (вступают в реакцию серебряного зеркала), Cu(OH)2, HNO3 разб. (концентрированная может дать сложные эфиры), бромной водой). Глюкоза, например, окисляется до глюконовой кислоты и ее солей, приведем реакцию серебряного зеркала:
См. видеоопыты: https://youtu.be/eOPpLE-Yfho https://youtu.be/LLBLfDJpjhs https://youtu.be/b1dMFqqbJTI?list=PLnbQh4j9gZkKZDdTU1xVdJZ8FQIvkJCWF
– как спирты, глюкоза и рибоза способны реагировать с кислотами с образованием сложных эфиров, например:
– как многоатомные спирты, глюкоза и рибоза способны растворять Cu (OH)2 с образованием ярко-синего раствора (подробнее см. в разделе спирты); – как все органические вещества моносахариды в жестких условиях окисляются с распадом цепи, например, глюкоза сгорает по реакции:
С6Н12О6 + 6O2 ® 6СO2 + 6H2O
– важнейшим свойством моносахаридов является их ферментативное брожение, именно так из глюкозы получают пищевой этанол, лимонную кислоту, молочную кислоту и др. Приведем в качестве примера спиртовое брожение глюкозы:
– моносахариды – это простейшие углеводы, они не подвергаются гидролизу в отличие от ди-, олиго- и полисахаридов. Фруктоза – кетоноспирт, она, в отличие от глюкозы и рибозы, не способна окислятся в мягких условиях (не вступает в реакцию серебряного зеркала). Дисахариды
Дисахариды – углеводы, молекулы которых состоят из остатков двух моносахаридов, связанных между собой так называемой гликозидной связью. Наиболее известные дисахариды – это сахароза, мальтоза и лактоза.
В заданиях встречается, в основном, сахароза, перечислим ее свойства: – сахароза не образует открытую форму, поэтому не проявляет свойств ни альдегидов (как глюкоза) ни кетонов (как фруктоза): при нагревании с аммиачным раствором оксида серебра(I) она не дает реакцию «серебряного зеркала», при нагревании с гидроксидом меди(II) не образует красного оксида меди(I); см. опыт: https://youtu.be/_vuPVJ38ScM !!! Надо учесть, что в отличие от сахарозы, мальтоза и лактоза могут в растворе образовывать открытую форму, поэтому мальтоза и лактоза могут проявлять восстанавливающие свойства альдегидов. – как многоатомные спирты, сахароза способна растворять Cu (OH)2: если раствор сахарозы прилить к гидроксиду меди(II), образуется ярко-синий раствор сахарата меди; см. опыт: https://youtu.be/ocdieqlR-Dg
– как дисахарид, сахароза способна распадаться на составляющие моносахариды: при нагревании раствора сахарозы в присутствии кислоты происходит гидролиз по схеме:
С12Н22О11 + Н2О сахароза глюкоза фруктоза см. опыт: https://youtu.be/XkNqOkPP3O0
– обезвоживание концентрированной серной кислотой: концентрированная серная кислота может отнять воду и «обуглить» любой углевод, но особенно эффектно реакция протекает с кристаллами сахарозы: https://youtu.be/p-PQoBt_ssU
Реакцию можно записать как:
С12Н22О11 + H2SO4 конц. изб. ® 12С + 11Н2О(в кислоту) Полисахариды
Полисахариды – сложные углеводы, состоящие из большого количества (до ста тысяч) остатков моносахаридов. Полисахариды – это природные высокомолекулярные соединения.
Основные представители – крахмал и целлюлоза.
Крахмал
Часть глюкозы, образующейся в зелёных растениях при фотосинтезе, превращается в крахмал:
n C6H12O6(глюкоза) → (C6H10O5) n + n H2O
Крахмал образуется из молекул α- D -глюкопиранозы (упрощенно α-глюкозы):
Число звеньев цепочки n для крахмала относительно невелико – несколько тысяч. В горячей воде набухает, образуя коллоидный раствор – клейстер. При действии ферментов или нагревании с кислотами крахмал в растворе подвергается гидролизу по схеме:
(С6Н10О5) n ® (С6Н10О5) х ® (С6Н10О5) т ® n /2 (С12Н22О11) ® n С6Н12О6
крахмал растворимый декстрины мальтоза α-глюкоза крахмал х < n m < х
см. опыт: https://youtu.be/9FkZHL0Yc6s?list=PLnbQh4j9gZkKZDdTU1xVdJZ8FQIvkJCWF
Этот процесс происходит в желудке человека и животного: крахмал превращается в α-глюкозу, которая усваивается организмом. Часть α-глюкозы может быть «отложена в запас» в виде полисахарида гликогена. Гликоген (животный крахмал) также состоит из остатков α-глюкозы, но имеет более разветвленное строение, чем обычный, растительный крахмал. Химические свойства крахмала: – главное свойство крахмала, как любого полисахарида – способность к гидролизу; – крахмал не проявляет свойств альдегидов (как глюкоза): при нагревании с аммиачным раствором оксида серебра(I) он не дает реакцию «серебряного зеркала», при нагревании с гидроксидом меди(II) не образует красного оксида меди(I); – характерной для крахмала является реакция с йодом: раствор йода окрашивает крахмал в синий цвет. Эта качественная реакция и на крахмал, и на йод; см. опыт: https://youtu.be/yHQBu6MSsbI
– крахмал многоатомный спирт, но он малорастворим, поэтому реакция с Cu(OH)2 практически не идет. Также для крахмала нехарактерно (хоть и возможно) образование сложных эфиров.
Целлюлоза
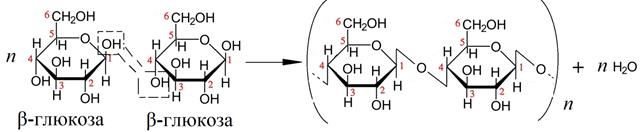
Целлюлоза (или клетчатка) – основная составная часть оболочки растительных клеток, самое распространенное органическое вещество. Образуется в растениях в процессе фотосинтеза. Макромолекулы целлюлозы – это длинные цепи, состоящие из сотен или десятков тысяч остатков β- D -глюкопиранозы (β–глюкозы):
Химические свойства целлюлозы: – отличие от крахмала целлюлоза не расщепляется в организме человека под действием ферментов и не может быть употреблена в пищу.
– целлюлоза нерастворима в воде, слабых кислотах и большинстве органических растворителей. Но целлюлоза подвергается гидролизу при нагревании измельченных древесных опилок и стружек в присутствии кислоты (т. н. осахаривание целлюлозы):
(С6Н10О5) n + n Н2О целлюлоза β–глюкоза
см. опыт: https://youtu.be/m6YvoPWuOtY
Полученную β–глюкозу используют в технических целях, например сбраживают в этиловый спирт. Такой спирт называют гидролизным, он содержит много вредных примесей, в том числе метанол, и может быть использован только в технических целях. – целлюлоза не проявляет свойств альдегидов; – образование сложных эфиров. В отличие от крахмала, для целлюлозы характерны реакции образования сложных эфиров. Каждое звено целлюлозы содержит 3 спиртовых группы –ОН:
Поэтому часто эти три группы в формуле целлюлозы выделяют: (С6Н10О5) n = (С6Н7О2(ОН)3) n. Наибольшее практическое значение имеют эфиры с азотной и уксусной кислотой. Целлюлоза с концентрированной азотной кислотой образует сложный эфир – тринитрат целлюлозы: (С6Н7О2(ОН)3) n + 3HNO3 (конц.) = (С6Н7О2(ОNO2)3) n + 3 n Н2О см. опыт: https://youtu.be/A0OtxEiNtcE
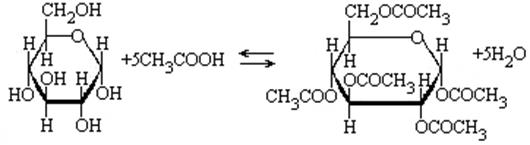
Сложный эфир тринитрат целлюлозы – пироксилин – взрывчатое вещество, на его основе изготавливают бездымный порох. При взаимодействии целлюлозы с уксусной кислотой (а в промышленности с уксусным ангидридом) образуется сложный эфир триацетилцеллюлоза:
(С6Н7О2(ОН)3) n + 3СН3СООН (конц.) = (С6Н7О2(ОСОСН3)3) n + 3 n Н2О
Триацетатцеллюлозы используют для получения ацетатного шелка. Структурные формулы этих эфиров можно посмотреть здесь: https://himija-online.ru/organicheskaya-ximiya/uglevody/cellyuloza.html – целлюлоза нерастворима в воде, но ее можно перевести в раствор: например, целлюлоза растворяется в реактиве Швейцера – аммиачном растворе Cu(OH)2, см. опыт см. опыт: https://youtu.be/UtoBhauQN5k
В промышленности целлюлозу растворяют в NaOH (в присутствии Na2S). При добавлении к полученному щелочному раствору H2SO4 целлюлоза выпадает в виде твёрдого вещества, которое выделяют и формуют: так получают вискозное волокно и целлофан.
Нитросоединения Нитросоединения содержат функциональную группу –NO2 (нитрогруппу), соединенную с углеводородным радикалом:
R–NO2
Нитросоединения как таковые, не входят в кодификатор ЕГЭ, но они часто встречаются и в тестах, и в задачах. Если в углеводородном радикале нет кратных связей, то общая формула таких предельных нитросоединений
С n H2 n +1NO2
Введение нитрогруппы –NO2 в органическое вещество называется нитрованием. Обычно нитрование проводят т.н. нитрующей смесью: смесь концентрированной НNO3 (нитрующий агент) и концентрированной H2SO4 (водоотнимающий агент). Нитрование алканов осуществляют разбавленной азотной кислотой при нагревании (реакция Коновалова), например:
В лаборатории для получения нитросоединений часто используют реакцию Мейера – взаимодействие галогеналканов с нитритом серебра AgNO2, например:
Главное свойство нитросоединений – способность восстанавливаться до первичных аминов по схеме (реакция Зинина):
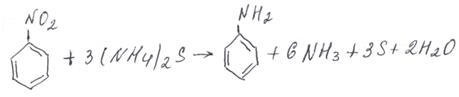
Впервые реакция была осуществлена Николаем Николаевичем Зининым в 1842 г для получения анилина, в качестве восстановителя был использован сульфид аммония:
В дальнейшем, сульфид аммония заменили на водород, в промышленности нитросоединения гидрируют на катализаторе при температуре 200–300°С:
В лаборатории используется атомарный водород (водород, получаемый в момент его выделения), который является более сильным восстановителем, чем молекулярный. Для этого реакцию восстановления проводят с металлами цинком или железом в кислой среде или с алюминием в щелочной среде:
Амины
Амины обычно рассматривают как производные аммиака, в которых один, два или все три атома водорода замещены органическими радикалами. По числу замещенных атомов водорода (иначе: по числу углеводородных радикалов, связанных с атомом азота) различают: – первичные амины: замещен один –Н; – вторичные амины: замещены два –Н; – третичные амины: замещены все три –Н; – соли алкиламмония или четвертичные амины: соединения, подобные солям аммония, см. рисунок ниже.
первичный вторичный третичный четвертичный
Номенклатура аминов В простых случаях названия аминов образуют из названий углеводородных радикалов-заместителей и суффикса амин:
метиламин диметиламин триметиламин
Если углеводородный радикал – большой, то название формируется как для любых производных углеводородов:
Часто в молекуле содержатся несколько групп –NH2 – это диамины, триамины и т.д., например:
(сополимер для получения нейлона)
Физические свойства аминов Амины – производные аммиака и повторяют некоторые его свойства. H3C–NH2, CH3–NH–CH3, N(CH3)3 – газы с запахом аммиака, амины с С4–С15 – жидкости с имеют характерный и очень неприятный запах несвежей рыбы. Низшие амины (с небольшой молекулярной массой) растворяются в воде, их растворы имеют щелочную среду и изменяют окраску индикаторов (кроме анилина). Высшие амины – твердые вещества, в воде не растворяются.
Горение аминов. Продуктами горения аминов, как и других азотсодержащих органических соединений, являются углекислый газ, вода и газ азот:
см. опыт https://youtu.be/waBq3U31Nxw?list=PLnbQh4j9gZkKZDdTU1xVdJZ8FQIvkJCWF
7. Взаимодействие аминов с карбоновыми кислотами (а также их ангидридами, хлорангидридами, сложными эфирами). При этом происходит ацилирование – замена –Н на группу
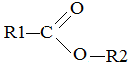
Ацилирование – важнейшее биохимическое свойство аминов (см. также свойство аминокислот – образование пептидов). Если рассмотреть эту реакцию с другой стороны, то можно сказать, что в карбоновой кислоте карбоксильная группа –ОН может замещаться на аминогруппу. Существует отдельный класс органических соединений – амиды кислот. Амиды кислот
Амидами кислот называются производные этих кислот, в которых гидроксильная группа замещена на аминогруппу:
Например, амид уксусной кислоты:
Полный амид двухосновной уксусной кислоты – карбамид или мочевина:
Амиды можно получить: – прокаливанием аммонийных солей карбоновых кислот:
– действием аммиака на сложные эфиры:
– мочевина – первое органическое вещество, полученное из неорганических: в 1828 г. немецкий химик Фридрихом Вёлер получил цианат аммония
а при его нагревании – мочевину:
До этого синтеза считали, что органическое вещество может быть получено только в живой природе. В настоящее время мочевину (карбамид) получают из аммиака и углекислого газа:
Мочевину (карбамид) используют в качестве удобрения. Некоторые амиды применяются для синтеза полимеров:
амид акриловой кислоты полиакриламид
Аминокислоты Аминокислоты – это органические соединения, в молекулах которых одновременно содержатся две функциональные группы: аминогруппа –NH2 и карбоксильная группа –СООН.
Номенклатура аминокислот Для аминокислот широко используют все три вида номенклатуры. По международной номенклатуре названия аминокислот строятся от названия кислоты (также, конечно, по IUPAC) с приставкой амино- и указанием цифрой места расположения аминогруппы. Нумерация углеродной цепи начинается с атома углерода карбоксильной группы. Например:
аминоэтановая 2-аминопропановая 6-аминогексановая кислота кислота кислота
По рациональной номенклатуре название также строится от названия кислоты (по рациональной же номенклатуре) с приставкой амино-, но место аминогруппы указывается греческой буквой (a-, b-, g-, d-, e-, z-, h-). Напомним, что по рациональной номенклатуре углерод функциональной группы (в данном случае карбоксильной) не считается, a-углерод – это углерод, ближайший к –СООН, т.е. 2 углерод по международной номенклатуре.
a-аминопропионовая b-аминомасляная e-аминокапроновая кислота кислота кислота
Известны около 500 встречающихся в природе аминокислот (хотя только 20 используются в генетическом коде). Иногда говорят о 22 важнейших протеиногенных кислотах (20 основных и 2 их модификации). Для этих двадцати двух α-аминокислот, которые играют исключительно важную роль в процессах жизнедеятельности животных и растений, применяются короткие исторические названия и даже трехбуквенные обозначения. Раньше на вступительных экзаменах в медицинские вузы спрашивали и названия, и формулы этих важнейших кислот. В ЕГЭ таких знаний не требуется, но исторические, традиционные названия аминокислот встречаются в заданиях: достаточно по названию понять, что это аминокислота. Поэтому приведем список 22 аминокислот, играющих важнейшую роль в жизни человека: Глицин, аланин, валин, изолейцин, лейцин, пролин, серин, треонин, цистеин, метионин, аспарагиновая кислота, аспарагин, глутаминовая кислота, глутамин, лизин, аргинин, гистидин, фенилаланин, тирозин, триптофан, селеноцистеин, пирролизин. Наиболее популярные из них:
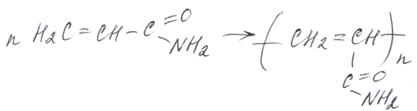
Из «не a-» аминокислот интерес представляет e-аминокапроновая кислота, которая используется для получения капрона:
При нагревании g-, d-, e-аминокислоты превращаются в циклические амиды – лактамы, например, e-аминокапроновая кислота превращается в капролактам:
Под действием водяного пара происходит раскрытие цикла и сшивание молекул в полимер капрон:
Образование внутренних солей. Как у всех амфотерных соединений, у них в полной мере не раскрыты ни основные, ни кислотные свойства. К тому же, «основная» аминогруппа и «кислотная» гидроксильная группа могут реагировать между собой, образуя внутренние соли или биполярные ионы:
Среда в растворе аминокислот зависит от количества функциональных групп: имеют нейтральную, кислую или щелочную среду. Большинство аминокислот содержит одну карбоксильную группу и одну аминогруппу, поэтому имеют нейтральную реакцию. см. опыт https://youtu.be/6wzOzF6n2cM?list=PLnbQh4j9gZkKZDdTU1xVdJZ8FQIvkJCWF
2. Взаимодействие с кислотами и щелочами с образованием солей. Как амфотерные соединения аминокислоты реагируют и с кислотами, и со щелочами, образуя два вида солей, например:
хлороводородная соль глицина (такая оригинальная форма записи этой соли – анион вначале – представлена в решении 35 задачи ДемоЕГЭ-2020)
глицинат натрия
Тема 24. Углеводы Углеводы – органические соединения, содержащие карбонильную группу и несколько гидроксильных групп. Большинство углеводов имеют формулу С n (H2O) m, где n и m ³ 3. Важнейшие представители углеводов (названия знать, все встречаются в ЕГЭ, формулы можно не запоминать): рибоза (компонент РНК) C5H10O5; глюкоза (виноградный сахар) С6Н12О6; фруктоза (фруктовый сахар) С6Н12О6; сахароза (тростниковый, свекловичный сахар) С12Н22О11; мальтоза (солодовый сахар) С12Н22О11; лактоза (молочный сахар) С12H22O11; крахмал и целлюлоза (С6Н10О5) n.
Углеводы являются неотъемлемым компонентом клеток и тканей всех живых организмов представителей растительного и животного мира, составляя (по массе) основную часть органического вещества на Земле. Источником углеводов для всех живых организмов является процесс фотосинтеза, осуществляемый растениями. Упрощенно фотосинтез можно выразить реакцией:
n СO2 + m H2O При функционировании живых организмов идет обратный процесс, с выделением энергии: С n (H2O) m + n O2 ® n СO2 + m H2O
Все углеводы состоят из отдельных «единиц», которыми являются сахариды. По способности к гидролизу на мономеры углеводы делятся на две группы: простые и сложные. Углеводы, содержащие одну единицу, называются моносахариды, две единицы – дисахариды, от двух до десяти единиц – олигосахариды, а более десяти – полисахариды. Низкомолекулярные углеводы: моносахариды, дисахариды и олигосахариды называются сахара.
Моносахариды Моносахариды (монозы) – это простейшие углеводы, именно они являются мономерами для всех более сложных углеводов – ди-, олиго- и полисахаридов. В молекуле любого моносахарида присутствует одна карбонильная группа (альдегидная или кетонная) и несколько гидроксильных групп. Если моносахарид содержит альдегидную группу – его называют альдоза, если кетонную – кетоза. Наиболее распространены моносахариды, содержащие 5 и 6 атомов углерода – пентозы и гексозы. В ЕГЭ встречаются три моносахарида: рибоза, глюкоза и фруктоза. Рибоза и глюкоза содержат альдегидную группировку, фруктоза – кетонную:
Молекулы моносахаридов достаточно сложны, поэтому возможны различные пространственные изомеры (или стереоизомеры). Рассмотрим кратко на примере глюкозы. В молекуле любой альдогексозы 4 атома углерода содержат один –Н и одну группу –ОН, т.е. могут существовать 24 = 16 стереоизомерных альдогексоз с различным взаимным положением этих заместителей. Глюкозой являются два из них, D -глюкоза и L -глюкоза, которые являются зеркальным отображением друг друга – т.е. оптическими изомерами:
D -глюкоза L -глюкоза
В природе встречается почти исключительно D -моносахариды, например D -глюкоза, D - – это форма, у которой ОН-группа располагается справа от предпоследнего атома углерода (у глюкозы – 5). На рисунке глюкоза изображена в форме линейной молекулы, в действительности глюкоза, как и другие сахара, образует циклические полуацетали. Вспомним свойства альдегидов: альдегиды со спиртами взаимодействуют по схеме
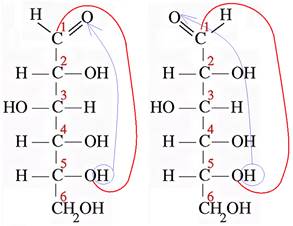
В молекуле D -глюкозы альдегидная группа реагирует с –ОН группой у 5 углерода. И при образовании цикла возможно 2 варианта! В зависимости от положения –Н и =О в альдегидной группе цикл может замкнутся по разному:
Итог – могут существовать циклы с разным положением вновь образованной группы –ОН – или под кольцом (a-изомер) или над кольцом (b-изомер). Обычно циклические формы углеводов изображают в виде проекций правильных многоугольников с заместителями над и под плоскостью цикла. Циклическую форму D -глюкозы правильно называть D -глюкопиранозой. В растворах α-D-глюкопираноза и β-D-глюкопираноза (хотя чаще их называют просто α-глюкоза и β-глюкоза)существуют в равновесии и переходят друг в друга через образование открытой формы:
Химические свойства моносахаридов определяются присутствующими в них функциональными группами: гидроксильными, альдегидной или кетонной. Причем последние 2 могут проявлять себя только в растворе, и то не в полной мере, так как моносахариды преимущественно существуют в циклической форме. Глюкоза и рибоза – альдегидоспирты, поэтому они проявляют свойства и альдегидов, и спиртов: – по альдегидной группе глюкоза и рибоза способны восстанавливаться (например, реагировать с водородом) с образованием спирта. Глюкоза, например, восстанавливается до шестиатомного спирта сорбита:
– по альдегидной группе глюкоза и рибоза способны окисляться даже в мягких условиях (например, реагируют с аммиачным раствором Ag2O (вступают в реакцию серебряного зеркала), Cu(OH)2, HNO3 разб. (концентрированная может дать сложные эфиры), бромной водой). Глюкоза, например, окисляется до глюконовой кислоты и ее солей, приведем реакцию серебряного зеркала:
См. видеоопыты: https://youtu.be/eOPpLE-Yfho https://youtu.be/LLBLfDJpjhs https://youtu.be/b1dMFqqbJTI?list=PLnbQh4j9gZkKZDdTU1xVdJZ8FQIvkJCWF
– как спирты, глюкоза и рибоза способны реагировать с кислотами с образованием сложных эфиров, например:
– как многоатомные спирты, глюкоза и рибоза способны растворять Cu (OH)2 с образованием ярко-синего раствора (подробнее см. в разделе спирты); – как все органические вещества моносахариды в жестких условиях окисляются с распадом цепи, например, глюкоза сгорает по реакции:
С6Н12О6 + 6O2 ® 6СO2 + 6H2O
– важнейшим свойством моносахаридов является их ферментативное брожение, именно так из глюкозы получают пищевой этанол, лимонную кислоту, молочную кислоту и др. Приведем в качестве примера спиртовое брожение глюкозы:
– моносахариды – это простейшие углеводы, они не подвергаются гидролизу в отличие от ди-, олиго- и полисахаридов. Фруктоза – кетоноспирт, она, в отличие от глюкозы и рибозы, не способна окислятся в мягких условиях (не вступает в реакцию серебряного зеркала). Дисахариды
Дисахариды – углеводы, молекулы которых состоят из остатков двух моносахаридов, связанных между собой так называемой гликозидной связью. Наиболее известные дисахариды – это сахароза, мальтоза и лактоза.
В заданиях встречается, в основном, сахароза, перечислим ее свойства: – сахароза не образует открытую форму, поэтому не проявляет свойств ни альдегидов (как глюкоза) ни кетонов (как фруктоза): при нагревании с аммиачным раствором оксида серебра(I) она не дает реакцию «серебряного зеркала», при нагревании с гидроксидом меди(II) не образует красного оксида меди(I); см. опыт: https://youtu.be/_vuPVJ38ScM !!! Надо учесть, что в отличие от сахарозы, мальтоза и лактоза могут в растворе образовывать открытую форму, поэтому мальтоза и лактоза могут проявлять восстанавливающие свойства альдегидов. – как многоатомные спирты, сахароза способна растворять Cu (OH)2: если раствор сахарозы прилить к гидроксиду меди(II), образуется ярко-синий раствор сахарата меди; см. опыт: https://youtu.be/ocdieqlR-Dg
– как дисахарид, сахароза способна распадаться на составляющие моносахариды: при нагревании раствора сахарозы в присутствии кислоты происходит гидролиз по схеме:
С12Н22О11 + Н2О сахароза глюкоза фруктоза см. опыт: https://youtu.be/XkNqOkPP3O0
– обезвоживание концентрированной серной кислотой: концентрированная серная кислота может отнять воду и «обуглить» любой углевод, но особенно эффектно реакция протекает с кристаллами сахарозы: https://youtu.be/p-PQoBt_ssU
Реакцию можно записать как:
С12Н22О11 + H2SO4 конц. изб. ® 12С + 11Н2О(в кислоту) Полисахариды
Полисахариды – сложные углеводы, состоящие из большого количества (до ста тысяч) остатков моносахаридов. Полисахариды – это природные высокомолекулярные соединения. Основные представители – крахмал и целлюлоза.
Крахмал
|
|||||||||||||||||
|
Последнее изменение этой страницы: 2021-04-04; просмотров: 194; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.139.72.78 (0.331 с.) |
 С n (H2O) m + n O2
С n (H2O) m + n O2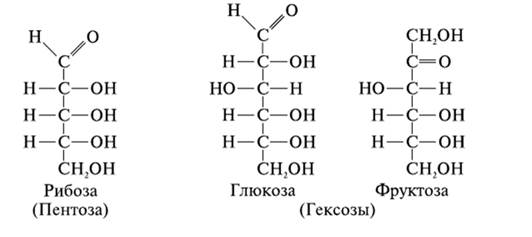
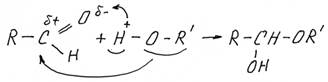


 С6Н12О6 + С6Н12О6
С6Н12О6 + С6Н12О6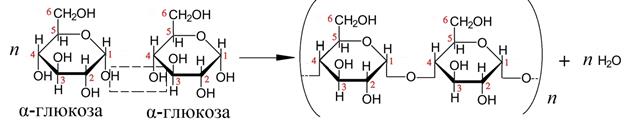
 n С6Н12О6
n С6Н12О6


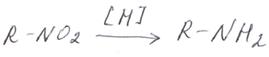
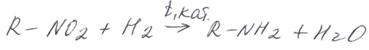
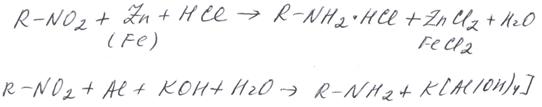
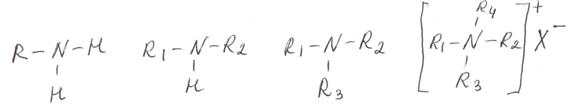
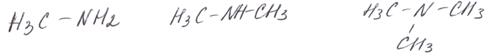
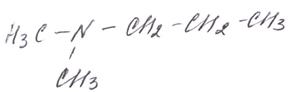 диметилпропиламин
диметилпропиламин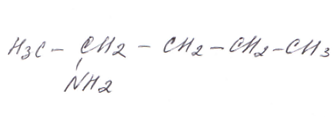 пентанамин-2
пентанамин-2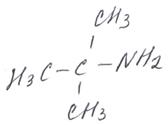 2-метилпропанамин-2
2-метилпропанамин-2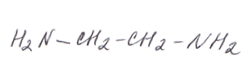 этилендиамин (этандиамин-1,2)
этилендиамин (этандиамин-1,2)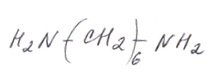 гексаметилендиамин (гександиамин-1,6)
гексаметилендиамин (гександиамин-1,6)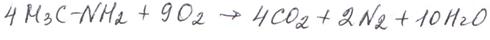
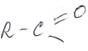 :
:
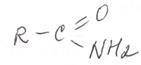
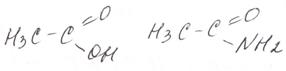
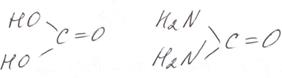
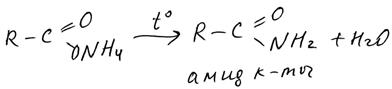
 + NH3 ®
+ NH3 ® 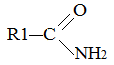 + R2–OH
+ R2–OH