Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Разделение гетерогенных смесейСтр 1 из 4Следующая ⇒
Определение Дисперсной называется система, состоящая из двух или более веществ, причем одно из них в виде очень маленьких частиц равномерно распределено в объеме другого. То вещество, которое присутствует в меньшем количестве и распределено в объеме другого, называют дисперсной фазой. Она может состоять из нескольких веществ. Вещество, присутствующее в большем количестве, в объеме которого распределена дисперсная фаза, называют дисперсионной средой. Между дисперсионной средой и частицами дисперсной фазы существует поверхность раздела, поэтому дисперсные системы называются гетерогенными (неоднородными). И дисперсную среду, и дисперсную фазу могут представлять вещества, находящиеся в различных агрегатных состояниях – твердом, жидком и газообразном. В зависимости от сочетания агрегатного состояния дисперсной среды и дисперсной фазы можно выделить 9 видов таких систем. Таблица. Типы дисперсионных систем.
По величине частиц веществ, составляющих дисперсную фазу, дисперсные системы делятся на:
Дисперсные системы и растворы очень важны в повседневной жизни и в природе. Судите сами: без нильского ила не состоялась бы великая цивилизация Древнего Египта; без воды, воздуха, горных пород и минералов вообще бы не существовала живая планета – наш общий дом – Земля; без клеток не было бы живых организмов и т.д.
Способы разделения смесей (и гетерогенных, и гомогенных) основаны на том факте, что вещества, входящие в состав смеси, сохраняют свои индивидуальные свойства. Гетерогенные смеси могут различаться по составу и фазовому состоянию, например: газ+жидкость; твердое вещество+жидкость; две несмешивающиеся жидкости и др. Основные способы разделения смесей представлены на схеме ниже. Рассмотрим каждый способ отдельно. Разделение гетерогенных смесей Для разделения гетерогенных смесей, представляющих собой системы твердое тело- жидкость или твердое тело - газ, выделяют три основных способа:
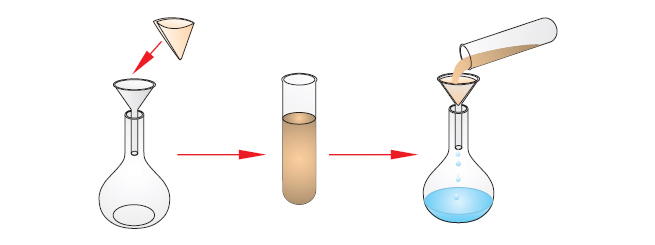
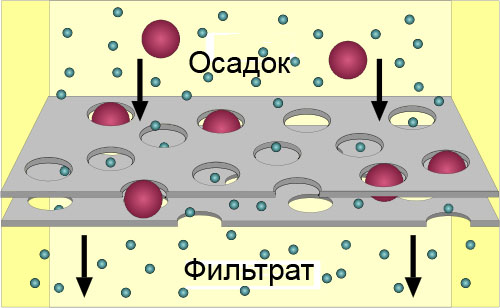
Фильтрование Фильтрование - метод, основанный на различной растворимости веществ и разных размерах частиц компонентов смеси. Фильтрование позволяет отделить твердое вещество от жидкости или газа. Для фильтрования жидкостей можно использовать фильтровальную бумагу, которую обычно складывают в четверо и вставляют в стеклянную воронку.
Воронку помещают в стакана, в который скапливается фильтрат - жидкость, прошедшая через фильтр. Размер пор в фильтровальной бумаге таков, что позволяет молекулам воды и молекулам растворенного вещества беспрепятственно просачиваться. Частицы размером больше 0,01 мм задерживаются на фильтре и не проходят сквозь него, таким образом формируется слой осадка. Запомни! С помощью фильтрования нельзя разделить истинные растворы веществ, то есть растворы, в которых растворение произошло на уровне молекул или ионов.
Кроме фильтровальной бумаги в химических лабораториях используют специальные фильтры с разным размером пор. Фильтрование газовых смесей принципиально не отличается от фильтрования жидкостей. Разница заключается только в том, что при фильтровании газов от твердых взвешенных частиц (ТВЧ) используются фильтры специальных конструкций (бумажный, угольный) и насосы для принудительного прокачивания газовой смеси через фильтр, например фильтрация воздуха в салоне автомобиля или вытяжка над плитой.
Фильтрованием можно разделить:
Отстаивание Метод основан на различной скорости оседания твердых частиц с разным весом (плотностью) в жидкой или воздушной среде. Метод используют для разделения двух и более твердых нерастворимых веществ в воде (или другом растворителе). Смесь нерастворимых веществ помещают в воду, тщательно перемешивают. Спустя некоторое время вещества с плотностью больше единицы оседают на дно сосуда, а вещества с плотностью меньше единицы - всплывают. Если в смеси находится несколько веществ с разной силой тяжести, то в нижнем слое будут отстаиваться более тяжелые вещества, а затем более легкие. Такие слои тоже можно разделить. Раньше так выделяли крупинки золота из измельченной золотоносной породы. Золотоносный песок помещали на наклонный желоб, по которому пускали струю воды. Поток воды подхватывал и уносил пустую породу, а тяжелые крупинки золота оседали на дне желоба. В случае газовых смесей также происходит оседание твердых частиц на твердых поверхностях, например оседание пыли на мебели или листьях растений.
Данным методом можно разделять и несмешивающиеся жидкости. Для этого используют делительную воронку. Например, для разделения бензина и воды смесь помещают в делительную воронку, ждут момента, пока не появится четкая граница раздела фаз. После чего аккуратно открывают краник и в стакан стекает вода. Отстаиванием можно разделить смеси:
Магнитная сепарация Метод основан на разных магнитных свойствах твердых компонентов смеси. Данный метод используют при наличии в смеси веществ-ферромагнетиков, то есть веществ, обладающих магнитными свойствами, например железа. Все вещества, по отношению к магнитному полю, условно можно разделить на три большие группы:
Магнитной сепарацией можно разделит ь:
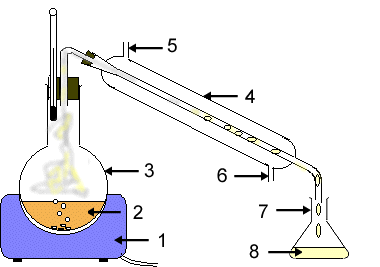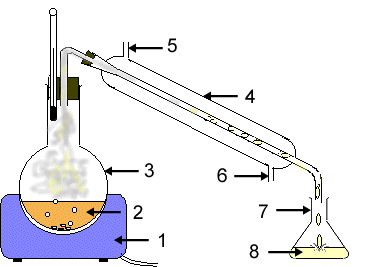
Определение Кристаллизация - фазовый переход вещества из газообразного (парообразного), жидкого или твердого аморфного состояния в кристаллическое. При этом испаренное вещество (воду или растворитель) можно собрать методом конденсирования на более холодной поверхности. Например, если поместить холодное предметное стекло над выпаривательной чашкой, то на его поверхности образуются капли воды. На этом же принципе основан метод дистилляции. Дистилляция. Перегонка. Если вещество, например сахар, разлагается при нагревании, то воду испаряют не полностью – упаривают раствор, а затем из насыщенного раствора осаждают кристаллы сахара. Иногда требуется очистить растворители от примесей, например воду от соли. В этом случае растворитель следует испарить, а затем его пары необходимо собрать и сконденсировать при охлаждении. Такой способ разделения гомогенной смеси называется дистилляцией, или перегонкой.
В природе вода в чистом виде (без солей) не встречается. Океаническая, морская, речная, колодезная и родниковая вода – это разновидности растворов солей в воде. Однако часто людям необходима чистая вода, не содержащая солей (используется в двигателях автомобилей; в химическом производстве для получения различных растворов и веществ; при изготовлении фотографий). Такую воду называют дистиллированной, именно ее применяют в лаборатории для проведения химических опытов. Перегонкой можно разделить:
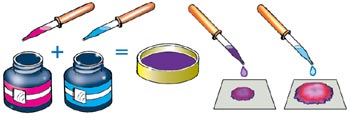
Хроматография Метод разделения и анализа смесей веществ. Основан на разных скоростях распределения исследуемого вещества между двумя фазами - неподвижной и подвижной (элюент). Неподвижная фаза, как правило, представляет собой сорбент (мелкодисперсный порошок, например оксид алюминия или оксид цинка или фильтровальная бумага) с развитой поверхностью, а подвижная - поток газа или жидкости. Поток подвижной фазы фильтруется через слой сорбента или перемещается вдоль слоя сорбента, например по поверхности фильтровальной бумаги.
Можно самостоятельно получить хроматограмму и увидеть сущность метода на практике. Нужно смешать несколько чернил и каплю полученной смеси нанести на фильтровальную бумагу. Затем точно в середину цветного пятнышка начнем по каплям приливать чистую воду. Каждую каплю нужно вносить только после того, как впитается предыдущая. Вода играет роль элюэнта, переносящего исследуемое вещество по сорбенту — пористой бумаге. Вещества, входящие в состав смеси, задерживаются бумагой по-разному: одни хорошо удерживаются ею, а другие впитываются медленнее и продолжают некоторое время растекаться вместе с водой. Вскоре по листу бумаги начнет расползаться настоящая красочная хроматограмма: пятно одного цвета в центре, окруженное разноцветными концентрическими кольцами. Особенно большое распространение получила тонкослойная хроматография, в органическом анализе. Достоинства тонкослойной хроматографии в том, что можно использовать простейший и очень чувствительный метод детектирования – визуальный контроль. Проявлять невидимые глазу пятна можно различными реактивами, а также используя ультрафиолетовый свет или авторадиографию.
В анализе органических и неорганических веществ применяют хроматографию на бумаге. Разработаны многочисленные методы разделения сложных смесей ионов, например смесей редкоземельных элементов, продуктов деления урана, элементов группы платины. Определение Экстракция - метод разделения, очистки и выделения веществ, основанный на процессе распределения вещества между двумя несмешивающимися растворителями. Одним из несмешивающихся растворителей обычно является вода, вторым – органический растворитель, однако это не обязательно. Экстракционный метод отличается универсальностью, он пригоден для выделения почти всех элементов в различных концентрациях. Экстракция позволяет разделять сложные многокомпонентные смеси зачастую эффективнее и быстрее, чем другие методы. Выполнение экстракционного отделения или разделения не требует сложного и дорогостоящего оборудования. Процесс может быть автоматизирован, при необходимости им можно управлять на расстоянии. Определение Сорбция - метод выделения и очистки веществ, основанный на поглощении твердым телом (адсорбция) или жидкостью-сорбентом (абсорбция) различных веществ (сорбатов) из газовых или жидких смесей. Чаще всего в промышленности методы абсорбции используют для очистки газовоздушных выбросов от частиц пыли или дыма, а также токсичных газообразных веществ. В случае поглощения газообразных веществ, между сорбентом и растворенным веществом может протекать химическая реакция. Например, при поглощении газообразного аммиака NH3 раствором азотной кислоты образуется нитрат аммония NH4NO3 (аммиачная селитра), который можно использовать в качестве высокоэффективного азотного удобрения. Определение Процесс, при котором происходит абсорбция растворенного вещества за счет протекания химической реакции, называется хемосорбцией. Адсорбцию также используют для очистки воды от химических растворимых примесей. Например, фильтры для питьевой воды работают на принципе адсорбции слоем активированного угля с ионами серебра. Помимо поглощения всем объемом жидкого сорбента (абсорбции), и поверхностным слоем сорбента (адсорбции), выделяют также сорбцию твердого тела или расплава (окклюзию). При сорбции паров твердыми веществами часто происходит капиллярная конденсация.
Массовая доля растворённого вещества это безразмерная величина, равная отношению массы растворённого вещества к общей массе раствора: ωв-ва=mв-ва/mр-ра(⋅100%) Объемная доля (для газов) Для характеристики газовой смеси используют похожую величину - объемную долю. Объемная доля равна отношению объема газа к общему объему газовой смеси. Выражается в % или является безразмерной величиной:
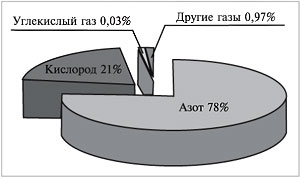
Самым распространенным примером газовой смеси можно смело назвать воздух. Если бы нам удалось разделить 100 л воздуха на отдельные газообразные компоненты, мы получили бы около 78 л азота, 21 л кислорода, 30 мл углекислого газа, в оставшемся объеме содержались бы так называемые благородные газы (главным образом аргон) и некоторые другие.
Рассчитаем объемную долю каждого газа:
φ(N2)+φ(O2)+φ(CO2)+φ(др.газов)=78%+21%+0,03%+0,97%=100% Тот воздух, который мы выдыхаем, гораздо беднее кислородом (его объемная доля снижается до 16%), зато содержание углекислого газа возрастает до 4%. Такой воздух для дыхания уже непригоден. Вот почему помещение, в котором находится много людей, надо регулярно проветривать. Мольная доля Мольная доля растворенного вещества показывает, какую часть от суммарного количества всех веществ, входящих в состав раствора, составляет количество растворенного вещества В. Находят мольную долю растворенного вещества c как отношение числа моль растворенного вещества А к общему числу моль всех веществ в растворе: η(A)= n(A) *100% n(A)+n(B) Молярная концентрация C показывает, сколько моль растворённого вещества содержится в 1 литре раствора. Cв-ва=nв-ва/V=mв-ва/Mв-ва ⋅V
где Mв-ва - молярная масса растворенного вещества г/моль. Молярная концентрация измеряется в моль/л и обозначается "M". Например, 2 M NaOH - двухмолярный раствор гидроксида натрия. Один литр такого раствора содержит 2 моль вещества или 80 г (M(NaOH) = 40 г/моль). Кроме перечисленных способов выражения концентрации вещества следует также отметить моляльность и нормальность раствора. В аналитической химии часто используют титр. Все перечисленные способы выражения концентрации обобщены в таблице:
НОРМАЛЬНАЯ КОНЦЕНТРАЦИЯ (нормальность раствора) Нормальность раствора обозначает число грамм-эквивалентов данного вещества в одном литре раствора или число миллиграмм-эквивалентов в одном миллилитре раствора. Cн=n(экв.)/V=C⋅z где z -число эквивалентности, C - молярная концентрация Определение Грамм - эквивалентом вещества называется количество граммов вещества, численно равное его эквиваленту. Для сложных веществ - это количество вещества, соответствующее прямо или косвенно при химических превращениях 1 грамму водорода или 8 граммам кислорода. z(основания) = М(основания) / число замещаемых в реакции гидроксильных групп z(кислоты) = М(кислоты) / число замещаемых в реакции атомов водорода z(соли) = М(соли) / произведение числа катионов на его заряд Величины нормальности обозначают буквой "Н". Например, децинормальный раствор серной кислоты обозначают "0,1 Н раствор H2SO4". Так как нормальность может быть определена только для данной реакции, то в разных реакциях величина нормальности одного и того же раствора может оказаться неодинаковой. Так, одномолярный раствор H2SO4 будет однонормальным, когда он предназначается для реакции со щёлочью с образованием гидросульфата NaHSO4, и двухнормальным в реакции с образованием Na2SO4. МОЛЯЛЬНАЯ КОНЦЕНТРАЦИЯ (моляльность раствора) Концентрацию раствора можно выразить количеством молей растворённого вещества в 1000 г растворителя. Такое выражение концентрации называют моляльностью раствора. Моляльная концентрация (моляльность) равна числу молей растворенного вещества в 1 килограмме (1000 г.) растворителя. Единица измерения - [моль/кг]: m=n(в-ва)/m(р-ра) ТИТР показывает, сколько граммов растворённого вещества X содержится в 1 мл или в 1 см3 раствора:
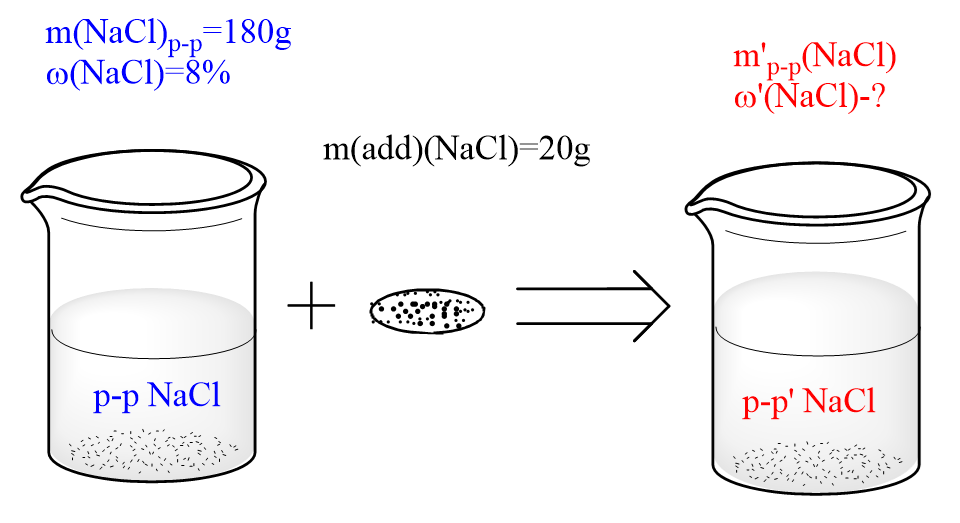
Т=m(в-ва)/V(р-ра) Задача Сколько граммов воды надо испарить из 800 г 15%-го раствора вещества, чтобы увеличить его массовую долю на 5%? Решение ДАНО: ω(в-ва)=15%=0,15 m(p-pa)=800г ω'(в-ва)=(15+5)%=20%=0,2 НАЙТИ: mисп.(H2O)=? РЕШЕНИЕ: 1)Найдем массу растворенного вещества в исходном растворе: m(в-ва)=ω(в-ва) ⋅ m(p−pa)=0,15 ⋅ 800г=120г 2) Поскольку испаряется только вода, масса вещества остается неизменной: m(в-ва) = m'(в-ва)=120г 3) Зная массу растворенного вещества и его массовую долю, найдем массу полученного раствора: m′(р-ра)=m(в-ва)/ω(в-ва)=120г/0,2=600г Масса испаренной воды - разность масс полученного и исходного растворов: mисп.(H2O)= m(р-ра) - m'(р-ра) = 800г - 600г = 200г Задача К 180 г 8-%-ного раствора хлорида натрия добавили 20 г NaCl. Массовая доля хлорида натрия в образовавшемся растворе равна __ %. Решение
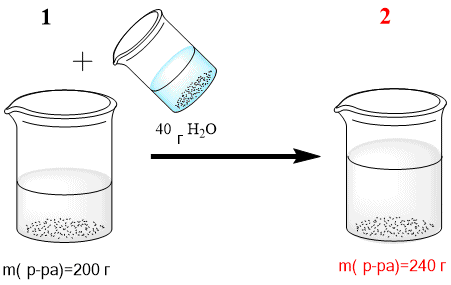
Дано: W (NaCl)=8%=0,08 m(p-pa)=180г mдоб(NaCl) =20г НАЙТИ: ω'(NaCl)=? РЕШЕНИЕ: 1)Найдем массу образовавшегося раствора: m’(p-pa)= m(p-pa) + mдоб (NaCl) = 180г + 20г = 200г 2) Найдем общую массу хлорида натрия в образовавшемся растворе: m’(NaCl) = m(NaCl) + m доб (NaCl) Для этого сначала посчитаем массу m(NaCl) в начальном растворе: m(NaCl)=ω(NaCl) ⋅ m(p−pa)/100%=8% ⋅ 180г/100%=14,4г m’(NaCl)= m(NaCl) + mдоб (NaCl) = 14.4г + 20г=34.4г 3) Найдем массовую долю соли в полученном растворе: ω′(NaCl)=m′(NaCl)/m′(p−pa) ⋅ 100%=34,4г/200г ⋅ 100%=17,2% Ответ: 17,2% Задача К 200г 15-%-ного раствора хлорида натрия добавили 40 г воды. Определите массовую долю соли в полученном растворе. Решение
ДАНО: ω(NaCl)=15%=0,15 m(p-pa)=200г mдоб(H2O) =40г НАЙТИ: ω'(NaCl)=? РЕШЕНИЕ: 1)Найдем массу образовавшегося раствора: m’(p-pa)= m(p-pa) + mдоб (H2O) = 200г + 40г = 240г 2) Найдем массу хлорида натрия в исходном растворе: m(NaCl)=ω(NaCl) ⋅ m(p−pa)/100%=15% ⋅ 200г/100%=30г Масса хлорида натрия остается неизменной и в полученном растворе: m(NaCl)=m′(NaCl) 3) Найдем массовую долю соли в полученном растворе: ω′(NaCl)=m(NaCl)/m′(p−pa) ⋅ 100%=30г/240г ⋅ 100%=12,5% Ответ: 12,5% Задача Определите массовую долю сульфата натрия в растворе, полученном сливанием 120г 10%-ного раствора Na2SO4 и 200г 4%-ного раствора того же вещества. ДАНО: ω1(Na2SO4)=10%=0,1 m1(p-pa)=120г ω2(Na2SO4)=4%=0,04 m2(p-pa)=200г НАЙТИ: ω3'(Na2SO4)=? РЕШЕНИЕ: 1)Найдем массу образовавшегося раствора: m3(p−pa)=m1(p−pa)+m2(p−pa)=120г+200г=320г 2) Найдем массу сульфата натрия в первом растворе:
m1(Na2SO4)=ω1(Na2SO4)⋅m1(p−pa)/100%=10%⋅120г/100%=12г Масса сульфата натрия во втором растворе:
m2(Na2SO4l)=ω2(Na2SO4)⋅m2(p−pa)/100%=4%⋅200г/100%=8г Таким образом, масса соли в полученном растворе будет равна:
m3(Na2SO4)=m1(Na2SO4)+m2(Na2SO4)=12г+8г=20г 3) Найдем массовую долю соли в полученном растворе: ω3(Na2SO4)=m3(Na2SO4)/m3(p−pa)⋅100%=20г/320г⋅100%=6,25% Ответ: 6,25%
Определение Дисперсной называется система, состоящая из двух или более веществ, причем одно из них в виде очень маленьких частиц равномерно распределено в объеме другого. То вещество, которое присутствует в меньшем количестве и распределено в объеме другого, называют дисперсной фазой. Она может состоять из нескольких веществ. Вещество, присутствующее в большем количестве, в объеме которого распределена дисперсная фаза, называют дисперсионной средой. Между дисперсионной средой и частицами дисперсной фазы существует поверхность раздела, поэтому дисперсные системы называются гетерогенными (неоднородными). И дисперсную среду, и дисперсную фазу могут представлять вещества, находящиеся в различных агрегатных состояниях – твердом, жидком и газообразном. В зависимости от сочетания агрегатного состояния дисперсной среды и дисперсной фазы можно выделить 9 видов таких систем. Таблица. Типы дисперсионных систем.
По величине частиц веществ, составляющих дисперсную фазу, дисперсные системы делятся на:
Дисперсные системы и растворы очень важны в повседневной жизни и в природе. Судите сами: без нильского ила не состоялась бы великая цивилизация Древнего Египта; без воды, воздуха, горных пород и минералов вообще бы не существовала живая планета – наш общий дом – Земля; без клеток не было бы живых организмов и т.д. Способы разделения смесей (и гетерогенных, и гомогенных) основаны на том факте, что вещества, входящие в состав смеси, сохраняют свои индивидуальные свойства. Гетерогенные смеси могут различаться по составу и фазовому состоянию, например: газ+жидкость; твердое вещество+жидкость; две несмешивающиеся жидкости и др. Основные способы разделения смесей представлены на схеме ниже. Рассмотрим каждый способ отдельно. Разделение гетерогенных смесей Для разделения гетерогенных смесей, представляющих собой системы твердое тело- жидкость или твердое тело - газ, выделяют три основных способа:
Фильтрование Фильтрование - метод, основанный на различной растворимости веществ и разных размерах частиц компонентов смеси. Фильтрование позволяет отделить твердое вещество от жидкости или газа. Для фильтрования жидкостей можно использовать фильтровальную бумагу, которую обычно складывают в четверо и вставляют в стеклянную воронку.
Воронку помещают в стакана, в который скапливается фильтрат - жидкость, прошедшая через фильтр. Размер пор в фильтровальной бумаге таков, что позволяет молекулам воды и молекулам растворенного вещества беспрепятственно просачиваться. Частицы размером больше 0,01 мм задерживаются на фильтре и не проходят сквозь него, таким образом формируется слой осадка. Запомни! С помощью фильтрования нельзя разделить истинные растворы веществ, то есть растворы, в которых растворение произошло на уровне молекул или ионов.
Кроме фильтровальной бумаги в химических лабораториях используют специальные фильтры с разным размером пор. Фильтрование газовых смесей принципиально не отличается от фильтрования жидкостей. Разница заключается только в том, что при фильтровании газов от твердых взвешенных частиц (ТВЧ) используются фильтры специальных конструкций (бумажный, угольный) и насосы для принудительного прокачивания газовой смеси через фильтр, например фильтрация воздуха в салоне автомобиля или вытяжка над плитой. Фильтрованием можно разделить:
Отстаивание Метод основан на различной скорости оседания твердых частиц с разным весом (плотностью) в жидкой или воздушной среде. Метод используют для разделения двух и более твердых нерастворимых веществ в воде (или другом растворителе). Смесь нерастворимых веществ помещают в воду, тщательно перемешивают. Спустя некоторое время вещества с плотностью больше единицы оседают на дно сосуда, а вещества с плотностью меньше единицы - всплывают. Если в смеси находится несколько веществ с разной силой тяжести, то в нижнем слое будут отстаиваться более тяжелые вещества, а затем более легкие. Такие слои тоже можно разделить. Раньше так выделяли крупинки золота из измельченной золотоносной породы. Золотоносный песок помещали на наклонный желоб, по которому пускали струю воды. Поток воды подхватывал и уносил пустую породу, а тяжелые крупинки золота оседали на дне желоба. В случае газовых смесей также происходит оседание твердых частиц на твердых поверхностях, например оседание пыли на мебели или листьях растений.
Данным методом можно разделять и несмешивающиеся жидкости. Для этого используют делительную воронку. Например, для разделения бензина и воды смесь помещают в делительную воронку, ждут момента, пока не появится четкая граница раздела фаз. После чего аккуратно открывают краник и в стакан стекает вода. Отстаиванием можно разделить смеси:
Магнитная сепарация Метод основан на разных магнитных свойствах твердых компонентов смеси. Данный метод используют при наличии в смеси веществ-ферромагнетиков, то есть веществ, обладающих магнитными свойствами, например железа. Все вещества, по отношению к магнитному полю, условно можно разделить на три большие группы:
Магнитной сепарацией можно разделит ь:
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2021-03-09; просмотров: 287; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.141.24.134 (0.134 с.) |