
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Теплотворная способность топлива и пищи
Наиболее распространенными химическими реакциями, используемыми для получения теплоты, являются реакции горения. Энергия, выделяемая при сгорании топлива или пищи, называется теплотворной способностью или калорийностью топлива и измеряется в кДж/кг.
10
Калорийность пищевых продуктов В процессе пищеварения пища перерабатывается с образованием глюкозы, жира и других веществ, при окислении которых выделяется энергия. Большая часть энергии, в которой нуждается наш организм, поступает из углеводов и жиров. В процессе пищеварения углеводы разлагаются на глюкозу. В качестве примера рассмотрим расчет теплового эффекта реакции при окислении одного моля глюкозы С6Н12О6. Глюкоза растворима в крови и переносится потоком крови к клеткам организма, где реагирует с кислородом в несколько стадий, превращаясь в конечном итоге в СО2 и Н2О с выделением энергии: С6Н12О6 + 6О2 ––> 6СО2(г) + 6Н2О(ж)+ Q DН = [6DHобр (H2O) + 6DHобр (CO2)] – [DHобр(C6H12O6)] = - 2816 кДж Простой расчет показывает, что калорийность глюкозы составляет 17 кДж/г или 17000 кДж/кг. Разложение углеводов происходит быстро, поэтому их энергия сразу же поступает в организм. Из-за быстрого окисления и высокой растворимости углеводов в организме запасается их небольшое количество и по этой причине они не могут быть долговременными источниками энергии Жиры также окисляются до СО2 и Н2О. Например, сгорание типичного жира стеарина С57Н110О6, происходит по уравнению: С57Н110О6 + 163/2 О2 = 57СО2 + 55 Н2О + 75520 кДж, что соответствует калорийности жира, равной 38000 кДж/кг. Сгорание жиров всего в 1,25 раза менее эффективно сгоранию бензина (октана): С8Н18 + 25/2 О2 = 8СО2 + 9Н2О Калорийность октана составляет 48000 кДж/кг. Существуют 2 причины, по которым жиры оказываются более удобными для хранения энергии в организме человека: жиры выделяют больше энергии в расчете на 1 г и они нерастворимы в воде, что позволяет им накапливаться. 11 В среднем взрослому человеку требуется около 6300 кДж/сутки, если он находится в покое и теплом помещении. При выполнении работы эта цифра возрастает до 10000 – 13000 кДж/сутки.
Взаимосвязь между ΔН и ΔU реакций, протекающих с участием газообразных веществ
В общем случае энтальпия и внутренняя энергия химической реакции мало зависят от температуры, при которой проводится реакция и в прикидочных расчетах влиянием температуры на эти величины обычно пренебрегают. В расчетах, требующих большей
точности, необходимо воспользоваться уравнениями Кирхгофа, которые описаны в специальной литературе. В реакциях, где участвуют или образуются газообразные вещества, связь между DН и ∆U описывается уравнением:
D Н = ∆U + р∆V = ∆U + ∆nRT (9) ∆n – изменение числа моль газообразных веществ. С2Н2 (г)+ 3/2 О2 (г) = Н2О(ж) + 2 СО2 ∆n = + 0,5 моль Cu(кр)+4HNO3(р) = 2NO2(г) + Cu(NO3)2(кр) +2 H2O(ж) ∆n = + 2,0 моль N2 (г) + 3H2 (г) = 2 NH3(г) ∆n = - 2,0 моль С точки зрения 1-го закона термодинамики нет никаких препятствий тому, что весь тепловой эффект химической реакции, например горения угля или газа был бы превращен в паровой машине в работу. Однако, весь опыт человечества показывает, что только часть тепловой энергии Q может быть превращена в работу A. Их отношение η = Q/А называется КПД (коэффициент полезного действия), который всегда меньше единицы η < 1.
12 ВТОРОЙ ЗАКОН ТЕРМОДИНАМИКИ
Первый закон термодинамики позволяет рассчитать тепловой эффект процесса, однако не дает ответа на вопросы о направлении и глубине протекания процесса и будет ли процесс протекать самопроизвольно или для его протекания необходимо подвести энергию извне. Самопроизвольные процессы идут сами по себе и не требуют затрат внешней энергии. Второй закон термодинамики дает возможность определить, какой из процессов будет протекать самопроизвольно и какое количество работы может быть при этом получено, а также насколько глубоко будет протекать процесс. Подобно первому закону, второе начало термодинамики выведено непосредственно из опыта. Самопроизвольные процессы в конечном итоге всегда приходят к состоянию равновесия, т.е. к состоянию, когда переход в прямом направлении и обратном равновероятен.
Суть обобщенных формулировок второго закона заключается в следующем: если некая реальная система получила от нагревателя определенное количество теплоты Q и совершила при этом работу А, то эта работа всегда меньше полученной теплоты, т.е. А<Q. Таким образом, можно принять, что внутренняя энергия системы состоит из двух составляющих: "свободной" X и "связанной" Y энергий, причем "свободная" энергия может быть переведена в работу, а "связанная" энергия рассеивается в окружающем пространстве в виде теплоты.
U = X + Y (10) Мерой связанной энергии является новая термодинамическая функция состояния, называемая энтропией.
13 Любой системе в данный момент времени соответствует множество микросостояний, которые реализуются во множестве элементарных объемов системы и меняются в каждый следующий момент времени. В каждом элементарном объеме все время меняются температура, давление, плотность, вязкость и т.д., что в жидкостях и газах связано с броуновским движением частиц (молекул, атомов, ионов). Если в микрообъеме частицы сталкиваются, то в нем повышаются давление, температура, плотность и т.д., если частицы разлетаются в разные стороны, то, наоборот, происходит уменьшение этих величин. В твердых телах микростояния меняются из-за тепловых колебаний частиц в узлах кристаллической решетки. На практике, измеряемые нами с помощью градусников, пирометров или манометров, температуры и давления являются средними величинами, складывающихся из температур и давлений в отдельных элементарных объемах системы. Появление того или конкретного микросостояния и их комбинаций в системе не предсказуемо и по этой причине, появление той или иной комбинации микросостояний, можно охарактеризовать только с позиций теории вероятности. Число возможных комбинаций, которые могут реализоваться в системе определяет ТЕРМОДИНАМИЧЕСКУЮ ВЕРОЯТНОСТЬ СОСТОЯНИЯ ВЕЩЕСТВА (W). Чем меньше число возможных микросостояний в системе, тем система более упорядочена, численные значения W малы и больше вероятность появления того или иного микросостояния. В пределе, в совершенном кристалле (без дефектов и без примесей), при температурах, близких к 0 К, мы имеем одну, не меняющуюся со временем комбинацию микросостояний. Картина статична, атомы в решетке не колеблются и W = 1. Наоборот, если число возможных состояний велико, то система неупорядочена и W → ∞. Таким образом, число возможных комбинаций микростояний в системе может меняться в широких пределах (1 ≤ W ≤ ∞). Как видно, число возможных микросостояний в системе может быть очень велико, так как во всех элементарных объемах системы (вещества) постоянно меняются координаты и импульсы частиц, давление, вязкость, плотность, температура и другие параметры, то охарактеризовать 14 термодинамическую вероятность состояния вещества W с помощью таких больших чисел крайне неудобно, а порой и невозможно. По этой причине, за меру числа микростояний, характеризующих неупорядоченность системы, приняли логарифмическую функцию, которую назвали энтропией:
S = R ∙ ln W (Дж / моль. К) (11) Здесь R – газовая постоянная, W – число возможных микростояний системы. Таким образом, энтропия есть логарифмическая функция состояния, описывающая степень неупорядоченности системы. Энтропия возрастает с усложнением однотипных молекул, с увеличением числа частиц, с увеличением объема, Т оС и при растворении твердых веществ. Например: S(газ) S2 (газ) S, Дж/моль.К 168 228 UC12 UC13 UC14 UC15 S, Дж/моль.К 79 150 198 213 NO NO2 N2O3 N2O5 S, Дж/моль.К 211 240 307 356
Химическая реакция, связанная с увеличением объема, также характеризуется возрастанием энтропии: СаСО3(к) = СаО(к) + СО2(г) ∆S >0 ∆n >0 С(к) + О2(г) = СО2(г) ∆S ≈ 0 ∆n ≈ 0 MgO(к) + СО2(г) = MgCO3(к) DS <0 ∆n <0 Здесь ∆n – изменение числа молей газообразных веществ, которые и вносят наибольший вклад в изменение энтропии химической реакции. Чаще всего мы имеем дело с тремя состояниями вещества. Для большинства веществ характерны переходы: ТВ → ЖИДК → ГАЗ (вода, металлы, большинство твердых и газообразных металлоидов). Для них изменение энтропии с температурой имеет вид (рис.2). 15
жидк
тв
Рис. 2. Изменение энтропии в зависимости от температуры при наличии фазовых переходов твердое тело – жидкость - газ
Для некоторых веществ промежуточное, жидкое состояние, отсутствует, и твердое вещество сразу же переходит в газовую фазу. Это процесс называется сублимацией. Такие переходы наблюдаются для J2ТВ → 2Jгаз; SТВ → S газ. Для этого случая изменение энтропии с температурой меняется согласно данным рис. 3.
газ
0 Тисп Т, К Рис. 3. Изменение энтропии в зависимости от температуры при наличии процесса сублимации вещества
16 Для фазовых переходов, происходящих в изобарно-изотермических условиях, изменение энтропии равно:
∆Sфп = ∆Нф.п./Tфп; (Р = const) (12)
Для фазовых переходов, происходящих в изохорно-изотермических условиях, изменение энтропии равно:
∆Sфп = ∆Uф.п./Tфп; (V=const) (13)
Изменение энтропии для реакции а А + вВ = сС + дД может быть рассчитано по уравнению: ∆ S0хр = [сS0 (С) + дS0(Д)] – [а S0 (А) + вS0(В)] (14) или D S0 хр = S (n i S0i) прод - S (n i S0i) исх (15)
ПОСТУЛАТ ПЛАНКА (Третий закон термодинамики)
В 1911 году М. Планк высказал постулат: Энтропия правильно сформированного кристалла чистого вещества при абсолютном нуле равна нулю. Следует подчеркнуть, что вещество в этом случае должно быть абсолютно чистым, а сам кристалл не должен иметь дефектов, так как все эти факторы увеличивают число микросостояний вещества, а значит и энтропию. Изменение энтропии при переходе от Т = 0 К к температуре 25 0С равно ∆S = S298 – S0 но S0 = 0 и поэтому энтропия при стандартных условиях и таблицах измеряется не как ∆S, а в значениях S298 .
17
|
|||||||||||||||||||||
|
Последнее изменение этой страницы: 2021-02-07; просмотров: 79; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.223.106.232 (0.034 с.) |
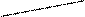 S, Дж/моль.К газ
S, Дж/моль.К газ

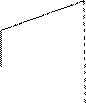

 0 Тпл Тисп Т, К
0 Тпл Тисп Т, К
 S, Дж/моль.К
S, Дж/моль.К 
 тв
тв 



