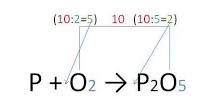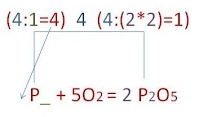Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Алгоритм составления уравнения химической реакцииСодержание книги
Поиск на нашем сайте
ЗАДАНИЯ ДЛЯ ЗАКРЕПЛЕНИЯ №1. Преобразуйте следующие схемы в уравнения химических реакций расставив необходимые коэффициенты и заменив стрелки на знак равенства: Zn + O2 → ZnO Fe + Cl2→ FeCl3 Mg + HCl → MgCl2 + H2 Al(OH)3 → Al2O3 + H2O HNO3→ H2O+NO2+O2 CaO+H2O→ Ca(OH)2 H2+Cl2→ HCl KClO3→ KClO4+KCl Fe(OH)2+H2O+O2→ Fe(OH)3 KBr+Cl2→ KCl+Br2 №2. Используя алгоритм составления уравнений химических реакций, составьте уравнения реакций взаимодействия между следующими парами веществ: 1) Na и O2 2) Na и Cl2 3) Al и S
3. Закон постоянства состава вещества
Вы изучали знаки химических элементов, их произношение, порядковый номер; изучали, что такое «относительная атомная масса». Вспомним, что ученые прошлого пытались создать атомно-молекулярную теорию, но эти разработки во второй половине 18 века не продвинулись вперед. Для окончательного формирования этого учения не хватало знания законов, определяющих отношения между количеством веществ реагирующих друг с другом и образующихся при химических реакциях. Эти законы были открыты лишь в конце 18 в начале 19 века. В результате установления закона сохранения массы с конца 18 века в химии прочно утвердились количественные методы исследования. Был изучен количественный состав многих веществ. При этом был установлен закон постоянства состава вещества. Представьте себе на минутку: Вы закончили медуниверситет и открыли частную стоматологическую клинику. К Вам пришел пациент, которому Вы поставили диагноз: «Кариес». Кариес зубов - самая распространенная болезнь нашего времени. Если ее запустить, кариозная полость доходит до пульпы – ткани, содержащей нервы, кровеносные и лимфатические сосуды. Зуб очень болит. Чтобы обезболить, врач вынужден убить нерв. Для этого используется «мышьяк» - паста, содержащая мышьяковистую кислоту, вещество, имеющее определенный состав. Это вещество быстро проникло в пульпу, и через 24-48 часов зуб был мертв. Теперь Вы можете поставить пломбу. - Как узнать формулу этого вещества (мышьяковистой кислоты)? - В каком соотношении находятся элементы в этом веществе? - Это вещество имеет постоянный или переменный состав? Отвечая на эти вопросы, сформулируйте, пожалуйста, цели и задачи сегодняшнего урока. Вывод: в ходе сегодняшнего урока мы изучим закон постоянства состава вещества; научимся применять закон на практике; научимся отличать вещества постоянного состава от переменного. Ученые XVII-XVIII вв. проводили множество количественных измерений, в т.ч. по определению массовой доли элемента в веществе. Но результаты их опытов были неточными, и как следствие, не совпадали. Французский химик Клод Луи Бертолле пытался доказать, что состав веществ зависит от пропорций, в которых находятся реагирующие вещества. В отличие от него другой французский химик Жозеф Луи Пруст провел много экспериментов по исследованию состава различных веществ и сделал вывод о постоянстве состава вещества. Формулировка, предложенная Прустом, гласит: когда несколько элементов образуют химически чистый образец, то он состоит из одних и тех же атомов. Отношения их масс и числа также носят постоянный характер. Примеры: 1. Хлорид натрия (NaCl) можно получить при взаимодействии соляной кислоты с гидроксидом натрия. Второй способ — обработка соляной кислотой карбоната натрия. В двух разных химических реакциях получаем соединение, формула которого NaCl. И в первом, и во втором случае вещество содержит 39,33% натрия и 60,66% хлора.2. 2. Кислород (химический знак O) при образовании молекулы воды соединяется с одним и тем же количеством водорода (H). Если взаимодействует 1,11 г водорода с 8,89 г кислорода, то образуется 10 г воды (H2O). Увеличение количества одного из веществ приводит к такому же результату. Не прореагируют атомы того элемента, которого взяли в избытке. Масса воды в этом опыте остается такой же – 10 г, состав ее молекул отражает формула H2O, то образуется 10 г воды (H2O). Увеличение количества одного из веществ приводит к такому же результату. Не прореагируют атомы того элемента, которого взяли в избытке. Масса воды в этом опыте остается такой же – 10 г, состав ее молекул отражает формула H2O. Суть закона В своей работе «Исследование меди» в 1799 г. Пруст показал, что природный карбонат меди и карбонат меди, полученный химиками в лаборатории, имеют один и тот же состав. Ничем не различаются вода, текущая из нашего крана, вода из родника, или вода, полученная синтетическим путем (имеется в виду состав чистого вещества – воды, а не состав смеси). Вода всегда будет содержать по массе 11,1 % водорода и 88,9 % кислорода.
|
||||||
|
Последнее изменение этой страницы: 2021-02-07; просмотров: 301; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.119 (0.007 с.) |