
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Закон постоянства состава вещества.Содержание книги Поиск на нашем сайте
К основным законам химии относится закон постоянства состава: Всякое чистое вещество независимо от способа его получения всегда имеет постоянный качественный и количественный состав. Атомно-молекулярное учение позволяет объяснить закон постоянства состава. Поскольку атомы имеют постоянную массу, то и массовый состав вещества в целом постоянен. Закон постоянства состава впервые сформулировал французский ученый-химик Ж.Пруст в 1808 г
В этой формулировке закона, как и в приведенной выше, подчеркивается постоянство состава соединения независимо от способа получения и места нахождения. Чтобы получить сульфид железа(II), мы смешивали железо и серу в соотношении 7:4. Посмотрите видео-эксперимент. Если смешать их в другой пропорции, например 10:4, то химическая реакция произойдет, но 3 г железа в реакцию не вступит. Почему наблюдается такая закономерность? Известно, что в сульфиде железа (II) на каждый один атом железа приходится один атом серы. Следовательно, для реакции нужно брать вещества в таких массовых соотношениях, чтобы сохранялось соотношение атомов железа и серы (1:1). Поскольку численные значения атомных масс Fe, S и их относительных атомных масс Ar(Fe), Ar(S) совпадают, можно записать:Ar(Fe):Ar(S) = 56:32 = 7:4. Отношение 7:4 сохраняется постоянно, в каких бы единицах массы ни выражать массу веществ (г, кг, т, а.е.м.). Большинство химических веществ обладает постоянным составом.
Развитие химии показало, что наряду с соединениями постоянного состава существуют соединения переменного состава. По предложению Н.С. Курнакова первые названы дальтонидами (в память английского химика и физика Дальтона), вторые – бертоллидами (в память французского химика Бертолле, предвидевшего такие соединения). Состав дальтонидов выражается простыми формулами с целочисленными стехиометрическими индексами, например Н2О, НCl, ССl4, СO2. Состав бертоллидов изменяется и не отвечает стехиометрическим отношениям.
Дальтониды – вещества постоянного качественного и количественного состава, которые не зависят от способа их получения. Бертоллиды – соединения переменного состава, не подчиняющиеся законам постоянства состава вещества и закону кратных отношений Пример: V0.9-1.3, TiO1.46-1.56 В связи с наличием соединений переменного состава в современную формулировку закона постоянства состава следует внести уточнение. В связи с наличием соединений переменного состава в современную формулировку закона постоянства состава следует внести уточнение. Cостав соединений молекулярной структуры, т.е. состоящих из молекул, - является постоянным независимо от способа получения. Состав же соединений с немолекулярной структурой (с атомной, ионной и металлической решеткой) не является постоянным и зависит от условий получения. Поскольку атомы имеют постоянную массу, то и массовый состав вещества в целом постоянен. На основе закона постоянства состава вещества можно производить различные расчеты. Задача №1. В каких массовых отношениях соединяются химические элементы в серной кислоте, химическая формула которой H2SO4? Решение: Используя ПСХЭ найдём относительные атомные массы химических элементов: Определим массовые отношения этих элементов в формуле H2SO4 m(H): m(S): m(O) = 2Ar(H): Ar(S): 4Ar(O) = 2: 32: 64 = 1: 16: 32 Таким образом, чтобы получить 49 г серной кислоты (1+16+32=49), необходимо взять 1 г - Н, 16 г - S и 32 г - О. Задача №2. Водород соединяется с серой в массовых отношениях 1:16. Используя данные об относительных атомных массах этих элементов, выведите химическую формулу сероводорода. Решение: Используя ПСХЭ найдём относительные атомные массы химических элементов: Ar(H)=1, Ar(S)=32. Обозначим количество атомов водорода в формуле - х, а серы - у: НхSу m(H): m(S) = хAr(H): уAr(S)= х1: у32 = (2х1): (1х32) = 2: 32 = 1: 16 Следовательно, формула сероводорода Н2S Задача №3. Выведите формулу сульфата меди, если массовые отношения в нём меди, серы и кислорода соответственно равны 2:1:2? Решение: Используя ПСХЭ найдём относительные атомные массы химических элементов: Ar(Cu)=64, Ar(S)=32, Ar(O)=16. Обозначим количество атомов меди в формуле - х, серы - у, а кислорода - z: CuxSyOz
m(Cu): m(S): m(O) = хAr(Cu): уAr(S): zAr(O) = x64: y32: z16 = (1х64): (1х32): (4*16) = 64:32:64 = 2:1:2
ЗАДАНИЯ ДЛЯ ЗАКРЕПЛЕНИЯ
Решите задачи №1. Применяя сведения об относительных атомных массах химических элементов, вычислите массовые отношения элементов в угольной кислоте, химическая формула которой H2CO3. №2. Определите массу кислорода, реагирующего без остатка с 3 г водорода, если водород и кислород в данном случае соединяются соответственно в соотношении 1:8? №3. Углерод и кислород в углекислом газе соединяются в массовых отношениях 3:8. Выведите химическую формулу углекислого газа №4. Определите массу водорода, реагирующего без остатка с 48 г кислорода, если водород и кислород в данном случае соединяются в соотношеннии 1:8.
|
||||||||
|
Последнее изменение этой страницы: 2021-02-07; просмотров: 165; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.227.26.244 (0.008 с.) |


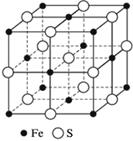 Рис. Кристаллическая решетка сульфида железа(II)
Рис. Кристаллическая решетка сульфида железа(II)


