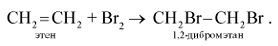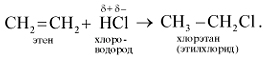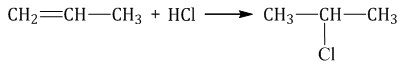Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Особенности радикального замещенияСтр 1 из 4Следующая ⇒
Особенности радикального замещения В реакцию радикального замещения легче всего вступают атомы водорода при третичном атоме С, затем при вторичном, а сложнее всего разорвать связь С-Н при первичном атоме углерода. Поэтому при бромировании 2-метилбутана преимущественно образуется 2-бром-2-метилбутан:
Химические свойства алканов Малоактивны в обычных условиях, не реагируют с растворами кислот и щелочей, не обесцвечивают раствор KMnO4 и бромную воду. 1. Горение (окисление с разрывом связей C—C и C—H): CH4 + 2O2 2. Замещение (с разрывом связей C—H): а) галогенирование (только с хлором и с бромом): 1-я стадия: CH4 + Cl2 При достаточном количестве галогена происходит дальнейшее замещение атомов водорода:
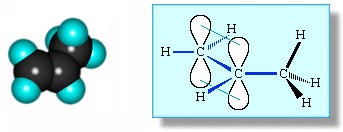
Строение алканов. Каждый атом углерода находится в sp3 – гибридизации, образует 4 σ - связи (1 С-С и 3 С-Н). Форма молекулы в виде тетраэдра с углом 109,5°. Связь образуется посредством перекрывания гибридных орбиталей, причем максимальная область перекрывания лежит в пространстве на прямой, соединяющей ядра атомов. Это наиболее эффективное перекрывание, поэтому σ-связь считается наиболее прочной. Изомерия алканов. Для алканов свойственна изомерия углеродного скелета. Предельные соединения могут принимать различные геометрические формы, сохраняя при этом угол между связями. Например,
Различные положения углеродной цепи называются конформациями. В нормальных условиях конформации алканов свободно переходят друг в друга с помощью вращения С-С связей, поэтому их часто называют поворотными изомерами. Существует 2 основные конформации – «заторможенное» и «заслоненное»:
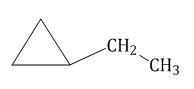
Изомерия углеродного скелета алканов. Количество изомеров возрастает с увеличением роста углеродной цепи. Например у бутана известно 2 изомера:
Для пентана – 3, для гептана – 9 и т.д. Если у молекулы алкана отнять один протон (атом водорода), то получится радикал:
Циклоалканы – это предельные (насыщенные) углеводороды, которые содержат замкнутый углеродный цикл.
Общая формула циклоалканов C n H 2n, где n≥3. Строение циклоалканов Атомы углерода в молекулах циклоалканов находятся в состоянии sp3-гибридизации и образует четыре σ-связи С–С и С–Н. В зависимости от размеров цикла меняются валентные углы.
Самый простой циклоалкан — циклопропан, представляет, по сути, плоский треугольник. σ-Связи в циклопропане называют «банановыми». Они не лежат вдоль оси, соединяющей ядра атомов, а отклоняются от неё, уменьшая напряжение в молекуле циклопропана. По свойствам «банановые» связи напоминают π-связи. Они легко разрываются.
Поэтому циклопропан очень легко вступает в реакции присоединения с разрывом углеродного цикла. Остальные циклоалканы имеют неплоское строение. Молекула циклобутана имеет перегиб по линии, соединяющей первый и третий атомы углерода в кольце:
Циклобутан также вступает в реакции присоединения, но угловое напряжение в циклобутане меньше, чем в циклопропане, поэтому реакции присоединения к циклобутану протекают сложнее. Большие циклы имеют более сложное, неплоское строение, вследствие чего угловое напряжение в молекулах больших циклоалканов почти отсутствует. Циклоалканы с большим циклом не вступают в реакции присоединения. Для них характерны реакции замещения. Строение циклопентана также неплоское, молекула представляет собой так называемый «конверт».
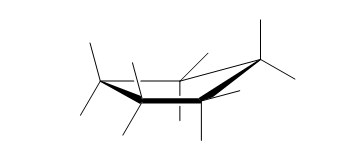
Молекула циклогексана не является плоским многоугольником и принимает различные конформации, имеющие названия «кресло» и «ванна»:
«кресло» «ванна» Изомерия циклоалканов Структурная изомерия Для циклоалканов характерна структурная изомерия, связанная с разным числом углеродных атомов в кольце, разным числом углеродных атомов в заместителях и с положением заместителей в цикле.
· Изомеры с разным числом атомов углерода в цикле отличаются размерами углеродного цикла.
· Изомеры с разным числом атомов углерода в заместителях отличаются строением заместителей у одинакового углеродного цикла.
· Изомеры с разным положением одинаковых заместителей в углеродном цикле.
· Межклассовая изомерия: циклоалканы изомерны алкенам.
Гидрирование циклоалканов С водородом могут реагировать малые циклы, а также (в жестких условиях) циклопентан. При этом происходит разрыв кольца и образование алкана. Циклопропан и циклобутан довольно легко присоединяют водород при нагревании в присутствии катализатора:
Циклопентан присоединяет водород в жестких условиях:
Бромирование протекает более медленно и избирательно. Циклогексан и циклоалканы с большим число атомов углерода в цикле с водородом не реагируют. Гидрогалогенирование Циклопропан и его гомологи с алкильными заместителями у трехчленного цикла вступают с галогеноводородами в реакции присоединения с разрывом цикла.
Реакции замещения
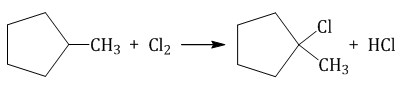
Галогенирование Галогенирование циклопентана, циклогексана и циклоалканов с большим количеством атомов углерода в цикле протекает по механизму радикального замещения.
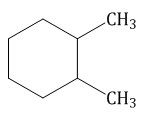
При хлорировании метилциклопентана замещение преимущественно протекает у третичного атома углерода:
Нитрование циклоалканов При взаимодействии циклоалканов с разбавленной азотной кислотой при нагревании образуются нитроциклоалканы.
Дегидрирование При нагревании циклоалканов в присутствии катализаторов протекает дегидрирование – отщепление водорода. Циклогексан и его производные дегидрируются при нагревании и под действием катализатора до бензола и его производных.
Окисление циклоалканов Горение Как и все углеводороды, алканы горят до углекислого газа и воды. Уравнение сгорания циклоалканов в общем виде: C n H 2n + 3n/2O 2 → nCO 2 + nH 2 O + Q
2C 5 H 10 + 15O 2 → 10CO 2 + 10H 2 O + Q Окисление При окислении циклогексана азотной кислотой или в присутствии катализатора образуется адипиновая (гександиовая) кислота:
Получение циклоалканов Дегидрирование алканов Алканы с длинным углеродным скелетом, содержащие 5 и более атомов углерода в главной цепи, при нагревании в присутствии металлических катализаторов образуют циклические соединения. При этом протекает дегидроциклизация – процесс отщепления водорода с образованием замкнутого цикла. Пентан и его гомологи, содержащие пять атомов углерода в главной цепи, при нагревании над платиновым катализатором образуют циклопентан и его гомологи: Алканы с углеродной цепью, содержащей 6 и более атомов углерода в главной цепи, при дегидрировании образуют устойчивые шестиатомные циклы, т. е. циклогексан и его гомологи, которые далее превращаются в ароматические углеводороды. Гексан при нагревании в присутствии оксида хрома (III) в зависимости от условий может образовать циклогексан и потом бензол:
Гептан при дегидрировании в присутствии катализатора образует метилциклогексан и далее толуол:
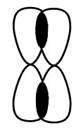
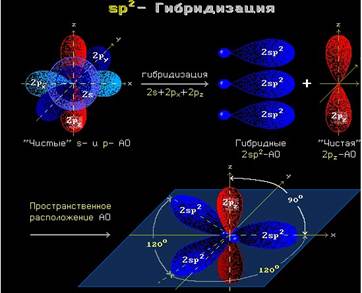
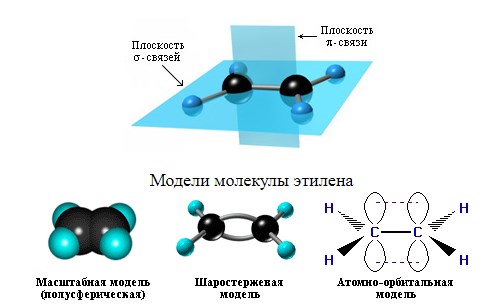
Дегидроциклизация алканов — важный промышленный способ получения циклоалканов. Строение алкенов. Рассмотрим особенности строения алкенов на примере этилена. В молекуле этилена присутствуют химические связи C–H и С=С. Связь C–H ковалентная слабополярная одинарная σ-связь. Связь С=С – двойная, ковалентная неполярная, одна из связей σ, вторая π-связь. Атомы углерода при двойной связи образуют по три σ-связи и одну π-связь. Следовательно, гибридизация атомов углерода при двойной связи в молекулах алкенов – sp2:
При образовании связи σ-связи между атомами углерода происходит перекрывание sp2-гибридных орбиталей атомов углерода:
При образовании π-связи между атомами углерода происходит перекрывание негибридных орбиталей атомов углерода:
Три sp2-гибридные орбитали атома углерода взаимно отталкиваются, и располагаются в пространстве так, чтобы угол между орбиталями был максимально возможным.
Поэтому три гибридные орбитали атомов углерода при двойной связи в алкенах направлены в пространстве под углом 120 о друг к другу:
Это соответствует плоско-треугольному строению молекулы.
Молекулам линейных алкенов с большим числом атомов углерода соответствует пространственное строение.
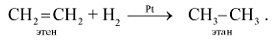
Химические свойства. По химическим свойствам этилен резко отличается от этана, что обусловлено электронным строением его молекулы. Имея в молекуле двойную связь, состоящую из • Способность к реакциям присоединения характерна для всех алкенов. 1. Присоединение водорода (реакция гидрирования):
2. Присоединение галогенов (реакция галогенирования):
При добавлении к алкену брома (в виде бромной воды) бурая окраска брома быстро исчезает. Эта реакция является качественной на двойную связь. 3. Присоединение галогеноводородов (реакция гидрогалогенирования):
Если исходный алкен несимметричен, то реакция протекает по правилу Марковникова.
Присоединение галогеноводородов к непредельным соединениям идет по ионному механизму. 4. Присоединение воды (реакция гидратации):
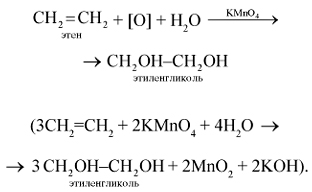
Этой реакцией пользуются для получения этилового спирта в промышленности. 5. Этилен легко окисляется уже при обычной температуре, например, при действии перманганата калия. Если этилен пропускать через водный раствор перманганата калия KMnO4, то характерная фиолетовая окраска последнего исчезает, происходит окисление этилена (реакция гидроксилирования) перманганатом калия (качественная реакция на двойную связь):
2. Этилен горит светящимся пламенем с образованием оксида углерода(IV) и воды: C2H4 + 3O2 —> 2CO2 + 2H2O. 3. Большое промышленное значение имеет частичное окисление этилена кислородом воздуха:
• Для этилена, как и для всех непредельных углеводородов, характерны реакции полимеризации. Они протекают при повышенной температуре, давлении и в присутствии катализаторов:
Полимеризация – это последовательное соединение одинаковых молекул в более крупные. Таким образом, для этилена и его гомологов характерны реакции присоединения, окисления и полимеризации.
Получение. 1. Дегидрация спиртов (по правилу Зайцева)˸ C2H5OH CH2=CH2↑+H2O. Правило Зайцева˸ при дегидратации спиртов водород отщепляется от наименее гидрогенизированного атома углерода. 2. Из галогенпроизводных алканов˸ а) CH3-CH2-Cl+KOH=CH2=CH2↑+KCl+H2O; спиртовой раствор б) СН2Br-CH2Br+Zn=CH2=CH2↑+ZnBr2. 3. Дегидрирование алканов˸ CH3-CH3 CH2=CH2↑+H2. 4. Из газов крекинга нефти C4H10 C2H4+C2H6. алкен 5. Крекинг жидких нефтепродуктов˸ C16H34 C8H16 + C8H18. алкен C8H16 C4H8 + C4H10. алкен Особенности радикального замещения В реакцию радикального замещения легче всего вступают атомы водорода при третичном атоме С, затем при вторичном, а сложнее всего разорвать связь С-Н при первичном атоме углерода. Поэтому при бромировании 2-метилбутана преимущественно образуется 2-бром-2-метилбутан:
Химические свойства алканов Малоактивны в обычных условиях, не реагируют с растворами кислот и щелочей, не обесцвечивают раствор KMnO4 и бромную воду. 1. Горение (окисление с разрывом связей C—C и C—H): CH4 + 2O2 2. Замещение (с разрывом связей C—H): а) галогенирование (только с хлором и с бромом): 1-я стадия: CH4 + Cl2 При достаточном количестве галогена происходит дальнейшее замещение атомов водорода:
Строение алканов. Каждый атом углерода находится в sp3 – гибридизации, образует 4 σ - связи (1 С-С и 3 С-Н). Форма молекулы в виде тетраэдра с углом 109,5°. Связь образуется посредством перекрывания гибридных орбиталей, причем максимальная область перекрывания лежит в пространстве на прямой, соединяющей ядра атомов. Это наиболее эффективное перекрывание, поэтому σ-связь считается наиболее прочной. Изомерия алканов. Для алканов свойственна изомерия углеродного скелета. Предельные соединения могут принимать различные геометрические формы, сохраняя при этом угол между связями. Например,
Различные положения углеродной цепи называются конформациями. В нормальных условиях конформации алканов свободно переходят друг в друга с помощью вращения С-С связей, поэтому их часто называют поворотными изомерами. Существует 2 основные конформации – «заторможенное» и «заслоненное»:
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2021-02-07; просмотров: 590; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.142.197.212 (0.111 с.) |
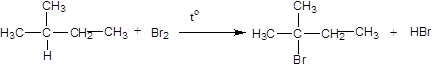
 CO2 + 2H2O + Q
CO2 + 2H2O + Q

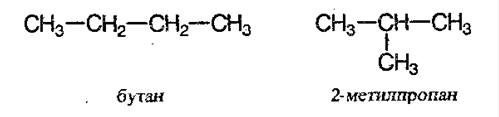
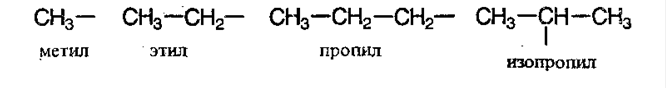





















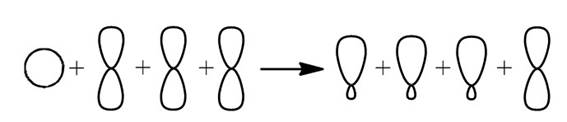

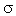 - и
- и  -связей, этилен способен присоединять два одновалентных атома или радикала за счет разрыва
-связей, этилен способен присоединять два одновалентных атома или радикала за счет разрыва