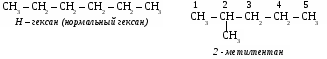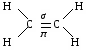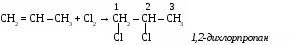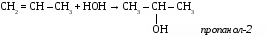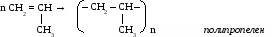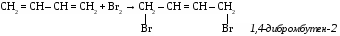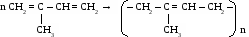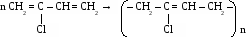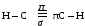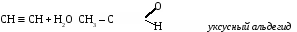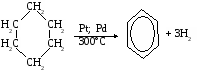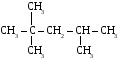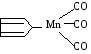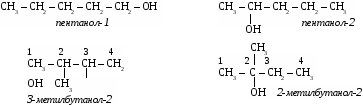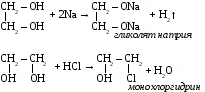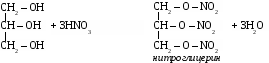Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Лекция . Тема 2. 1: теоретические основы органической химии.Стр 1 из 7Следующая ⇒
Лекция.ТЕМА 2.1: ТЕОРЕТИЧЕСКИЕ ОСНОВЫ ОРГАНИЧЕСКОЙ ХИМИИ. 1. Предмет органической химии. К органическим веществам относят соединения углерода с другими элементами, за исключением оксидов углерода, угольной кислоты и ее солей. Ученым известно более 18 млн. органических веществ, в то время как неорганических около 100 тыс. Многообразие органических соединений объясняется способностью атомов углерода образовывать цепи, прямые и разветвленные, а также замкнутые циклы. Кроме того, они могут образовывать между собой двойные и тройные связи. Органическая химия - химия углеводородов и их производных, то есть продуктов, образующихся при замене атомов водорода другими атомами или группами атомов. Формулы в органической химии.
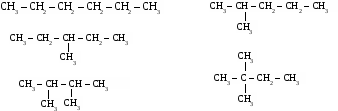
2. Теория химического строения органических соединений А.М. Бутлерова. Химическое строение - определенная последовательность соединения атомов в молекулах веществ. Основные положения теории химического строения. 1. Атомы в молекулах соединены друг с другом согласно их валентности, причем углерод в органических веществах всегда четырехвалентен, а его атомы способны соединяться в цепи линейного, разветвленного и замкнутого строения. Свойства органических веществ определяются не только их качественным и количественные составом, но и порядком связи в молекуле, то есть химическим строением. Атомы в молекулах органических веществ оказывают друг на друга взаимное влияние, от которого зависят свойства вещества в целом. 3. Изомерия органических соединений. Изомеры – вещества, имеющие одинаковый состав молекул, но различное химическое строение и, обладающие поэтому разными свойствами. 1. Изомерия углеродного скелета. Упражнение: составить формулы пяти изомеров вещества, имеющего состав С6Н14.
Лекция.ТЕМА 2.2: ПРЕДЕЛЬНЫЕ УГЛЕВОДОРОДЫ. (Парафины. Алканы). Предельными или насыщенными углеводородами называют углеводороды с незамкнутыми углеродными цепями, в молекулах которых все атомы связаны одинарными связями. МЕТАН. 1. Электронное и пространственное строение молекулы метана. Атом углерода имеет электронную формулу 1s2 2s2 2р2, на внешнем энергетическом уровне находится четыре электрона. В невозбужденном состоянии у атома углерода два неспаренных электрона. При переходе в возбужденное состояние один s-электрон переходит на вакантную р-орбиталь, атом углерода становится четырехвалентным.
При образований молекулы метана и молекул других предельных углеводородов происходит гибридизация электронных орбиталей. Одна s- и три р-орбитали взаимодействуют между собой, образуя четыре новые, совершенно равноценные орбитали. Такой процесс называется sp3 - гибридизацией. Гибридизация - процесс выравнивания электронных орбиталей по форме и энергии. В результате взаимного отталкивания гибридные орбитали занимают в пространстве самое выгодное положение, поэтому угол между их осями равен 109°28¢ и они направлены по вершинам правильного тетраэдра. Таким образом молекула метана в пространстве представляет собой тетраэдр. 2 Физические свойства метана. Метан в природе. Метан - газ без цвета, вкуса и запаха, легче воздуха, нерастворим в воде. Входит в состав природного газа (до 95%), встречается в каменноугольных шахтах, где представляет большую опасность. 3. Химические свойства метана. 3.1 горение СН4 + 2О2 → СО2 + 2Н2О 3.2 разложение при нагревании
3.3 реакция замещения
Механизм реакции замещения.
Реакция замещения идет по свободно-радикальному механизму. Частицы, имеющие неспаренные электроны, и обладающие поэтому неиспользованными валентностями, называются свободными радикалами. 5. Получение метана в лаборатории.
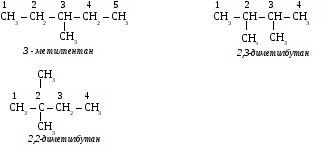
6. Применение метана. Метан используется как топливо и сырье в химической промышленности. Предельные углеводороды. Радикалы. СН4 метан – СН3 метил С2Н6 этан – С2Н5 этил С3Н8 пропан – С3Н7 пропил С4Н10 бутан – С4Н9 бутил С5Н12 пентан – С5Н11 амил С6Н14 гексан – С6Н13 гексил С7Н16 гептан – С7Н15 гептил С8Н18 октан – С8Н17 октил С9Н20 нонан – С9Н19 нонил С10Н22 декан – С10Н21 депил СnH2n+2 общая формула предельных углеводородов. УПРАЖНЕНИЕ Составить формулы пяти изомеров гексана и назвать их используя номенклатуру ИЮПАК.
Строение молекул алканов.
Молекулы предельных углеводородов имеют зигзагообразное строение. Угол между направлениями углерод - углеродных равен 109° 28¢. В молекулах алканов возможно относительно свободное вращение атомов вокруг связи С—С.
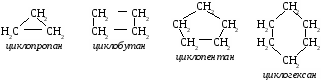
Циклоалканы. Σ = 180° (п – 2) формула для расчета величины угла в правильном
ТЕСТ ПО ТЕМЕ «АЛКАНЫ» Вариант №1 1. Диметилпропан относится к классу углеводородов, общая формула которого а) CnH2n+2 в) CnH2n -2 б) CnH2n г) CnH2n+1 2. Гомологом этана является а) С2Н4 в) СН3- CH2 - CH2 - СН3 б) С3Н4 г) С6Н12 3. Какой вид изомерии характерен для алканов: а) положения двойной связи в) углеродного скелета б) пространственная г) гомологических рядов 4. Угол связи в молекулах алканов составляет а)109028 б)1200 в) 1800 г) 10405 5. В уравнении полного сгорания пентана коэффициент перед формулой кислорода равен а) 5 б) 8 в) 6 г) 9
6. Пропан взаимодействует с: а) Br2 в) HCl б) H2 г) NaOH (р-р). 7. Газообразные алканы – это: а) СН4, С4Н10, С10Н22 в) С6Н14, С5Н12, С5Н10 б) С3Н8, С2Н6, С4Н10 г) С7Н16, С6Н14, С10Н22. 8. Реакция 2СН3I + 2Na = 2NaI + C2Н6 носит имя: а) Зинина; в).Вюрца; б) Бутлерова; г) Менделеева.
9. Установите соответствие между формулой вещества и его названием: Структурная формула Название вещества СН3 | 1) 2 – метилпентан а) СН3 –C – СН3 2) пентан | 3) бутан СН3 4) 2,2 - диметилпропан б) СН3 – СН2 – СН2 – СН3 5) гептан в) СН3 – (СH2)5 – СН3 6) гексан г) СН3 – СН – СН2 – СН2 – СН3 | СН3
10. Установите соответствие между реагирующими веществами и продуктами их взаимодействия. Реагирующие вещества: Продукты взаимодействия: а) CН4 + Cl2 → 1) CО2 + Н2 б) C2Н6 + О2 → 2) C2Н6 + NаCl в) CН3Cl + Nа → 3) CН3Cl + НCl г) С3Н8 → 4) CО2 + Н2О
5) CН2Cl2 + Н2
6) C + Н2
ЭТИЛЕН. Строение молекулы этилена. Молекула этилена имеет плоское строение, углы между направлениями связей равны 120º. Между атомами углерода располагается двойная связь, длина которой составляет 0,133 нм,
Получение этилена.
Применение этилена. Этилен используется для получения растворителей, ядохимикатов, антифризов, полиэтилена, этилового спирта, дляускорения созревания овощей и фруктов.
Задача 2. При дегидратации 92 г этилового спирта получили этилен объемом 40 л. Вычислите выход этилена в %от теоретически возможного. Гомологический ряд этилена. Предельные углеводороды Не предельные углеводороды С2Н6 этан С2Н4 этилен, этен С3Н8 пропан С3Н6 пропилен, пропен С4Н10 бутан С4Н8 бутилен, бутен С5Н12 пентан С5Н10 амилен, пентен С6Н14 гексан С6Н12 гексилен, гексен СnН2n - общая формула этиленовых углеводородов Упражнение. Составить формулы четырех изомеров пентенаи назвать их, используя номенклатуру ИЮПАК.
Упражнение. Составить уравнения лекций, характеризующих химические свойства пропилена. 1. с галогенами
2. с галогеноводородами Присоединение галогеноводородов к алкенам определяется правилом Марковникова: «Галоген присоединяется к наименее гидрогенизированному атому углерода двойной связи, а водород - к наивнее гидрогенизированному».
3. с водородом CH2 = CH – СН3 + Н2 → СН3 – СН2 – СН3 пропан 4. с водой
5. полимеризация
САМОСТОЯТЕЛЬНАЯ РАБОТА ПО ТЕМЕ «ЭТИЛЕНОВЫЕ УГЛЕВОДОРОДЫ» Вариант №1 1. Составить 5 изомеров октена. Дать им названия по международной номенклатуре. 2. Продолжить уравнения реакций: 1) СН2 = СН―CН2―СН3 + Вr2→ 2) СН2 = СН―CН2―СН3 + НВr→
Номенклатура алкадиенов.
Упражнение. Уравнениями реакций подтвердить химические свойства бутадиена-1, 4.
CH2 = CH – СН = СН2 + Н2 → CH3 – CH = СН – СН3 бутен-2
CH2 = CH – СН = СН2 + НCl → CH3 – CH = СН – СН2Cl 1-хлорбутен-2
n CH2 = CH – СН = СН2 (– CH2 – CH = СН – СН2 –)n бутадиеновый каучук Упражнение. Составить формулы по названиям:
КАУЧУК. Каучуками называют продукты полимеризации диеновых углеводородов и их производных. Природный, или натуральный, каучук получают из млечного сока (латекса) каучуконосных растений, например гевеи.
Каучуки относят к полимерам, называемым эластомерами. Однако каучуки очень чувствительны к высоким и низким температурам. Этот недостаток устраняется с помощью процесса, называемого вулканизацией. Он заключается в нагревании каучука с серой, при этом отдельные полимерные цепи сшиваются между собой за счет образования дисульфидных мостиков. Продукт частичной вулканизации каучука называют резиной. Она имеет сетчатую структуру и менее эластична, чем каучук, но обладает значительно большей прочностью. При увеличении количества серы (до 30%) продукт вулканизации (эбонит) полностью теряет пластичность. Синтетические каучуки. Первый синтетический каучук был получен в СССР под руководством академика С.В. Лебедева в 1932 году, радикальной полимеризацией бутадиена-1,3 в присутствии металлического натрия. Бутадиеновый каучук обладает хорошей водо- и газонепроницаемостью, но менее эластичен, чем натуральный каучук. Общим недостатком углеводородных каучуков является их низкая термическая устойчивость, набухание и разрушение в нефтепродуктах, этих недостатков лишен хлоропреновый каучук.
Хлоропреновый каучук используют для изготовления бензо- и маслостойкой резины, трубопроводов при перекачке нефтепродуктов.
АЦЕТИЛЕН 1. Строение молекулы. Молекула ацетилена содержит тройную связь и имеет линейное строение.
2.Физические свойства ацетилена.
Ацетилен - газ без цвета, вкуса и запаха, легче воздуха, нерастворим в воде, растворим в ацетоне. 3. Химические свойства ацетилена. Благодаря наличию тройной связи ацетилен вступает в реакции присоединения. а) галогенирование CH º CH + Br2 → CHBr = CHBr 1,2-дибромэтан б)гидрирование CH º CH + Н2 → CH2 = CH2 в) гидрогалогенирование CH º CH + HCl → CH2r = CHCl винилхлорид г) гидратация
д) окисление раствором перманганата калия CH º CH + 4[O] → H2C2O4 щавелевая кислота е) димеризация CH º CH + CH º CH → CH º CH – CH º CH2 винилацетилен ж) тримеризация
Горение 2C2H2 + 5O2 → 4CO2 + 2H2O Получение ацетилена. 1. Карбидный способ. CaC2 + 2H2O → C2H2 + Ca(OH)2 2. Пиролиз метана.
БЕНЗОЛ. Строение молекулы бензола. В 1865 г немецкий химик Ф. Кекуле предложил первую структурную формулу бензола, представляющую собой цикл из шести атомов углерода с чередующимися одинарными и двойными связями. Эту формулу широко использует химики и сейчас. По современным представлениям все шесть атомов углерода в бензоле находятся в состоянии sp2-гибридизации. За счет трех гибридных sр2-орбиталвй каждый атом образует сигма-связи с двумя соседними углеродными атомами и с одним атомом водорода. Оставшиеся p-электроны образуют общее шестиэлектронное облако равномерно распределенное по бензольному кольцу. Все связи С-С будут равноценными. Они являются полуторными или, как говорит, носят ароматический характер.
Получение бензола.
3. Тримеризация ацетилена.
Гомологи бензола 1. Номенклатура гомологов бензола.
Упражнение. Составить уравнения реакций по схеме: метан → хлорметан → этан → этилен → дихлорэтан
Нефтепродукты. 1 Бензин. Бензин содержит углеводороды от С5 до С11 стемпературой кипения от 20° до 200° С. По назначению бензин подразделяют на автомобильный и авиационный. Автомобильные бензины маркируют буквой А,авиационные - буквой Б. Например: А 72, А 96, Б 70, Б 115. Цифра в марке бензина указывает его октановоечисло, то есть определяет его качество (детонационную стойкость). СН3 – СН2 – СН2 – СН2 – СН2 – СН2 – СН3 нормальный гептан (октановое число равно нулю)
2,2,4-триметплпентан (изооктан) - октановое число равно 100. Для повышения октанового числа используют антидетонаторы. 1. Этиловая жидкость (смесь тетраэтилсвинца и бромэтана). (С2Н5)4Pb и С2Н5Br 2. Циклопентадиенилмарганецтрикарбонил (ЦТМ).
Керосин. - Авиационное и ракетное топливо, осветительный керосин. Газойль. - Дизельное топливо. Мазут. - Котельное топливо, сырье для получения смазочных масел. Парафин. Используется в медицине, электротехнике. Переработка нефти. 1. Перегонка нефти. Перегонку осуществляют при температурах 320°-350°С Крекинг нефтепродуктов.
а) термический крекинг температура процесса 500° - 550°С б) каталитический крекинг температура процесса 450° - 500°С
катализаторы: Al2O3; SiO2; Pt.
КОКСОВАНИЕ КАМЕННОГО УГЛЯ. Коксование - разложение каменного угля при нагревании его без доступа воздуха при температуре около 1100°С. Продукта коксования.
Упражнения:
а) 1,2,4-триметилбензол б) 3-бром-2,2-диметилгексан в) 3-метилбутин-1 г) 2,4-диметилпентадиен-2,3 д) 2-хлор-3,3-диэтилгексан
Предельные углеводороды Одноатомные спирты СН4 метан СН3ОН метиловый,метанол С2Н6 этан С2Н5ОН этиловый, этанол С3Н8 пропан С3Н7ОН пропиловый, пропанол С4Н10 бутан С4Н9ОН бутиловый, бутанол С5Н12 пентан С5Н11ОН амиловый, пентанол С6Н14 гексан С6Н13ОН гексиловый, гексанол Упражнение. Составить формулы четырех изомеров пентанола и назвать их.
Простые эфиры. Простые эфиры - органические вещества, в молекулах которых два углеводородных радикала соединены через атом кислорода. R1–O–R2 – общая формула простых эфиров Простые эфиры образуются при взаимодействии молекул одного и того же спирта или различных спиртов при нагревании в присутствии серной кислоты. Упражнение. Составьте уравнения реакций получения всех простых эфиров, образовавшихся при нагревании смеси метанола и этанола в присутствии серной кислоты, назовите их.
Задача. При сгорании 3,45 г вещества образовалось 6,6 г СО2 и 4,05 г воды. Плотность паров этого вещества по воздуху равна 1,59. Определить молекулярную формулу вещества.
МНОГОАТОМНЫЕ СПИРТЫ. 1. Отдельные представители. Номенклатура
2. Физические свойства этиленгликоля и глицерина. Этиленгликоль и глицерин бесцветные, прозрачные сиропообразные жидкости. Растворимы в воде, вкус сладкий. Этиленгликоль ядовит.
3. Химические свойства. Многоатомными спиртам называют производные предельных углеводородов, в молекулах которых содержатся две или более гидроксильные группы. Свойства многоатомных спиртов сходны со свойствами одноатомных. В реакцию может вступать одна или несколько гидроксильных групп. Многоатомные спирты реагируют с щелочными металлами с выделением водорода, вступают в реакции замещения с галогеноводородами.
Многоатомные спирты могут образовывать сложные эфиры по всем гидроксильным группам.
ТЕСТ ПО ТЕМЕ «УГЛЕВОДОРОДЫ» Вариант №1 Часть I. 1. Углеводород С4Н10 относится к классу: б) алкены г) алканы.
2. Общая формула циклоалканов: б) СnH2n-6 г) CnH2n
3. Молекулы алкадиенов содержат: б) только одинарные связи г) 2 двойные связи.
4. Угол связи в молекуле бензола: а) 90° в) 180° б) 120° г) 109°28/
5. Тип гибридизации атомов углерода в молекуле этилена: а) sp3 в) sp б) sp2 г) pр
6. Вещества одинакового состава, но различного строения и с различными свойствами называют: а) радикалами в) изомерами б) гомологами г) аналогами 7. Какой тип реакции характерен для алкенов: б) соединения г) замещения
8. При гидрировании алкенов образуются: б) алканы г) спирты.
9. Продуктом реакции бутена -1 с хлором является: а) 2-хлорбутен-1 в) 1,1-дихлорбутан. б) 1,2-дихлорбутан г) 1,2 –дихлорбутен-1
10. Каучук получают, используя реакцию: б) изомеризации г) полимеризации
11. Ацетилен не может реагировать б) кислородом г) метаном 12.Cпособ разделения нефти фракции основан на: а) крекинге в) коксование б) дистилляции г) пиролизе Часть II. 1. Составьте формулы четырех изомеров пентена, назовите их. 2. Составьте формулы по названиям: (4 балла) а) 2,3,4-триметилпентан б) 2,2-дибром-4-эгилгептан в) 1-хлор-3-метилбензол г) 2,4-дихлор-3-метилгексен-2 д) 1,5-дибромпентан
Лекция.ТЕМА 2.1: ТЕОРЕТИЧЕСКИЕ ОСНОВЫ ОРГАНИЧЕСКОЙ ХИМИИ. 1. Предмет органической химии. К органическим веществам относят соединения углерода с другими элементами, за исключением оксидов углерода, угольной кислоты и ее солей. Ученым известно более 18 млн. органических веществ, в то время как неорганических около 100 тыс. Многообразие органических соединений объясняется способностью атомов углерода образовывать цепи, прямые и разветвленные, а также замкнутые циклы. Кроме того, они могут образовывать между собой двойные и тройные связи. Органическая химия - химия углеводородов и их производных, то есть продуктов, образующихся при замене атомов водорода другими атомами или группами атомов.
|
|||||||||||
|
Последнее изменение этой страницы: 2021-02-07; просмотров: 170; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.142.119.114 (0.232 с.) |