
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Взвешенная плавка сульфидных медных концентратов на воздушном дутьеСодержание книги
Поиск на нашем сайте 3.5.1 Расчёт рационального состава концентрата Состав медного концентрата, %: Сu -22,0; Fe – 26,0; S-34,0, CaO-2,0; MgO-2,0; SiO2-11,0; Al2O3-2,0; прочие- 1,0. Принимаем, что в концентрате Fe, Cu и S представлены минералами CuFeS2, CuS, FeS2 Расчёт ведём на 100 кг медного концентрата. Обозначим число кг минералов, содержащихся в 100 кг медного концентрата через буквы: x- CuFeS2, y- CuS и z- FeS2. Тогда масса меди, содержащаяся в CuFeS2 и CuS, составит; кг:
63,54x + 63,54y = 22,0
Масса железа, содержащаяся в CuFeS2 и FeS2, составит, кг:
55,85x + 55,85z =26,0
Масса серы, содержащаяся в CuFeS2, CuS и FeS2, составит, кг:
64,12x + 32,06y + 64,12z = 34,0
Таким образом, имеем систему из трёх уравнений:
63,54x + 63,54y = 22 (1) 55,85x + 55,85z =26,0 (2) 64,12x + 32,06y + 64,12z = 34,0 (3)
Решаем уравнения (2) и (3) относительно z
55,85x + 55,85z =26,0 × 64,12 (2)
64,12∙55,85x + 64,12∙55,85z =64,12∙26 (2) 55,85∙64,12x + 55,85∙32,06y + 55,85∙64,12z = 55,85∙34,0 (3)
Вычитая из уравнения (3) уравнение (2), получим
1790,55 y = 1787,2 -1667,12 = 231,78
Откуда получим y = 0,129 Подставляя значение y в уравнение (1) получим
х = 0,217
Подставляя значение x в уравнение (2), получим
z = 0,249
Таким образом, в 100 кг медного концентрата содержится минералов:
CuFeS2 - 0,217 кМоль, CuS - 0,129 кМоль и FeS2 – 0,249 кМоль.
Тогда в каждом минерале содержится компонентов:
CuFeS2: Cu – 13,79 кг, Fe – 12,12 кг, S- 13,91 кг, CuFeS2 - 39,82 кг
СuS: Cu – 8,19 кг, S – 4,13кг, CuS -12, 32 кг.
FeS2: Fe – 13,91 кг, S - 15,96 кг, FeS2 -29,87 кг
Полученные данные сводим в таблицу 65.
Таблица 65- Рациональный состав сульфидного медного концентрата
3.5 2 Расчёт пыли Принимаем вынос пыли из печи 10%. Расчёт ведём на 100 кг концентрата Количество СuFeS2 уносимое отходящими газами составит:
39,81∙0,1 = 3,98 кг.
В нём содержится:
Cu – 13,8∙0,1 = 1,38 кг, Fe – 12,1∙0,1 = 1,21 кг,
S – 13,91∙0,1 = 1,39 кг
Количество СuS уносимое отходящими газами составит
12,33∙0,1 =1,23 кг.
В нём содержится
Cu – 8,2∙0,1 = 0,82 кг, S – 4,13∙0,1 = 0,41 кг.
Количество FeS2 уносимое отходящими газами составит
29,86∙0.1 = 2,99 кг. В нём содержится
Fe – 13,9∙0,1 = 1,39 кг,
S – 15,96∙0,1 = 1,60 кг.
Другие компоненты концентрата перейдут в пыль в количестве
СаО - 2∙0,1 = 0,2 кг, MgО - 2∙0,1 = 0,2 кг, SiO2 – 11,0∙0,1 = 1,1 кг, Al2O3 - 2∙0,1 = 0,2 кг.
прочие – 1,0∙0,1 = 0,1 кг.
Таблица 66- Количество и состав пыли, образующейся из концентрата
Рациональный состав концентрата за вычетом пыли представлен в таблице 67.
Таблица 67- Рациональный состав сульфидного медного концентрата с учётом пыли
3.5.3 Расчёт рационального состава штейна В процессе плавки высшие сульфиды разлагаются по уравнениям
2CuFeS2 = Cu2S + 2FeS + 0,5S2
При этом образуется
Сu2S -
FeS -
S -
2CuS = Cu2S + 0,5S2
При этом образуется
Cu2S -
S -
FeS2 = FeS + 0,5S2
При этом образуется
FeS -
S -
Всего образуется в результате диссоциации высших сульфидов
Cu2S – 24,78 кг, FeS -36,84 кг, S – 12,17 кг Принимаем, что содержание меди в штейне составляет 60,0%, а извлечение меди в штейн 94,5%. Тогда в штейн перейдёт меди
19,8 ∙0,954 = 18,89 кг
Масса штейна составит
Содержание меди в штейне по правилу Мостовича составляет 25%. Тогда масса серы в штейне составит
31,48∙0,25 = 7,87 кг
Медь в штейне находится в виде Cu2S. Количество серы в штейне связанной с медью составит
Количество Сu2S в штейне составит
18,89 + 4,77 = 23,66 кг
В медном штейне всегда растворён кислород, который cвязан с железом находится в виде Fe3O4. количество кислорода в штейне, содержащем 60% меди составляет 1,24%. Масса кислорода в штейне составляет
0,0124∙31,48 = 0,39 кг.
Количество железа, связанное с кислородом в штейне, составит
Масса магнетита в штейне составит
1,02 + 0,39 = 1,41 кг.
Принимаем содержание прочих в штейне 1%, что составляет 0,31 кг.
Остальная масса штейна будет представлена FeS, количество которого составит
31,48 – 23,66 – 1,41 – 0,31= 6,1 кг
Количество железа связанное с FeS, составит
Количество серы в штейне, связанной в с FeS, составит
Рациональный состав штейна приведён в таблице 68. Таблица 68 – Рациональный состав штейна
3.5.4 Расчёт состава и выхода шлака без добавки флюсов Количество меди, которое переходит в шлак, составит
19,8 -18,89 = 0,91 кг
В шлаке медь находится в виде Cu2S. Количество серы в шлак, связанной с Cu2S, составит
Количество Cu2S в шлаке составит
0,91 + 0,23 = 1,14 кг
Количество серы, переходящее в газовую фазу составит
Sгаз. = Sкон.- Sпыль -Sшл..-Sшт.= 34,0 – 3,4 – 0,23 -6,99 = 23,38 кг.
Количество FeS, окисляющееся до оксидов
36,84 -6,1 = 30,74 кг
В нём содержится железа
и серы
Переходит серы в газовую фазу
12,17 + 11,21 =23,38
Окисление FeS в факеле протекает по уравнению
FeS + 1,5O2 = FeО + 3SO2
В результате образуется FeО
Часть FeО окисляется до магнетита по уравнению
6FeО + О2 = 2Fe3О4
Принимаем, что 30 % FeО окисляется до магнетита., что составит
25,12∙0,3 = 7,54 кг FeО
Количество образовавшегося магнетита составит
Из этого количества магнетита 1,41 кг переходит в штейн. Оставшаяся часть магнетита
8,1 -1,41 = 6,69 кг
переходит в шлак. В нём содержится кислорода
и железа
В шлак также прейдёт FeO в количестве
25,12 – 7,54 = 17,58 кг
В нём содержится кислорода
и железа
Состав и количество шлака плавки без добавки флюса приведены в таблице 69.
Таблица 69 – Состав и количество шлак без добавки флюсов
3.5.5 Расчёт количества и состава шлака с добавкой флюсов Рекомендуемое содержание SiO2 в шлаке плавки во взвешенном состоянии составляет порядка 30%.. В качестве флюса используется кварцевая руда состава, %: SiO2- 78,4; FeO- 4,9; MgO 6,0, Al2O3 - 6,0 прочие – 4,7
3,8∙16/55,85 =1,09
Обозначим через Х массу добавляемой кварцевой руды. Составляем баланс по кремнезёму, считая, что вся кремневая руда переходит в шлак
0,784X + 9,9 = 0,3(41,3 + X)
0,784X -0,3X = 12,39 – 9,9
0,484X = 2,49
X = 5,14 кг
Масса шлака составит
41,3 + 5,14 = 46,44 кг
C кремневой рудой в шлак поступает SiO2
5,14∙0,784 = 4,03 кг
C кремневой рудой в шлак поступает FeO
5,14∙0,049 = 0,25 кг
В нём содержится железа
и кислорода
C кремниевой рудой в шлак поступает также:
MgO - 5,14∙0,06 = 0,31 кг, Al2O3 - 5,14∙0,06 = 0,31 кг, прочие – 5,14∙0,047 = 0,24 кг
Таким образом, в шлаке будет содержаться оксидов:
SiO2 - 9,9 + 4,03 = 13,93 кг, Fe3O4 – 6,69 кг, FeO – 17,58 + 0,25 = 17,83 кг,
(Fe -13,86 кг, О – 3,97 кг)
CaO – 1,8 кг, MgO – 1,8 + 0,31 = 2,11 кг, Al2O3 – 1,8 + 0,31 = 2,11 кг,
прочие – 0,59 + 0,24 = 0,83 кг.
Состав и количество шлака с учётом добавки флюса представлен в таблице 70.
Таблица 70 – Состав и количество шлак с учётом добавки флюсов
3.5.6 Расчёт количества и состава пыли Считаем, что в пыль переходит 10% кварцевой руды. Тогда в шихту необходимо ввести кварцевого флюса
В пыль переходит
5,71 – 5,14 = 0,57
кварцевой руды. В ней содержится
SiO2 -0,57∙0,784 = 0,45 кг, FeO - 0,57∙0,049 = 0,03 кг (Fe – 0,02 кг, О – 0,01 кг).
MgO – 0,57∙0,06 =0,03 кг, Al2O3 – 0,57∙0,06 = 0,03 кг, прочие –0,57∙0,047= 0,03 кг.
Тогда в пыли содержится
SiO2 – 1,1 + 0,45 = 1,55 кг; FeO 0,03 кг (Fe – 0,02 кг, О – 0,01 кг);
MgO – 0,2 + 0,03 = 0,23 кг; Al2O3 – 0,2 + 0,043 = 0,23 кг; прочие – 0,1 + 0,03 = 0,13 кг
Окончательный состав пыли приведён в таблице 71.
Таблица 71- Количество и состав пыли
3.5.7 Расчёт количества и состава газовой фазы Считаем, что сера в газовой фазе находится в виде SO2. Количество серы, перешедшее в газовую фазу, составит 34,0 - 3,4 – 0,23 - 6,99 = 23, 38 кг
Тогда степень десульфуризации плавки составит
Количество кислорода, затрачиваемое на образование SO2, составит
Количество SO2 в газовой фазе составит
23,38 + 23,34 = 46,72 кг.
Количество кислорода, затрачиваемое на образование FeO за счёт окисления FeS, составит
Количество кислорода, затрачиваемое на окисление FeO до Fe3O4, составит
Всего затрачивается кислорода
23,34 + 5,59 + 0,28 = 29,21 кг
Количество подаваемого в печь азота воздуха составит
Количество затрачиваемого на плавку воздуха составит
29,21 + 97,79 = 127 кг.
Для плавки во взвешенном состоянии шихта подсушивается до содержания в ней влаги порядка 0,1%. Тогда с шихтой поступает в печь влаги
Считая отходящие газы идеальным газом, рассчитаем объём газом по уравнению Менделеева- Клапейрона
V = где g – масса газа, кг; М – молекурярный вес газа, кг 22,4 – объём, который занимает 1 кмоль газа, м3; V – объём газа, м3.
Объём отходящих газов составит:
SO2 -
Количество и состав отходящих газов представлен в таблице 72.
Таблица 72 – Количество и состав отходящих газов
3.5.8 Материальный баланс плавки во взвешенном состоянии На основании выполненных расчётов составляем материальный баланс плавки медных концентратов во взвешенном состоянии. Материальный баланс представлен в таблице 73.
Таблица 73 – Материальный баланс плавки
Невязка составляет
3.5.9 Расчёт теплового баланса плавки 3.5.9.1 Исходные данные для расчёта Принимаем величины теплоёмкостей для
Сшт. = 0,941 кДж/(кг∙град.)
Сшл.. = 1,42 кДж/(кг∙град.)
Сших. = 0,84 кДж/(кг∙град.)
Спыль. = 0,84 кДж/(кг∙град.)
СSO2 = 2,298 кДж/(нм3∙град.)
СN2 = 1,423 кДж/(нм3∙град.)
СH2O(газ) = 1,803 кДж/(нм3∙град.)
СH2O(ж) = 4,186 кДж/(кг∙град.)
Своз. = 1,443 кДж/(нм3∙град.)
Теплота испарения воды-2300 кДж/кг.
Температура поступающих в печь материалов 25оС.
Температура выпускаемого штейна 1180оС.
Температура выпускаемого шлака 1250 оС.
Температура отходящих газов 1300оС
3.5.9.2 Статьи прихода тепла 3.5.9.2.1 Тепло экзотермических реакций
FeS + 1,5O2 = FeO + SO2 ∆H
За счёт окисления 30,74 кг FeS выделится тепла
3FeO + O2 = Fe3O4 ∆H
За счёт окисления 7,54 кг FeO выделится тепла
S2 + 2O2 = 2SO2 ∆H
За счёт окисления 12,17 кг S2 выделится тепла
2FeO + SiO2 = 2FeO∙SiO2 ∆H
За счёт реакции ошлакования 17,83 кг FeO выделится тепла
СаО + SiO2 = СаО∙ SiO2 ∆H
За счёт реакции ошлакования СаО выделится тепла
За счёт протекания экзотермических реакций выделится тепла
161316 + 11280 + 117797 + 4256 + 1339 = 295 988 кДж.
3.5.9.2.2 Тепло, поступаемое в печь с загружаемыми материалами Тепло, поступаемое в печь с загружаемыми материалами, рассчитаем по уравнению
Q = C i∙gi∙ti (26)
где Ci - теплоёмкость 9-того компонента, кДж/(кг∙град.); gi - масса компонента, кг; ti - температура, оС Тепло, поступаемое в печь с шихтой, составит
105,82∙25∙0,84 = 2222 кДж
Тепло, поступаемое в печь с воздухом, составит
127 ∙ 25∙1,297 = 4118 кДж.
Тепло, поступаемое в печь с загружаемыми материалами, составит
2222 + 4118 = 6340 кДж
3.5.9.3 Расход тепла 3.5.9.3.1 Тепло, расходуемое на разложение высших сульфидов за счёт
2CuFeS2=Cu2S+2FeS+0,5S2 ∆H
За счёт реакции диссоциации 35,83 кг CuFeS2 поглощается тепла
2CuS = Cu2S + 0,5S2 ∆H
За счёт диссоциации 11,1 кг CuS поглощается тепла
FeS2 = FeS + 0,5S2 ∆H
За счёт диссоциации 26,8 кг FeS2
Тепло, затрачиваемое на нагрев и испарения влаги, составит
4,186∙75∙0,1 + 0,11∙2300 = 288 кДж
За счёт протекания эндотермических реакций поглощается тепла
9801 + 3109 + 16115 + 288 = 29313 кДж
3.5.9.3 Тепло, теряемое выгружаемыми из печи продуктами плавки Тепло, теряемое со штейном штейна
31,48∙0,941∙1180 = 34955 кДж
Тепло шлака, теряемое со шлаком, составит
46,44∙1,42∙1250 = 82431 кДж.
Тепло, теряемое с пылью, составит
10,57∙0,84∙1300 = 11542 кДж
Тепло, теряемое с отходящими газами, составит
(16,3∙2,298 + 78,23∙1,423 + 0,14∙1,803)∙1300 = 193739 кДж.
Потери тепла с продуктами плавки составят
34955 + 82431 + 11542 + 193739 = 322667 кДж
Общие потери тепла составят
29313 + 322667 = 351980 кДж.
Принимаем, что потери тепла в окружающую среду составят 5% от общих потерь
Тепловой баланс плавки представлен в таблице 74
Таблица 74 - Тепловой баланс процесса плавки
Дефицит тепла составляет
370505 – 302328 = 68187 кДж.
Этот дефицит восполняем введением в печь природного газа и его сжиганием. Принимаем состав природного газа, % (об.): СН4 -98,8, СО2 – 0,8, N2 – 0,4. Сгорание природного газа протекает по реакции
СН4 +2О2 = СО2 + 2Н2О ∆H
В 1м3 природного газа содержится 0,988 м3 СН4, 0,008 м3 СО2 и 0,004 м3 N2. При сгорании 1м3 природного газа в соответствии со стехиометрией реакции сгорания образования расходуется
0,988∙2 = 1,976 м3 О2
и образуется
0,99 м3 СО2 и 2∙1,98 = 3,96 м3 Н2О
При этом расходуется воздуха
Принимаем избыток воздуха при сжигании природного газа α = 1,1. Фактический расход воздуха составит
9,41∙1,1 = 10,35 м3.
В нём содержится азота и кислорода
Избыток кислорода в газовой фазе составит
2,17 – 1,98 = 0,19 м3.
Количество газов, образующихся в результате сгорании 1 м3 природного газа, составит:
СО2 – 0,008 + 0,99 = 0,998 м3; Н2О – 3,95 м3; N2 –0,004 + 8,184 м3 и О2 -0,19 м3.
При сгорании 1м3 природного газа выделяется тепла
Означим через Х м3 количество природного газа для восполнения недостатка тепла. Количество тепла, полученного от сжигания газа, составит
35386∙Х кДж
Количество тепла, вносимое воздухом для сжигания природного газа, составит
10,35∙1,297∙25∙Х = 336∙Х кДж
Количество тепла, вносимое природным газом, составит
1,568∙25∙Х = 39,2∙Х кДж.
Потери тепла с компонентами отходящего газа от сгорания природного газа составит
СО2 – 2,289∙0,998∙1300 = 2970∙Х кДж; N2 – 1,423∙8,184∙1300 = 15140∙Х кДж;
Н2О – 1,803∙3,96∙1300 = 9283∙Х кДж; О2 – 1,510∙0,19∙1300 = 373∙Х кДж.
Общие потери тепла с отходящим газом от сгорания природного газа составят
2970∙Х + 15140∙Х + 9283∙Х + 373∙Х = 27766∙Х
Составляем баланс по приходу и расходу тепла от сжигания природного газа
35386∙Х + 336∙Х + 39,2∙Х - 27766∙Х = 68187
Решая уравнение, получим
Х = 8,53 м3
Таким образом, для поддержания нормального теплового режима работы печи на 100 кг концентрата необходимо чжигать8,53 м3 природного газа
3.5.10 Количество и состав отходящих газов с чётом сжиганияприродного газа. При сжигании 8,53 м3 природного газа образуется газов
Н2О - 3,96∙8,53 = 33,78 м3 (27,14 кг); N2 –8,184∙8,53 = 69,81 м3 (87,26 кг);
СО2 –0,998∙8,53 = 8,51 м3 (16,72 кг); О2 – 0,19∙9,53 = 1,62 м3 (2,31 кг)
Количество и состав отходящих газов, с учётом сжигания природного газа представлен в таблице 75.
Таблица 75 – Количество и состав отходящих газов с учётом сжигания природного газа
3.5.11 Материальный баланс плавки с учётом сжигания природного газа Количество воздуха, расходуемое на сжигание природного газа, составляет 10,35 м3или
10,35∙1,29 = 13,35 кг
В нём содержится
О2 – 13,35∙0,23 = 3,07 кг и N2 13,35∙0,77 = 10,28 кг.
На ликвидацию дефицита тепла в процессе плавки расходуется 8,53 м3 природного газа. В нём содержится метана
8,53∙0,988 = 8,43 м3 или
В нём содержится
С -
Количество прочих в природном газе составляет
СО2- 8,53∙0,008 = 0,07 м3 или 0,14 кг и N2- 8,53∙0,004 = 0,03 м3 или 0,04 кг <
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2021-02-07; просмотров: 242; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.214 (0.009 с.) |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

 64,12x + 32,06y + 64,12z = 34,0 × 55,85 (3)
64,12x + 32,06y + 64,12z = 34,0 × 55,85 (3) 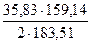 = 15,54 кг.
= 15,54 кг. = 17,16 кг
= 17,16 кг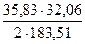 = 3,13 кг
= 3,13 кг = 9,24 кг
= 9,24 кг = 1,86 кг.
= 1,86 кг. = 19,68 кг
= 19,68 кг = 7,18 кг.
= 7,18 кг.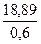 = 31,48 кг.
= 31,48 кг. = 4,77 кг.
= 4,77 кг.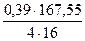 = 1,02 кг
= 1,02 кг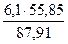 = 3,88 кг.
= 3,88 кг.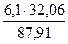 = 2,22 кг
= 2,22 кг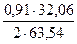 = 0,23
= 0,23 = 19,53 кг
= 19,53 кг = 11,21 кг
= 11,21 кг 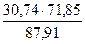 = 25,12 кг
= 25,12 кг 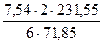 = 8,1 кг кг
= 8,1 кг кг 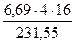 = 1,85 кг.
= 1,85 кг.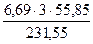 = 4,84 кг
= 4,84 кг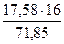 = 3,91 кг
= 3,91 кг = 13,67 кг
= 13,67 кг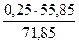 = 0,19 кг
= 0,19 кг = 0,06 кг.
= 0,06 кг.
 = 5,71 кг
= 5,71 кг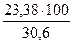 = 76,4 %.
= 76,4 %.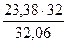 = 23,34 кг
= 23,34 кг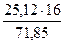 = 5,59 кг
= 5,59 кг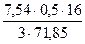 = 0,28 кг.
= 0,28 кг. = 97,79 кг.
= 97,79 кг.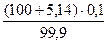 = 0,11 кг.
= 0,11 кг. ,
, 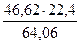 = 16,3 м3; N2 -
= 16,3 м3; N2 - 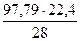 = 78,23 м3; Н2О -
= 78,23 м3; Н2О - 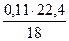 = 0,14 м3.
= 0,14 м3.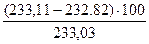 = 0,12%.
= 0,12%.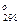 = - 461,33 кДж
= - 461,33 кДж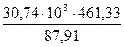 = 161316 кДж
= 161316 кДж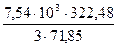 = 11280 кДж
= 11280 кДж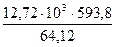 = 117797 кДж
= 117797 кДж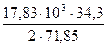 = 4256 кДж.
= 4256 кДж.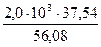 = 1339 кДж.
= 1339 кДж.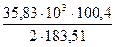 = 9801 кДж
= 9801 кДж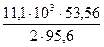 = 3,109 кДж
= 3,109 кДж = 16115 кДж.
= 16115 кДж.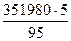 = 18525 кДж
= 18525 кДж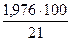 = 9,41 м3
= 9,41 м3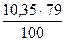 = 8,18 м3 N2 и
= 8,18 м3 N2 и  = 2,17 м3 О2
= 2,17 м3 О2 = 35386 кДж.
= 35386 кДж.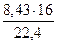 = 6,02 кг
= 6,02 кг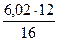 = 4,52 кг и Н -
= 4,52 кг и Н -  = 1,50 кг
= 1,50 кг


