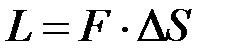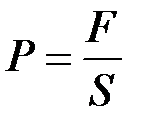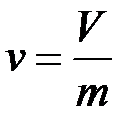Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Основные параметры состояния термодинамической системы.Содержание книги Поиск на нашем сайте
Основой термодинамического метода исследования является определение состояния ТДС. Состояние системы характеризуется с помощью термодинамических параметров (макропараметров давление, объём, температура) Параметр состояния – физическая величина, количественно или качественно характеризующая свойства ТДС и рабочего тела в частности. Рабочее тело – газ или пар, то есть тело по средствам которого осуществляется преобразование теплоты в работу.
При подводе теплоты увеличивается температура рабочего тела, при этом увеличивается и давление, что приводит к перемещению поршня и увеличению объёма – таким образом осуществляется преобразование теплоты в работу, зная характер изменения данных параметров вычисляется значение работы осуществляемое данной системой.
Давление - физическая величина равная отношению силы равномерно распределённой по поверхности тела к площади поверхности данного тела расположенной перпендикулярно действию силы.
В технике так же используются не системные единицы измерения давления. 1 а.т. = 1 кгс/см2 = 735мм рт.ст. = 10м вод.ст. = 0,981×105 Па = 0,981 бар. 1 атм = 1,013 кгс/см2 = 760мм рт.ст. = 1,013×105 Па.
Объём – обозначается V измеряется м3. Удельный объём – объём одного килограмма вещества. Обозначается ν измеряется м3/кг. Величиной обратной удельному объёму является давление.
Плотность – при определённой температуре приводится в справочниках используется для вычисления удельного объёма. Измеряется кг/м3
Температура – в МКТ степень нагретости тела, качественной мерой температуры является наше ощущение тепла, а количественной – показания термометра. Понятие температура вводиться нулевым законом термодинамики. Согласно нулевому закону термодинамики: тела находящиеся в тепловом равновесии имеют одинаковую температуру. Разность температур тел между собой определяет меру их отклонения от состояния теплового равновесия. Из этого следует: 1)Если тела имеют одинаковую температуру, то между ними не происходит теплообмена. 2)Если тела при непосредственном контакте не обмениваются теплотой, то их температуры равны. Температурой ещё является величина характеризующая внутренние движение в системе, определяется энергией каждой её части и однозначно определяет величину внутренней энергии системы. В термодинамике используется абсолютная температурная шкала Т [Кельвин]. За начало отсчёта принята температура абсолютного нуля – температура при которой прекращается тепловое движение молекул. В системе Си используется другая температурная шкала t [Цельсий]. Разница между шкалами составляет 273,150, то есть: T=t+273,150 В шкале Цельсия за начало отсчёта принята температура замерзания воды при нормальном атмосферном давлении, в качестве второй опорной точки служит температура кипения воды, опять таки при нормальном атмосферном давлении. Особое место в физике занимают газовые термометры в них термометрическим веществом (вещество реагирующие на изменение температуры изменением некоторого физического параметра давления, размера, электрического сопротивления) является газ неизменного объёма. Термометрической величиной (величина которая изменяется при изменении температуры) служит давление газа, опыт показывает что давление газа при постоянном объёме линейно зависит от температуры. Чтобы построить шкалу газового термометра достаточно измерить давление при двух температурах: плавления и кипения, соединив эти точки прямой, и продлив её в обе стороны получим прямую зависимость температуры и давления. В точке где давление отсутствует температура равна абсолютному нулю.
Лекция №4 Уравнение состояния. Если система предоставлена сама себе, то через некоторое время (время релаксации) в системе установится равновесие, при этом значение параметров в различных точках системы выравниваются между собой и будут однозначно связанны определённым соотношением, которое называется уравнением состояния данной системы. Уравнение состояния ТДС связывающие между собой давление, объём и температуру называется уравнением состояния ТДС. f(PVT) f- зависит от свойств данной системы. Любой из параметров данной функции можно определить зная два других: P=f(TV) V=f(TP) T=f(PV) Вопрос получения уравнений состояния достаточно сложен и полностью не решен даже для газов. Уравнение состояния получено методами статической физики в рамках МКТ а также империческим (опытным) экспериментальным путём для газов близких по свойствам к идеальным. Идеальным газом называется газ в котором: 1. Отсутствуют силы взаимодействия между молекулами. 2. Пренебрегают объёмом молекул. 3. Столкновения молекул между собой и со стенками системы являются абсолютно упругими. В реальных газах: 1. молекулы занимают некоторый объём. 2. междуними действуют силы притяжения и отталкивания. Учёт этих факторов значительно усложняет термодинамический расчёт, однако, свойства реального газа во многих практических условиях достаточно близки к свойствам идеального газа.
|
|||||||||||||
|
Последнее изменение этой страницы: 2021-03-09; просмотров: 102; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.119 (0.008 с.) |