
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Декстран. Строение, применение в медицине продуктов частичного гидролиза декстрана.
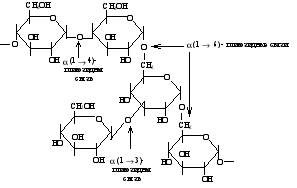
Декстраны — (С6Н10О5)n — полисахариды бактериального происхождения, построены из остатков, D-глюкопиранозы. Их макромолекулы сильно разветвлены. Основным типом связи является (1-6), а в местах разветвлений — (1-4), (1-3) и реже (1-2)- гликозидные связи.
Нативный декстран имеет молекулярную массу порядка 300.000-400.000 и используется для изготовления сефадексов, применяемых в гельфильтрации. Частично гидролизованный декстран с молекулярной массой 60.000-90.000 в изотоническом растворе NаСI (0,85%) используется в качестве плазмозамещающих растворов (полиглюкин, реополиглюкин и др.).
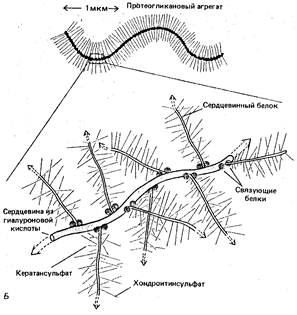
Гeтерополисахариды — высшие полисахариды, при кислотном гидролизе которых образуется смесь производных моносахаридов — аминосахара и уроновые кислоты. Различают: 1) гликозаминогликаны и 2) протеогликаны (гликозаминогликаны, ковалентно связанные с белком). Гликозаминогликаны гетерополисахариды с длинными неразветвленными цепями, состоящими из повторяющихся дисахаридных звеньев. Их называют гликозаминогликанами потому, что один из двух остатков в повторяющемся дисахариде представлен аминосахаром (N-ацетилглюкозамином или N-ацетилгалактозамином). В большинстве случаев, один из этих аминосахаров сульфатирован (этерифицирован остатками серной кислоты), а второй представляет собой уроновую кислоту. Присутствие у многих сахарных остатков ионизированных сульфатных или карбоксильных групп придают гликозаминогликанам большой отрицательный заряд и способность притягивать множество таких осмотически активных ионов, как Nа+. Большое количество полярных гидрофильных групп и высокая осмотическая концентрация ионов способствуют гидратации гликозаминогликанов и матрикса соединительной ткани в целом. Это создает давление набухания (тургор), позволяющее матриксу образовывать рыхлый гидратированный гель и противостоять сжимающим силам. Именно таким образом сопротивляется сжатию, например, матрикс хряща. В то же время, гелевая структура не препятствует быстрой диффузии водорастворимых молекул и миграции клеток. К гликозаминогликанам относятся: гиалуроновая кислота, хондроитинсульфаты, гепарин и др.
Гиалуроновая кислота является основным компонентом соединительной ткани. В больших количествах она содержится в синовиальной жидкости суставов, стекловидном теле глаза, пуповине, а также, в коже. Ее повторяющейся структурной единицей является дисахаридный фрагмент, состоящий из,D-глюкуроновой кислоты и N-ацетил-,D-глюкозамина, связанных между собой (13) гликозидной связью. Повторяющиеся же дисахаридные фрагменты связаны друг с другом (14) гликозидными связями, образующимися между полуацетальным гидроксилом N-ацетилглюкозамина и спиртовым гидроксилом у 4-го углеродного атома глюкуроновой кислоты следующей единицы. Гиалуроновая кислота имеет молекулярную массу свыше 10 млн. и отличается высокой вязкостью. Гиалуроновая кислота играет важную роль в сопротивлении организма вторжению бактерий. Однако ряд бактерий, секретирующих гиалуронидазу (фермент, расщепляющий гиалуроновую кислоту), могут легко распространяться в организме, устраняя препятствие, создаваемое вязкой гиалуроновой кислотой. В соединительной ткани гиалуроновая кислота обычно связана с белками. Хондроитинсульфаты по структуре, локализации в тканях и выполняемым функциям напоминают гиалуроновую кислоту, за тем исключением, что гексозамин представлен N ацетил-,D-галактозамином, а отдельные гидроксильные группы в 4, 6 или обоих положениях N-ацетил-галактозаминного остатка этерифицированы остатками серной кислоты:
Хондроитин-4-сульфат: R = SO3, R = H; хондроитин-6-сульфат: R = H, R = SO3 Хондроитин-4,6-дисульфат: R = R = SO3. Хондроитинсульфаты обычно встречаются только в связанном с белками виде (протеогликаны). Протеогликаны – это группа углевод-белковых биополимеров, в которых преобладает доля углеводного компонента. Свойства протеогликанов, главным образом, определяются полисахаридными составляющими. Основным типом связей между полисахаридной и полипептидной цепями служит О-гликозидная связь.
В хрящевой и соединительной ткани хондроитинсульфаты прочно связываются с гиалуроновой кислотой с помощью связующих белков, образуя очень большие агрегаты. Эти агрегаты можно наблюдать в электронном микроскопе:
В составе протеогликановых агрегатов протеогликановые молекулы выступают в роли субъединиц нековалентно связанных с помощью небольших, так называемых, связывающих белков с длинной цепью гиалуроновой кислоты. Подобные структуры придают хрящам более твёрдую консистенцию и вместе с тем – большую упругость. Гликопротеины представляют собой смешанные биополимеры, состоящие из молекул белка, к которой ковалентно присоединены олигосахаридные цепи. В гликопротеинах преобладает доля белкового компонента. Гликопротеины входят в состав всех органов тканей и клеток организма человека и животных; они содержатся в секреторных жидкостях и плазме крови. Функции их чрезвычайно разнообразны. Среди них встречаются ферменты, гормоны, белки иммунной системы, компоненты плазмы крови, муцины, рецепторы клеточных мембран и т.д.
МЕТАБОЛИЗМ УГЛЕВОДОВ Гликолиз
Реакции гликолиза Сахара подвергаются метаболическим превращениям преимущественно в виде сложных эфиров фосфорной кислоты. Глюкоза, которую ткани получают из крови, в клетке также предварительно активируется путем фосфорилирования. В АТФ-зависимой реакции, катализируемой гексокиназой [1] глюкоза превращается в глюкозо-6-фосфат. После изомеризации глюкозо-6-фосфата в фруктозо-6-фосфат [2] последний вновь фосфорилируется с образованием фруктозо-1,6-дифосфата. Фосфофруктокиназа [3], катализирующая эту стадию, является важным ключевым ферментом гликолиза. До этого момента на одну молекулу глюкозы расходуются две молекулы АТФ. фруктозо-1,6-дифосфат расщепляется далее альдолазой [4] на два фосфорилированных С3-фрагмента. Эти фрагменты — глицеральдегид-3-фосфат и дигидроксиацетонфосфат — превращаются один в другой триозофосфатизомеразой [5]. Глицеральдегид-3-фосфат затем окисляется глицеральдегид-З-фосфатдегидрогеназой [6] с образованием НАДН + Н+. В этой реакции в молекулу включается неорганический фосфат с образованием 1,3-дифосфоглицерата. Такое промежуточное соединение содержит смешанную ангидридную связь, расщепление которой является высоко экзоэргическим процессом. На следующей стадии (катализируемой фосфоглицераткиназой [7]) гидролиз этого соединения сопряжен с образованием АТФ. Следующий промежуточный продукт, гидролиз которого может быть сопряжен с синтезом АТФ, образуется в реакции изомеризации 3-фосфоглицерата, полученного в результате реакции [7], в 2-фосфоглицерат (фермент: фосфоглицератмутаза [8]) и последующего отщепления воды (фермент: енолаза [9]). Продукт представляет собой сложный эфир фосфорной кислоты и енольной формы пирувата и потому называется фосфоенолпируватом (PEP). На последней стадии, которая катализируется пируваткиназой [10], образуются пируват и АТФ. Наряду со стадией [6] и тиокиназной реакцией в цитратном цикле это третья реакция, позволяющая клеткам синтезировать АТФ независимо от дыхательной цепи. Несмотря на образование АТФ она высоко экзоэргична и потому необратима.
При гликолизе на активацию одной молекулы глюкозы потребляется 2 молекулы АТФ. В то же время при метаболическом превращении каждого С3-фрагмента образуются 2 молекулы АТФ. В результате выигрыш энергии составляет 2 моля АТФ на моль глюкозы. Изменение свободной энергии Энергетика метаболических процессов зависит не только от изменения стандартной свободной энергии ΔGo', но и от концентрации метаболита. На схеме представлены фактические изменения свободной энергии ΔG на отдельных стадиях гликолиза в эритроцитах. Видно, что только три реакции (1, 3 и 10) протекают с высоким изменением свободной энергии, причем равновесие сильно смещено в сторону образования конечных продуктов. Другие реакции легко обратимы. Они могут идти в противоположном направлении при биосинтезе глюкозы (глюконеогенезе), причем с участием тех же ферментов, что и при деградации глюкозы. Для необратимых стадий 1, 3 и 10 в глюконеогенезе используются обходные пути.
Гексозомонофосфатный путь Гексозомонофосфатный путь [ГМП (HMW), часто называемый также пентозофосфатным путем] является окислительным обменом веществ в цитоплазме, в котором, как и в гликолизе, исходным субстратом служит глюкозо-6-фосфат. ГМП поставляет два важных исходных соединения для анаболических процессов: НАДФН + Н+ (NADPH + Н+), необходимый для биосинтеза жирных кислот и изопреноидов и рибозо-5-фосфат, предшественник в биосинтезе нуклеотидов. В процессе окисления глюкозо-6-фосфат превращается в рибулозо-5-фосфат. При этом образуются 1 молекула CO2 и 2 НАДФН + Н+. Значительно более сложная часть пути — восстановительная (Б) — в зависимости от обмена веществ либо превращает часть образованного пентозофосфата снова в гексозофосфат, либо включает его в гликолиз для деградации. В большинстве клеток за счет ГМП разрушается не более 10% глюкозо-6-фосфата. Реакции
Восстановительная часть ГМП показана здесь только схематически. Функция восстановительной ветви состоит в том, чтобы производство НАДФН + Н+ и пентозофосфатов соответствовало метаболическим потребностям клеток. Обычно потребность в НАДФН + Н+ намного выше, чем в пентозофосфатах. В этих условиях 6 молекул рибулозо-5-фосфата под действием трансальдолаз и транскетолаз образуют 5 молекул фруктозо-6-фосфата, которые изомеризуются в 5 молекул глюкозо-6-фосфата. Глюкозо-6-фосфат вновь участвует в окислительной части ГМП в процессе получения НАДФН + Н+. Неоднократное повторение этих реакций позволяет окислить глюкозо-6-фосфат до 6 молекул CO2. При этом образуется 12 молекул НАДФН + Н+, а пентозофосфат не образуется. При взаимном превращении фосфатов сахаров в восстановительной части ГМП особенно важны два фермента. Трансальдолаза [5] переносит С3-звенья от седогептулозо-7-фосфата, кетосахара с 7 атомами углерода, на альдегидную группу глицеральдегид-3-фосфата. Аналогичным образом транскетолаза [4] катализирует перенос С2-фрагмента с одного фосфата сахара на другой. Реакции восстановительной части ГМП обратимы, т.е. гексозофосфаты могут непосредственно превращаться в пентозофосфаты. Это превращение может происходить при высокой потребности клетки в пентозофосфатах, например на стадии репликации ДНК и S-фазе клеточного цикла. Глюконеогенез Некоторые ткани, такие, как мозг и эритроциты, зависят от постоянного снабжения глюкозой. Если получаемое с пищей количество углеводов недостаточно, необходимая концентрация глюкозы в крови может поддерживаться некоторое время за счет расщепления гликогена печенью (см. с. 158). Если истощены также и эти запасы, в печени запускается синтез глюкозы de novo, глюконеогенез (см. с. 302). Наряду с печенью высокой глюконеогенезной активностью обладают также клетки почечных канальцев. Исходными соединениями в глюконеогенезе являются аминокислоты мышечной ткани. При длительном голодании это приводит к массивному распаду мышечного белка. Другими важными исходными веществами для синтеза глюкозы служат лактат, образующийся в эритроцитах и мышечной ткани при недостатке О2, а также глицерин, образующийся при расщеплении жиров. Напротив, жирные кислоты не могут трансформироваться в глюкозу в организме животных, так как в данном случае деградация жирных кислот не является анаплеротическим процессом. В организме человека за счет глюконеогенеза образуется несколько сотен граммов глюкозы в сутки.
Многие реакции глюконеогенеза катализируются теми же ферментами, что и процессы гликолиза. Некоторые ферменты специфичны для глюконеогенеза и синтезируются только по мере необходимости под воздействием кортизола и гпюкагона. На схеме представлена только эта группа ферментов. В то время как гликолиз протекает в цитоплазме, глюконеогенез происходит также в митохондриях и эндоплазматическом ретикулуме. Первые стадии реакционной цепи протекают в митохондриях. Причиной такого «обходного» пути является неблагоприятная константа равновесия пируваткиназной реакции. Для перевода пирувата непосредственно в фосфоенолпируват(PEP) недостаточно энергии расщепления АТФ. Пируват, образующийся из лактата или аминокислот, переносится в матрикс митохондрий и там карбоксилируется в оксалоацетат в биотинзависимой реакции, катализируемой пируваткарбоксилазой [2]. Оксалоацетат является промежуточным метаболитом цитратного цикла. Поэтому аминокислоты, которые включаются в цитратный цикл или конвертируются в пируват, могут непосредственно превращаться в глюкозу. Оксалоацетат, образующийся в митохондриальном матриксе, восстанавливается в малат [3]. который может переноситься в цитоплазму с помощью специальных переносчиков. Оксалоацетат может также переноситься из митохондрии в цитоплазму после переаминирования в аспартат. В цитоплазме малат вновь превращается цитоплазматической малатдегидрогеназой в оксалоацетат, который в реакции, катализируемой ГТФ-зависимой РЕР-карбоксикиназой [4], переводится в фосфоенолпируват. Последующие стадии до фруктозо-1,6-дифосфата представляют собой модификации соответствующих реакций гликолиза. При этом для образования 1,3-дифосфоглицерата дополнительно расходуется АТФ. Две глюконеогенез-специфичные фосфатазы отщепляют по очереди фосфатные остатки от фруктозо-1,6-дифосфата. Промежуточной стадией является изомеризация фруктозо-6-фосфата в глюкозо-6-фосфат, одна из реакций гликолиза. Глюкозо-6-фосфатаза печени [5] является мембранным ферментом, локализованным внутри гладкого эндоплазматического ретикулума. Перенос глюкозо-6-фосфата в эндоплазматический ретикулум и возврат образующейся глюкозы в цитоплазму осуществляется специфическими переносчиками. Из цитоплазмы глюкоза поступает в кровь. Глицерин прежде всего фосфорилируется [7] в положении 3. Образующийся 3-глицерофосфат окисляется НАД+-зависимой дегидрогеназой [8] в дигидроксиацетон-3-фосфат, который далее включается в глюконеогенез. Метаболизм гликогена Гликоген служит в животном организме резервом углеводов, из которого по мере метаболической потребности могут высвобождаться глюкозофосфат или глюкоза. Хранение в организме собственно глюкозы неприемлемо из-за ее высокой растворимости: высокие концентрации глюкозы создают в клетке высоко гипертоническую среду, что приводит к притоку воды. Напротив, нерастворимый гликоген осмотически почти неактивен. Гликоген животных, как и амилопектин растений, представляет собой разветвленный гомополимер глюкозы, в котором остатки глюкозы соединены α(1→4)-гликозидной связью. Связи в точках ветвления находятся в положении α(1→6) примерно каждого 10-го остатка. Гликоген печени никогда не расщепляется полностью. Как правило, укорачиваются или удлиняются (при высоком содержании глюкозы) только невосстанавливающие концы древовидной структуры. Удлинение цепи катализируется гликоген-синтазой [2]. Так как образование гликозидных связей между сахарами является эндоэргической реакцией, вначале в реакции глюкозо-1-фосфата с уридинтрифосфатом [УТФ (UTP)] образуется активированный предшественник — УДФ-глюкоза([1]. После этого остаток глюкозы легко переносится с этого промежуточного соединения на гликоген. Когда растущая цепь достигает определенной длины (>11 остатков), специальный фермент ветвления гликогена (1,4→1,6-трансгликозидаза) [3] катализирует перенос концевого олигосахарида, состоящего из 6-7 остатков, на 6-ОН остаток глюкозы той же или другой цепи гликогена с образованием точки ветвления [α(1→6)-связи] Дальнейшее удлинение этого фрагмента осуществляется гликоген-синтазой, образующей α(1→4)-связи. Разветвленная структура гликогена облегчает быстрое освобождение углеводных остатков. Наиболее важным ферментом деградации гликогена является гликоген-фосфорилаза [4], отщепляющая от невосстанавливающего конца цепи остатки глюкозы в виде глюкозо-1-фосфата. Чем больше таких концов, тем больше молекул фосфорилазы могут действовать одновременно. Образование глюкозо-1-фосфата вместо глюкозы имеет то преимущество, что для включения освобожденных остатков глюкозы в гликолиз или ГМП не требуется АТФ. Благодаря структуре гликоген-фосфорилазы, процесс последовательного отщепления останавливается за 4 остатка глюкозы от точки разветвления. Точки ветвления удаляются двумя другими ферментами [5 и 6]. Вначале трисахарид боковой цепи переносится [5] к невосстанавливающему концу главной цепи. Затем 1,6-гликозидаза [6] отщепляет остающийся единичный остаток глюкозы в точке ветвления в виде свободной глюкозы, после чего неразветвленная цепь, может вновь расщепляться фосфорилазой. Баланс гликогена В организме человека может содержаться до 450 г гликогена, треть из которого накапливается в печени, а остальное — главным образом в мышцах. Содержание гликогена в других органах незначительно. Гликоген печени служит прежде всего для поддержания уровня глюкозы в крови в фазе пострезорбции. Поэтому содержание гликогена в печени варьирует в широких пределах. При длительном голодании оно падает почти до нуля, после чего начинается снабжение организма глю
|
|||||||||
|
Последнее изменение этой страницы: 2021-03-09; просмотров: 431; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.145.36.10 (0.029 с.) |


 Гликолиз — это катаболический путь обмена веществ в цитоплазме; он, по-видимому, протекает почти во всех организмах и клетках независимо от того, живут они в аэробных или анаэробных условиях. Баланс гликолиза простой: в аэробных условиях молекула глюкозы деградирует до двух молекул пирувата. Кроме того, образуются по две молекулы АТФ и НАДН + H+ (аэробный гликолиз). В анаэробных условиях пируват претерпевает дальнейшие превращения, обеспечивая при этом регенерацию НАД+. При этом образуются продукты брожения, такие, как лактат или этанол (анаэробный гликолиз). В этих условиях гликолиз является единственным способом получения энергии для синтеза АТФ из АДФ и неорганического фосфата.
Гликолиз — это катаболический путь обмена веществ в цитоплазме; он, по-видимому, протекает почти во всех организмах и клетках независимо от того, живут они в аэробных или анаэробных условиях. Баланс гликолиза простой: в аэробных условиях молекула глюкозы деградирует до двух молекул пирувата. Кроме того, образуются по две молекулы АТФ и НАДН + H+ (аэробный гликолиз). В анаэробных условиях пируват претерпевает дальнейшие превращения, обеспечивая при этом регенерацию НАД+. При этом образуются продукты брожения, такие, как лактат или этанол (анаэробный гликолиз). В этих условиях гликолиз является единственным способом получения энергии для синтеза АТФ из АДФ и неорганического фосфата.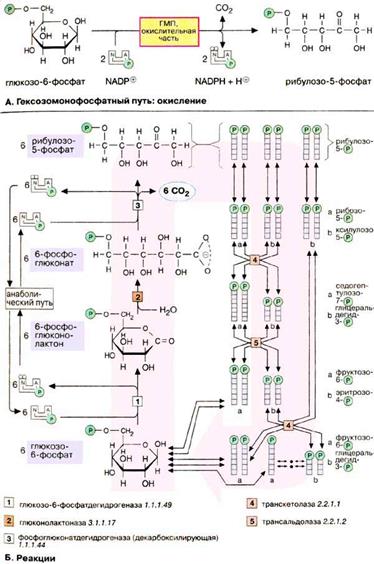 Окислительная часть ГМП начинается с окисления глюкозо-6-фосфата глюкозо-6-фосфатдегидрогеназой [1]. При этом образуется НАДФН + Н+ и 6-фосфоглюколактон — внутримолекулярный сложный эфир (лактон) 6-фосфоглюконата. Специфическая гидролаза (фермент [2]) расщепляет сложноэфирную связь и оставляет свободной карбоксильную группу 6-фосфоглюконата. Последний фермент окислительной части, фосфоглюконатдегидрогеназа (3), отщепляет карбоксильную группу 6-фосфоглюконата в виде CO2 с одновременным окислением гидроксильной группы при С-3 до кетогруппы. Наряду со второй молекулой НАДФН + Н+ при этом образуется кетопентоза, рибулозо-5-фосфат, которая под действием изомеразы превращается в рибозо-5-фосфат, исходное соединение для нуклеотидного синтеза (на схеме сверху).
Окислительная часть ГМП начинается с окисления глюкозо-6-фосфата глюкозо-6-фосфатдегидрогеназой [1]. При этом образуется НАДФН + Н+ и 6-фосфоглюколактон — внутримолекулярный сложный эфир (лактон) 6-фосфоглюконата. Специфическая гидролаза (фермент [2]) расщепляет сложноэфирную связь и оставляет свободной карбоксильную группу 6-фосфоглюконата. Последний фермент окислительной части, фосфоглюконатдегидрогеназа (3), отщепляет карбоксильную группу 6-фосфоглюконата в виде CO2 с одновременным окислением гидроксильной группы при С-3 до кетогруппы. Наряду со второй молекулой НАДФН + Н+ при этом образуется кетопентоза, рибулозо-5-фосфат, которая под действием изомеразы превращается в рибозо-5-фосфат, исходное соединение для нуклеотидного синтеза (на схеме сверху).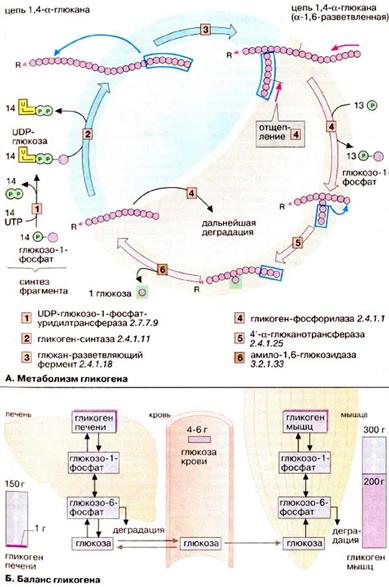 Таким образом, возникает древовидная структура с молекулярной массой >1ּ107 Да (до 50 000 остатков), в которой имеется только одна свободная аномерная ОН-группа, т. е. только один восстанавливающий конец.
Таким образом, возникает древовидная структура с молекулярной массой >1ּ107 Да (до 50 000 остатков), в которой имеется только одна свободная аномерная ОН-группа, т. е. только один восстанавливающий конец. козой с помощью глюконеогенеза. Гликоген мышц служит резервом энергии и не участвует в регуляции уровня глюкозы в крови. В мышцах отсутствует глюкозо-6-фосфатаза, поэтому гликоген мышц не может быть источником глюкозы в крови. По этой причине колебания содержания гликогена в мышцах меньше, чем в печени.
козой с помощью глюконеогенеза. Гликоген мышц служит резервом энергии и не участвует в регуляции уровня глюкозы в крови. В мышцах отсутствует глюкозо-6-фосфатаза, поэтому гликоген мышц не может быть источником глюкозы в крови. По этой причине колебания содержания гликогена в мышцах меньше, чем в печени.


