Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Классификация кристаллов по типу химической связиСодержание книги
Поиск на нашем сайте
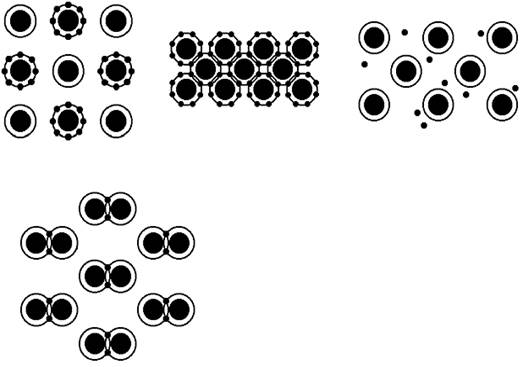
В атомной структуре материалов встречается несколько типов связей, что дает возможность систематизировать разнообразные кристаллы и по этому признаку. Рассмотрим наиболее важные из них (рис.2). Ионные кристаллы. Для них характерна ионная связь, обусловленная переходом электронов от одного атома к другому и как результат - электростатическое притяжение между положительными и отрицательными ионами (рис.2, а). Это весьма прочная, направленная связь, ограничивающая движение электронов, она характерна для солей и оксидов (NaCl, MgO, LiF и т.д.), но нет ни одного чистого элемента с такой связью. Ионным кристаллам свойственна малая электропроводность при низких температурах, которая возрастает при нагреве. При этом электрический ток в ионных кристаллах обеспечивается путем направленного потока ионов (ионная проводимость).
Рис. 2. Типы химической связи атомов: а - ионная; б - ковалентная; в - металлическая; г - молекулярная Ковалентные кристаллы. В этих кристаллах действует ковалентная (или гомеополярная) связь, возникающая в результате того, что электроны, находящиеся на внешней оболочке, примерно равномерно поделены между соседними атомами (рис.2, б). Тем самым каждый атом связан с сосeдом общей парой валентных электронов. Силы притяжения в этом случае слабее, чем при ионной связи. Однако ковалентная связь является сильно направленной, она прочно фиксирует взаимное расположение атомов. Ковалентные кристаллы характеризуются высокой температурой плавления, большой твердостью и малой электропроводностью, которая, как и у кристаллов с ионной связью, растет с повышением температуры, но у ковалентных кристаллов электропроводность обусловлена электронными процессами, т.е. связана с направленным движением электронов. Характерными примерами материалов с подобным типом связи являются алмаз (т.е. углерод), а также такие элементы, как кремний, германий и др. Металлические кристаллы. Металлическая связь возникает, когда атомы в решетке максимально плотно упакованы (модель жестких шаров). В результате электрические поля атомных ядер перекрываются. Электроны, находящиеся на внешних сферах атомов, под действием этих полей теряют связь со своими атомами и становятся обобществленными ("свободными"). В результате решетка металлического кристалла представляет собой каркас из закономерно расположенных в пространстве положительных ионов, погруженный в "газ" из свободных электронов (рис.2, в). В этом случае отсутствует направленная связь, электроны сравнительно легко перемещаются в решетке, обеспечивая хорошую тепло- и электропроводность. Металлическая связь напоминает ковалентную, поскольку в обоих случаях валентные электроны становятся общими. Однако существенное различие состоит в том, что в металлических кристаллах связывающие электроны не привязаны к паре взаимодействующих атомов, а "размазаны" по всему объему. При этом отличительная особенность металлических кристаллов - у них электропроводность падает с повышением температуры, или, как говорят, они имеют отрицательный температурный коэффициент электропроводности. Именно по этому признаку принято разделять вещества на металлы и неметаллы (или металлоиды) - по разной температурной зависимости электропроводности; у первых она растет при понижении температуры, а у вторых при - нагреве. Ввиду этого металлы можно определить как вещества с электронной проводимостью, возрастающей с понижением температуры. Соответственно неметаллы - это химические элементы, не обладающие свойствами, характерными для металлов. К ним относятся, например, газы (H, N, O, F, Cl, инертные газы), некоторые твердые тела (B, C, Si, P, S, As и др.).
Число элементов, являющихся металлами, весьма обширно – это Li, Na, Cs, Cu, Ag, Au и другие. Молекулярные кристаллы. В узлах кристаллической решетки находятся устойчивые молекулы, причем внутри молекул атомы связаны сильно. Однако между самими молекулами силы взаимодействия являются слабыми (так называемые силы Ван дер Ваальса или силы поляризационного взаимодействия) и осуществляются за счет определенного смещения центров электрических зарядов в целом нейтральных молекул и их кулоновского притяжения (рис.2, г). Такая связь наблюдается, например, в твердом водороде, а также в отвердевших инертных газах. Молекулярные кристаллы имеют низкую температуру плавления и легко сублимируют (переходят из твердого состояния в газообразное).
Некоторые кристаллы занимают промежуточное положение между этими "идеальными" типами. Например, существуют твердые фазы, которые обладают металлической проводимостью и другими свойствами, характерными при наличии металлической связи, но в то же время похожи на ковалентные кристаллы. Так, ряд, казалось бы, известных элементов, традиционно относимых к привычным металлам, в чистом виде таковыми, строго говоря, признать нельзя. Это обусловлено тем, что у них, помимо очевидной металлической связи, в заметной степени фиксируется и ковалентная. К числу подобных материалов относятся Fe, Cr, Mo, Co и некоторые другие элементы.
|
|||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2021-01-09; просмотров: 392; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.142.250.52 (0.01 с.) |
||||||||||||||||||||||||||||