
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Глава 1. Ионообменная хроматография.Стр 1 из 6Следующая ⇒
ОСНОВЫ ХРОМАТОГРАФИИ Часть 2. Ионообменная хроматография и тонкослойная хроматография
Методическое пособие для студентов 4 курса очного отделения фармацевтического факультета
КАЗАНЬ - 2013
ББК 24.4 УДК 543.544+615.07 Печатается по решению Центрального координационно-методического совета Казанского государственного медицинского университета
Составители: доцент, к.ф.н. Сидуллина С.А.
Рецензенты: доцент каф. фармакологии фармацевтического факультета с курсами фармакогнозии и ботаники, к.б.н. Хазиев Р.Ш., профессор КНИТУ, д.х.н. Гармонов С.Ю.
Основы хроматографии. Часть 2. Ионообменная хроматография и тонкослойная хроматография / С.А. Сидуллина - Казань КГМУ, 2013.- 49 с. Методическое пособие предназначено для студентов 4 курса очного отделения фармацевтического факультета. Включает изложение теоретических основ ионообменной и тонкослойной хроматографии, использование данных методов в качественном и количественном анализе лекарств.
©Казанский государственный медицинский университет, 2013
Содержание
ВВЕДЕНИЕ Методическое пособие предназначено для студентов 4 курса очного отделения фармацевтического факультета. Часть 1 включает изложение роли отечественных учёных в развитии хроматографических методов анализа, теоретических основ хроматографии, характеристику адсорбентов, требования к подвижным фазам, аппаратуре, использование газо-жидкостной и высокоэффективной жидкостной хроматографии в качественном и количественном анализе лекарств. Часть 2 посвящена изложению теоретических основ ионообменной (ИОХ) и тонкослойной хроматографии (ТСХ), использованию данных методов в качественном и количественном анализе лекарств. Ионобменная хроматография является более частным вариантом ионной хроматографии. Этот вариант хроматографии позволяет разделять ионы и полярные молекулы, на основании зарядов разделяемых молекул.
Данный вид хроматографии позволяет разделить практически любые заряженные молекулы, в том числе: крупные - белки, малые - молекулы нуклеотидов и аминокислот. Часто ИОХ используют как первый этап очистки веществ. Ионообменная хроматография позволяет разделить молекулы, основываясь на ионных взаимодействиях. Неподвижная фаза имеет заряженные функциональные группы, которые взаимодействуют с анализируемыми ионизированными молекулами противоположного заряда. Этот вариант хроматографии классифицируется на два типа - катионную и анионную ИОХ. Катионная ИОХ задерживает положительно заряженные катионы, так как неподвижная фаза имеет отрицательно заряженные функциональные группы, например, фосфат (PO43−). Анионная ИОХ задерживает отрицательно заряженные анионы, так как неподвижная фаза имеет положительно заряженные функциональные группы, например, +N(R)4. Тонкослойная хроматография (планарная) - один из вариантов хроматографических методов, основанных на избирательном распределении компонентов анализируемой смеси между двумя несмешивающимися фазами. Хроматографические методы различают по агрегатному состоянию подвижной (газ или жидкость) и неподвижной (жидкость или твёрдое тело) фаз. Планарная хроматография - способ анализа, в котором процессы разделения смеси веществ осуществляются в плоском слое сорбента (неподвижной фазе). Она разделяется на бумажную и тонкослойную хроматографии. В первой в качестве сорбента используется специальная бумага, во второй процессы разделения происходят в тонких слоях сорбента, нанесённого на инертную твёрдую подложку, или в плёнках пористого полимерного материала. ТСХ, однако, заняла особое место среди других хроматографических методов благодаря простоте методики и доступности оборудования, широкой области применения, высокой экономичности, достаточно высокой селективности и чувствительности. Цель методического пособия - помочь студентам при освоении ПК-4 (способность и готовность к анализу лекарственных средств с использованием хроматографии условиях фармацевтических предприятий и организаций, включая условия хроматографирования и выбор необходимого оборудования, с соблюдением требований международных стандартов, ПК-28 (способность и готовность к разработке, испытанию и анализу, регистрации лекарственных средств, оптимизации существующих лекарственных препаратов на основе современных технологий и методов контроля в соответствии с международной системой требований и стандартов), ПК-35 (способность и готовность проводить анализ лекарственных средств с помощью химических, биологических и физико-химических методов в соответствии с требованиями ГФ), ПК-36 (способность и готовность интерпретировать и оценивать результаты анализа лекарственных средств), ПК-37 (способность и готовность проводить определение физико-химических характеристик отдельных лекарственных форм, в том числе таблеток, мазей, растворов для инъекций), ПК-49 (способность и готовность к участию в постановке научных задач и их экспериментальной реализации.
Теоретические основы метода Заметный вклад в развитие хроматографического метода анализа внёс Г. Шваб (Германия), явившийся основателем ионообменной хроматографии (1937–1940 гг). Дальнейшее развитие она получила в работах советских ученых Е.Н. Гапона и Т.Б. Гапона, которые провели хроматографическое разделение смеси ионов в растворе (совместно с Ф.М. Шемякиным, 1947), а также осуществили высказанную еще Цветом идею о возможности хроматографического разделения смеси веществ на основе различия в растворимости труднорастворимых осадков. Современный этап в развитии ионообменной хроматографии начался в 1975 г. после работы Г. Смолла, Т. Стивенса и У. Баумана (США), в которой они предложили новый аналитический метод, названный ионной хроматографией (вариант высокоэффективной ионообменной хроматографии с кондуктометрическим детектированием). В ИОХ разделение компонентов смеси достигается за счёт обратимого взаимодействия ионизирующихся веществ с ионными группами сорбента. Сохранение электро-нейтральности сорбента обеспечивается наличием способных к ионному обмену противоионов, расположенных в непосредственной близости к поверхности. Ион введённого образца, взаимодействуя с фиксированным зарядом сорбента, обменивается с противоионом. Вещества, имеющие разное сродство к фиксированным зарядом, разделяются на анионитах или на катионитах. Аниониты имеют на поверхности положительно заряженные группы и сорбируют из подвижной фазы анионы. Катиониты соответственно содержат группы с отрицательным зарядом, взаимодействующие с катионами. В качестве подвижной фазы используют водные растворы солей кислот, оснований и растворители типа жидкого аммиака, т.е. системы растворителей, имеющих высокое значение диэлектрической проницаемости и большую тенденцию ионизировать соединения. Обычно работают с буферными растворами, дозволяющими регулировать значение рН. При хроматографическом разделении ионы анализируемого вещества конкурируют с ионами, содержащимися в элюенте, стремясь вступать во взаимодействие с противоположно заряженными группами сорбента. Отсюда следует, что ИОХ можно применять для разделения любых соединений, которые могут быть каким-либо образом ионизированы. Можно провести анализ даже нейтральных молекул сахаров в виде их комплексов с борат-ионом.
ИОХ незаменима при разделении высокополярных веществ, к таким соединениям относятся аминокислоты, пептиды, сахара. Разделение конкретных веществ зависит в первую очередь от выбора наиболее подходящего сорбента и подвижной фазы. В качестве неподвижных фаз в ИОХ применяют ионообменные смолы и силикагели с привитыми ионогенными группами. Катиониты получают сульфированием матрицы. Протон, ионносвязанный с сульфогруппой, может перемещаться и даже уходить за пределы смолы в раствор. При этом чтобы молекула была в целом электронейтральной, место протона занимает положительно заряженный ион, который из раствора переходит в смолу. Если реакция протекает до конца, то смола находится в натриевой (ионной) форме. Анионообменные смолы получают хлорированием матрицы и последующим алкилированием алифатическим амином. В большинстве случаев в ионообменной хроматографии применяются твёрдые ионообменники. Существуют также амфотерные иониты, способные к обмену одновременно как катионов, так и анионов. Такие иониты называются амфолитами. Ионит можно представить себе состоящим из каркаса, или матрицы, молекулы которой способны к ионному обмену. Матрица несет положительный или отрицательный заряд, который компенсируется зарядом ионов противоположного знака, так что в целом ионит нейтрален. Заряд матрице придают группы атомов, обычно это кислотные или основные остатки молекул. Эти ионы называются фиксированными ионами. Ионы, компенсирующие заряд матрицы, получили название противоионов. Они обладают в пределах матрицы определённой подвижностью, что и обуславливает способность ионита к обмену. Наряду с обменом ионами ионит обладает способностью набухать, поглощая растворитель, а также адсорбировать из раствора ионы одинакового заряда с матрицей. Такие ионы называются коионами. Статистическое распределение противоионов различного типа между ионитом и раствором должно было бы привести при установлении равновесия к одинаковому соотношению между активностями или концентрациями (для разбавленных растворов) этих ионов в обеих фазах. Однако в действительности этого не наблюдается, вследствие чего и возникает возможность путём ионного обмена практически полностью разделять смесь ионов. Важнейшими причинами этого являются следующие:
1. Силы электростатического взаимодействия между заряженной матрицей ионита и различными противоионами неодинаковы. Существенное влияние оказывает величина заряда иона. 2. Кроме чисто электростатических сил проявляются и другие силы взаимодействия между ионами и окружающей их средой. В растворе и в ионите они могут для ионов разного типа значительно различаться. 3. Противоионы относительно крупных размеров по чисто стерическим причинам могут сказаться неспособными проникать сквозь тонкие поры матрицы ионита. Возникает так называемый ситовый эффект. Перечисленные причины наряду с другими, вызывающими преимущественное поглощение ионитом ионов определённого типа, обуславливают важнейшее свойство ионита - селективность. Это свойство зависит не только от природы ионита, структуры его матрицы, но и от условий проведения эксперимента, например pH среды, температуры и т.д.
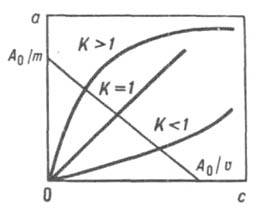
Ионообменное равновесие Равновесное отношение концентраций ионов в твёрдой фазе линейно связано с соответствующим отношением в жидкой фазе, разумеется, с учётом зарядов обменивающихся ионов. Если на графике, отражающем эту зависимость, при постоянной температуре опыта по оси абсцисс откладывать равновесные отношения концентрации ионов в растворе, а по оси ординат отношения концентраций в твёрдой фазе, получим изотерму ионного обмена (рис. 1). Прямолинейность изотермы указывает на соблюдение закона действия масс, а её отклонение от прямолинейности свидетельствует о неподчинении этого обмена закону. Следует отметить, что для разбавленных растворов этот закон выполняется.
Рис. 1. Изотермы ионного обмена для систем с различными значениями констант равновесия (А0 - исходное количество вещества, m - масса раствора, v - объём раствора).
Константа ионного обмена (К) равна тангенсу угла наклона прямой, изображающей изотерму ионного обмена, к оси абсцисс. Физический смысл константы ионного обмена заключается в том, что она позволяет дать количественную характеристику способности ионита к обмену с теми или иными ионами из раствора, т.е. выражает преимущественную сорбцию одного из двух обменивающихся ионов. Поэтому константа ионного обмена может быть названа коэффициентом селективности. Таким образом, если обменивается ион А+ из твёрдой фазы на ион В+ из раствора, то коэффициент селективности равен:
Индекс А и В в данном случае означает, что первоначально ион А+ находился в твёрдой фазе, а ион В+ - в растворе. Коэффициент селективности может быть больше, меньше или равен единице. Если КА'В > 1, то ион В+, находящийся в растворе, имеет большее сродство к иониту, чем ион А+, обмен происходит в сторону замещения иона А+ в ионите, на ион В+. Если КА,В <1, то направление процесса ионного обмена меняется. Наконец, при КА,В = 1 сродство ионов А+ и В+ к иониту одинаково.
Если обменивающиеся ионы имеют одинаковые заряды, то размерность коэффициента селективности не зависит от единиц измерения концентрации в растворе и в ионите, тогда как при различных значениях зарядов ионов численное значение коэффициента селективности зависит от единиц измерения концентрации. Наряду с коэффициентом селективности для количественной характеристики ионитов можно пользоваться коэффициентом распределения (КР):
(2),
представляющим собой отношение концентрации иона (первоначально находившегося в растворе) в ионите к его концентрации в растворе к моменту достижения равновесия. Таким образом, КР характеризует степень извлечения ионитом растворённого иона. Отношение коэффициентов распределения двух ионов, разделяемых в одинаковых условиях, называется коэффициентом разделения, который характеризует способность данного ионита к разделению смеси двух различных ионов в растворе. Если коэффициент разделения смеси равен единице, то разделение смеси ионов невозможно. Таким образом, в ИОХ необходимо выбирать иониты с достаточно высоким коэффициентом разделения по отношению к анализируемым ионам. Иониты Свойствами ионитов обладает довольно большое число различных природных и синтетических соединений. Минеральные иониты. Природные минеральные иониты являются, как правило, кристаллическими силикатами, жёсткая решетка которых несёт избыточный заряд. Наиболее важными представителями этой группы ионитов являются целлиты, способные к обмену катионами. К ним относятся минералы анальцим, шабазит, гармотом, гейландит, натролит и некоторые другие. Синтетические неорганические иониты. К этому типу ионитов относятся плавленные и гелеобразные пермутиты, активированный оксид алюминия /алюминатный оксид алюминия/, иониты на основах циркония и титана. Пермутиты представляют собой гидратированные алюмосиликаты и являются катионитами. Иониты на основе углей. Сульфирование бурых, каменных углей и антрацитов дымящейся серной кислотой позволяет вводить в угли подвижные сульфогруппы, а также, после окисления, карбоксильные группы и превращать угли в ионообменники. Сульфирование способствует протеканию реакций поликонденсации и превращает уголь в гель. Благодаря этому иониты на основе сульфированных углей (сульфоуглей) приближаются по свойствам к синтетическим органическим ионитам. Для окисленных углей характерна высокая селективность. Иониты на основе синтетических полимерных веществ - смол. Наибольшее практическое применение нашли синтетические органические иониты, получаемые на основе полимерных веществ – синтетических смол, что обусловлено прежде всего их большой химической стойкостью, механической прочностью, высокой обменной емкостью, а также большим разнообразием свойств, в частности, высокой селективностью. Различают четыре типа ионитов как для катионитов, так и для анионитов. 1 тип - иониты, проявляющие свойства сильных кислот или сильных оснований. Для катионитов этого типа характерна высокая степень диссоциации и связанная с этим легкость обмена протонов на катионы из раствора электролита. Обменная ёмкость этих катионитов практически не зависит от pH раствора. 2 тип - иониты, проявляющие свойства слабых кислот или слабых оснований. Для катионитов этого типа характерно, что при малых значениях pH раствора большинство катионов не вытесняет из них ионов водорода, т.е. их обменная ёмкость близка к нулю. При возрастании pH раствора и достижения некоторого его значения обменная ёмкость резко возрастает и затем достигает предельного значения. Значение pH раствора, при котором начинается резкое возрастание обменной ёмкости, зависит от концентрации катионов в растворе и природы катионита. 3 тип - иониты смешанного типа, проявляющие свойства смеси сильной и слабой кислот или, соответственно, оснований. Иониты этого типа обладают двумя предельными значениями обменной ёмкости в зависимости от pH или рОН раствора. Для катионитов первая величина предельной обменной ёмкости связана с присутствием в них сильнокислотных групп, а вторая обусловлена наличием слабокислотных остатков. 4 тип - иониты, обменная ёмкость которых с ростом pH или рОН раствора непрерывно возрастает. Иониты, относящиеся к этому типу, ведут себя подобно смеси нескольких кислот или оснований различной силы. Зависимость обменной ёмкости от pH или рОН раствора для ионита 4 группы близка к линейной. Для этого типа ионитов часто оказывается невозможным найти предельное значение обменной ёмкости. Примером ионитов 4 группы могут служить почвы, глины, некоторые минералы. Чтобы установить, к какому типу принадлежит тот или иной ионит, по экспериментальным данным строят график зависимости обменной ёмкости от pH (для катионитов) или рОН (для анионитов) раствора. Для получения такой зависимости прибегают к методу титрования и строят две кривые титрования какого-либо вещества, вступающего в обменную реакцию с ионами испытуемого ионита. Целлюлозоиониты. Так называются ионообменники, получаемые на основе производных целлюлозы, содержащих ионогенные группы и способных к ограниченному набуханию. Существенным отличием целлюлозоионитов от ионообменных смол является то, что ионный обмен в них протекает не внутри гранулы, как это имеет место у ионообменных смол, а на поверхности тончайших волокон. Из целлюлозоионитов наиболее часто применяют катиониты СЭ (сульфоэтилцеллюлоза), СМ (сульфометилцеллюлоза), Р(фосфориллированная целлюлоза) и КМ (карбоксиметилцеллюлоза). К анионитам относятся ТЭАЭ (триэтиламиноэтилцеллюлоза), ДЭАЭ (диэтиламиноэтилцеллюло-за), АЭ (аминоэтилцеллюлоза), ЭКТЕОЛА - продукт реакции эпи-хлоргидрина и триэтиламина с целлюлозой и т.д. Особо крупные органическое ионы (например, антибиотиков) не проникают во внутреннюю часть зерен малонабухающих (даже слабосшитых) сорбентов, в результате чего наблюдается состояние "ложного" равновесия. Поэтому для эффективной реализации таких процессов часто рекомендуют использовать так называемой поверхностно-слоистые сорбенты, в которых ионогенные группы расположены тонким слоем вблизи поверхности зерен. Обменная ёмкость ионитов К числу важнейших свойств ионитов относится их обменная ёмкость. Полная обменная ёмкость данного ионита является величиной постоянной и определяется, в первую очередь, числом фиксированных ионов в каркасе ионита. В этой связи, в идеальных условиях полная обменная ёмкость не зависит от состояния ионита и природы противоиона, а лишь от природы самого ионита. В реальных условиях, однако, она зависит от ряда факторов, в частности, от pH раствора. Это усложняет однозначное определение понятия обменной ёмкости. Кроме того, обменная ёмкость, определяемая в статистических условиях, отличается от величины, полученной в динамических условиях. Поэтому при определении обменной ёмкости необходимо указывать условия, при которых она определена. Различают два типа динамической обменной ёмкости: динамическую обменную ёмкость до проскока (ДОЕ), и полную динамическую обменную ёмкость (ПДОЕ). ДОЕ представляет собой ёмкость ионита, определяемую по появлению данного иона в вытекающем из колонки растворе. ПДОЕ определяется по полному насыщению ионита в колонке данным ионом.
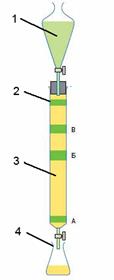
Аппаратура и подготовка ионита Ионообменный хроматографический анализ может осуществляться в двух вариантах: колоночном и тонкослойном. Важным условием успешного решения практических задач методом ИОХ является правильный выбор ионита, его подготовка, а также определение условий проведения опыта, особенно размеров колонны. Поэтому хроматографическому анализу должна предшествовать подготовка ионита, его испытание обменной ёмкости и других свойств, а также установление на их основе оптимальных размеров зёрен ионита и хроматографической колонки (её длины и диаметра). Соотношение диаметра колонки и размеров зёрен ионита не должно быть менее чем 40:1. В ИОХ применяют аппаратуру, аналогичную применяемой в жидкостной хроматографии. Большое значение имеет чистота применяемой при хроматографии воды, особенно при определении обменной ёмкости. Присутствие посторонних ионов может нарушить обмен и исказить его результаты. В особо точных измерениях следует применять бидистиллят, хранящийся в кварцевой или полиэтиленовой посуде. Важной стадией работы с ионитами является их подготовка к эксперименту и регенерация после отработки. Товарные иониты часто содержат различные примеси, особенно ионы железа. Поэтому иониты следует предварительно очищать. Кроме того, ионит должен быть доведен до набухания. Процесс обмена ионов включает пять последовательных стадий: перемещение сорбируемого иона к поверхности зерна сорбента (1) и внутри него (2), собственно ионный обмен (3), перемещение вытесняемого иона внутри зерна сорбента (4) и от его поверхности в растворе (5). Все стадии, кроме собственно химический реакции обмена, носят диффузионный характер. Уменьшение пути диффузии в результате уменьшения размера зёрен (соответственно и межзернового пространства) приводит к резкому увеличению скорости ионного обмена. Вследствие малой энергии активации диффузии скорость ионного обмена мало зависит от температуры. Большинство ионообменных процессов проводится в динамических условиях - пропусканием раствора через неподвижный слой сорбента в периодической процессах или противоточным движением раствора и сорбента в непрерывных процессах. На рис. 2 приведён типичный прибор для колоночной хроматографии. Преимущества динамического способа - глубокая очистка раствора от примесей (благодаря контакту со свежими порциями сорбента) и полное использование обменной ёмкости слоя (вследствие увода током раствора продуктов ионообменной реакции из сферы реакции).
Рис. 2. Типичный прибор для колоночной хроматографии: 1 – капельная (делительная) воронка; 2 – хроматографическая колонка; 3 – сорбент; 4 – колба (сборник элюента). Перед проведением колоночной хроматографии необходимо подобрать элюент и сорбент при помощи ТСХ. Для эффективной очистки выделяемого компонента смеси примеси должны отличаться по Rf не менее чем на 0,15. Элюент для колоночной хроматографии должен быть менее полярным чем для ТСХ анализа. Для эффективного разделения смеси нескольких веществ можно использовать градиентное элюирование, т.е. начинать элюировать неполярными растворителями (пентан, гексан), далее постепенно увеличивать полярность смеси (смеси: гексан/этилацетат от 20:1 до 1:5) и, наконец, переходить к высоко полярным растворителям и смесям (метанол, смеси метанол/триэтиламин 20:1). Способы заполнения колонки сорбентом: 1. Сухой способ. Колонка заполняется сорбентом. После чего сразу наносят вещество и приступают к элюированию. Минус этого способа - частое растрескивание слоя сорбента - из-за чего плохое разделение. Данный способ подходит для флеш-хроматографии, т.е. отделения целевого вещества от примесей с Rf ~0. 2. Элюент затем сорбент. Колонку заполняют до половины длины элюентом, затем порциями засыпают сорбент, следя, чтобы он полностью смачивался. Минус этого способа - если сорбент достаточно мелкий, он слипается комками и падает на дно колонки в виде шариков. Способ часто применяют при работе с крупнозернистым силикагелем. 3. Сорбент в виде суспензии в элюенте. В колонку засыпают необходимое количество сухого сорбента, высыпают его из колонки в химический стакан. Заливают сорбент элюентом и перемешивают для равномерного смачивания. Через некоторое время суспензию взбалтывают и выливают при помощи химической воронки на колонку. Остатки сорбента смывают со стенок химического стакана элюентом. Способы нанесения вещества на колонку: 1. Сухой способ. Вещества наносятся в индивидуальном виде - твердом (просто насыпают на колонку) или жидком (переносят пипеткой на колонку). 2. В растворе. Вещество растворяют в минимальном количестве элюента или менее полярном растворителе, чем элюент и наносят пипеткой. Важно! Растворитель должен быть менее полярный, чем элюент, иначе вещество вытянется с колонки вместе с этим растворителем. Важно! Чем уже слой раствора с веществом - тем лучше разделение. 3. В виде твердой смеси с сорбентом. Вещество смешивают с сорбентом с добавлением небольшого количества растворителя. Растворитель удаляют на роторном испарителе. Сухой сорбент с веществом насыпают на колонку. Наносить вещество на колонку (жидкое или в растворе) следует по стенкам колонки, чтобы не размывать слой сорбента. Важно! Чем ровнее нанесено вещество, тем лучше его разделение. После нанесения вещества верхний слой сорбента на колонке можно накрыть ваткой или фильтровальной бумагой, чтобы при добавлении элюента не происходило размывание слоя сорбента. Важно! Чем ровнее слой сорбента, тем лучше разделение веществ. Элюирование под давлением. В принципе, в большинстве случаев элюирование проводят при атмосферном давлении. Так как чем быстрее скорость элюирования - тем хуже разделение. Однако, при использовании мелкозернистых сорбентов без элюирования при избыточном давлении не обойтись из-за крайне низкой скорости процесса. В этих случаях применяют колбы Бунзена, в которые помещают хроматографические колонки и подключают к вакуумному насосу (наиболее подходит при проведении флеш-хроматографии на фильтре Шотта) или нагнетают давление при помощи груши. Важно! При проведении хроматографирования слой сорбента ни в коем случае не должен пересыхать, иначе может произойти его растрескивание, приводящее к снижению разделяющей способности. Вещество должно быть растворимо в применяемом элюенте, иначе произойдет его кристаллизация в колонке, что ухудшает разделение. Собранный элюент анализируют титриметрическими или физико-химическими методами.
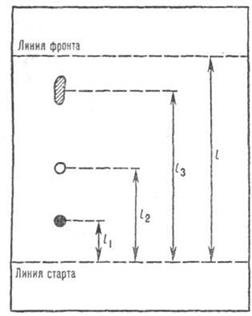
Теоретические основы метода Если сорбент помещён не в колонку, а в виде тонкого слоя на пластинке, то мы получим один из вариантов хроматографии – тонкослойную хроматографию (ТСX). Метод ТСХ разработан советскими учеными Н.А. Измайловым и М.С. Брайбер ещё в 1938 г. По чувствительности и возможности определения веществ в сложных смесях и в малых количествах ТСХ превосходит все известные приёмы аналитической химии. Основное достоинство ТСХ заключается в несложности аппаратуры, простоте и большей скорости проведения эксперимента, достаточной чёткости разделения смеси веществ и в возможности анализа ультрамикроскопических количеств вещества. Хроматографический процесс в тонком слое сорбента, как и в колонке, обусловлен переносом подвижной жидкой фазы вдоль слоя неподвижного твердого носителя и переносом компонентов разделяемой смеси по слою с различными скоростями. Однако в тонком слое вещества разделяемой смеси диффундируют не только в продольном направлении, как это имеет место в колонке, но и в поперечном. Кроме того, движение подвижной фазы в тонком слое обусловлено не гравитационными силами, как в колонке, а капиллярными, преобладающими над гравитационными. Процесс в тонком слое следует рассматривать как двумерный, при котором диффузионная массопередача в поперечном направлении соизмерима с продольной диффузией. Для характеристики сорбционных свойств системы сорбат-сорбент в тонком слое вводят понятие подвижности Rf.
Рис. 3. Схема определения величины Rf при хроматографировании в тонком слое сорбента.
За Rf принимают отношение расстояния Xi, пройденное зоной вещества от стартовой линии до центра зоны, к расстоянию Xf, пройденному растворителем за то же время (Xf равно расстоянию от стартовой линии до границы фронта растворителя к концу опыта):
Понятно, что Xi не может быть больше Xf. Поэтому значения Rf лежат в пределах от нуля до единицы. Если значения X для различных веществ неодинаковы, то и значения Rf также будут различны. Следовательно, Rf может служить сорбционной характеристикой системы сорбат-сорбент и в данных условиях опыта, для данных веществ, сорбента и растворителя есть величина постоянная. При малых значениях Rf и уменьшении продолжительности анализа достигается минимальное размывание зоны вещества на сорбенте. Следовательно, в этих условиях концентрация вещества максимальна, что приводит к увеличению чувствительности анализа. Определяя оптимальный размер диаметра зёрен сорбента, необходимо учитывать следующие обстоятельства. При уменьшении диаметра зёрен уменьшается сопротивление массопередаче. Поэтому влияние на размывание кинетических факторов становится менее значительным. Однако при этом уменьшается скорость движения растворителя, так как увеличивается гидродинамическое сопротивление слоя. Следовательно, уменьшение диаметра зерна приводит к увеличению времени анализа, а это вызывает усиление диффузионного размывания. Оптимальным можно считать такой размер зерен сорбента, при котором суммарное влияние размывающих факторов было бы минимальным. Таким образом, теоретические представления о процессе в тонком слое и выведенные на их основе закономерности позволяют рассчитать оптимальные условия опыта.
Методические варианты ТСХ Хроматографирование в тонком слое может быть осуществлено в нескольких вариантах. Во-первых, слой сорбента может быть незакрепленным на пластинке и закрепленным. В первом случае сорбент наносят на пластинку в виде порошка, покрывающего её равномерным тонким слоем. Пластинку для хроматографирования устанавливают в специальную камеру горизонтально или под углом к горизонтальной плоскости не более 15-20°. Во втором случае сорбент предварительно смешивают с каким-либо связующим материалом и наносят на пластинку в виде пасты, распределяемой по поверхности пластинки ровным тонким слоем. В качестве связующих материалов обычно применяют медицинский гипс, очищенный крахмал и т.д. Пластинка с закрепленным слоем может устанавливаться в камере в любом положении вплоть до вертикального. Некоторые фирмы выпускают пластинки с закрепленным слоем, изготовленные машинным способом и в готовом для эксперимента виде. В качестве пластин, служащих подложкой для сорбента, чаще всего применяют стекло, алюминиевую фольгу или полиэфирную плёнку. Стеклянные пластинки наиболее универсальны вследствие устойчивости к воздействию любых растворителей и реагентов, применяющихся в ТСХ. Алюминиевые и пластмассовые пластинки эластичны, поэтому им можно придавать любую форму. Кроме того, полиэфирные плёнки прозрачны для УФ излучения в пределах до 320 нм и, следовательно, на них можно производить фотометрирование пятен непосредственно в слое. Некоторые фирмы изготовляют пластинки со слоем, разделенным небольшими промежутками на отдельные дорожки, что позволяет предотвратить возможное перекрывание соседних пятен при хроматографировании. Наконец, выпускаются стеклянные пластинки, покрытые тонким слоем силикагеля и прочно связанные с ним химическими связями. Последнее достигается обжигом силикагеля, нанесённого на стекло. Такие пластинки возможно использовать многократно, не удаляя слоя сорбента, а лишь регенерируя его растворителями или же хромовой кислотой с последующей промывкой водой и сушкой при 120 °С. Движение растворителя вдоль слоя также может происходить по-разному. В восходящей хроматографии растворитель поднимается снизу вверх, причём его движение обусловлено лишь действием капиллярных сил. Компоненты смеси остаются на слое в виде пятен. В нисходящей хроматографии растворитель продвигается по слою сверху вниз под действием как капиллярных, так и гравитационных сил. Если процесс останавливается при достижении фронтом растворителя нижней границы слоя сорбента, то компоненты разделяемой смеси остаются в слое в виде пятен. Если же хроматографический процесс продолжать, то растворитель стекает со слоя и вымывает компоненты анализируемой смеси. В этом случае, как в колоночной хроматографии, раствор собирают отдельными порциями и анализируют. Однако широкого распространения в таком виде нисходящая хроматография не получила. Горизонтальная хроматография может выполняться в двух вариантах: в виде круговой и со свободным испарением растворителя. В круговой хроматографии пластинку устанавливают строго горизонтально. Пробу исследуемой смеси наносят в виде капли в центре пластинки. Туда же непрерывно подают растворитель, который под действием капиллярных сил движется по слою в радиальном направлении от центра. Компоненты анализируемой смеси располагаются в слое согласно их сорбционным свойствам в виде концентрических колец. Метод чрезвычайно быстр, поэтому он применяется в предварительных испытаниях при подборе сорбента или растворителя для анализа неизвестной смеси. Во втором варианте горизонтальной хроматографии пластинку устанавливают в камере строго горизонтально, а растворитель подают с одного края пластинки по всей её ширине. После прохождения растворителем некоторого расстояния пластинку вынимают из герметической камеры и помещают в открытую камеру. При этом растворитель частично испаряется. Этот метод применяют, если необходимо разделить смесь веществ с близкими значениями Rf. Двумерную хроматографию применяют, если разделение смеси при помощи однократного хроматографирования не достигается. В этом случае после первого хроматографирования пластинку вынимают из камеры, испаряют растворитель, пластинку поворачивают на 90° и производят повторное хроматографирование в том же или ином растворителе в направлении, перпендикулярном первоначальному. При этом достигается значительно лучшее разделение.
|
|||||||||||||||||||||||
|
Последнее изменение этой страницы: 2021-01-08; просмотров: 205; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.21.233.41 (0.078 с.) |
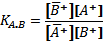 (1).
(1).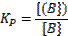
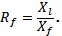 (3)
(3)


