Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Причины аномалий физических свойств воды: строение, структура и геометрия молекулы воды.
Одно из объяснений такого аномального поведении воды уходит в дебри ее молекулярного строения. Даже в самой популярной форме звучит оно сегодня следующим, таинственным образом. Вода не подчиняется логике законов физики, которым следуют другие вещества «из-за свойств атомов кислорода и водорода, из-за их структурного расположения в молекуле, из-за определенного поведения электронов в молекуле...». Если конкретизировать эти заключения, то выяснится, что в нормальных условиях простая молекула H2O, состоящая из одного атома кислорода и двух атомов водорода представляет собой газ (рис.2.11).
Рис.2.11. Простая молекула Н2О представляет собой пар. С помощью водородных связей (точки) простые молекулы Н2О способны объединяться в группы.
Быть воде – водой позволяет уникальное свойство этих трехатомных молекул в процессе физического взаимодействия объединяться в группы с помощью водородных связей, возникающих в результате электростатического взаимодействия между отрицательным зарядом кислорода одной молекулы воды и частичным положительным зарядом водорода соседней молекулы (точки на рис.2.8). Такие же связи, кстати, существуют и у других соединений водорода - в большинстве биологических молекул, например, углеводов, белков, нуклеиновых кислот.. Группы молекул Н2О, объединяются, таким образом, посредством водородных связей в более крупную молекулу - кластер (H2O)Х, не теряя в этом ансамбле своей индивидуальности (рис.2.12.). Величина Х может меняться от 3 до 6. Вода, таким образом,является сложным химическим веществом.Она состоит из повторяющихся кластеров, содержащих от 3 до 6 одиночных молекул H 2 O. Действительная формула воды имеет вид среднего между Н6О3 и Н12О6. Устойчивость «сцепки» отдельных молекул воды в кластере обеспечивают водородные связи, которые между молекулами Н2О в 24 раза слабее, чем связи между атомами кислорода и водорода в самой молекуле Н2О.
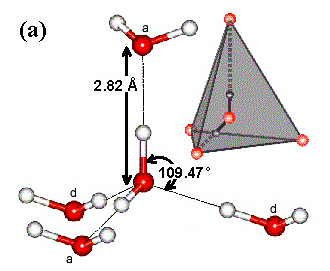
Они начинают распадаться при температуре 100°С и полностью разрушаются при нагревании водяного пара до 600°С. Тем не менее, единой модели структуры воды пока не существует. В 1933 г. английские ученые Дж. Бернал и Фаулер предложили первую теорию о тетраэдической структуре воды. Согласно ее положениям каждая молекула Н2Оможет одновременно образовывать четыре водородные связи с другими простыми молекулами под строго определенными углами, равными 109,47°, направленных к вершинам тетраэдра (рис.2.13а). Это не позволяет такому кластеру при замерзании создавать плотную структуру и лед менее плотный, чем жидкая вода. При этом в структурах льда этот тетраэдр оказывается правильным (рис.2.13б).
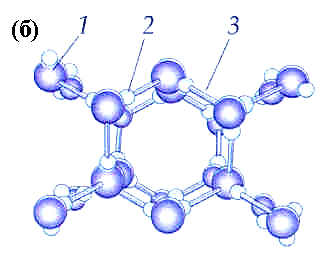
Рис.2.13. Гипотетическая схема модели структуры льда (а – тетраэдры; б – положение молекул воды в структуре льда: 1 – атом кислорода, 2 – атом водорода, 3 – водородные связи).
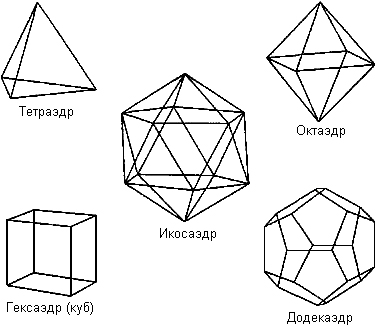
У жидкой воды, кроме тетраэдрических, могут быть и другие формы водородных связей, например, додекаэдров – двенадцатигранников (рис.2.14).
Рис.2.14. Возможные варианты форм водородных связей в молекуле воды. При таянии льда - переходе его в воду, тетраэдры начинают распадаться, но в каком количестве и с какой скоростью – пока неизвестно. По мнению разных ученых при плавлении льда разрывается от 11 до 50% водородных связей, а некоторые полагают, что таких разрывов не происходит вообще. Чистая вода, таким образом, в любых агрегатных состояниях оказывается практически мало изученной чрезвычайно гибкой, изменчивой равновесной структурной смесью пара, льда и жидкости. Факт существования в реальных термодинамических условиях Земли вещества одновременно в трех фазах, чутко реагирующего на малейшие изменения давления, температуры и магнитных полей, свидетельствует о необычайной сложности его природы. Известный геофизик, океанолог академик В.В.Шулейкин (1885-1979) отмечал, что «Среди всех веществ, изучаемых физиками и физико-химиками, вода во многих отношениях является самым трудным». В этой связи становится понятным заключение некоторых исследователей о том, что: «К сожалению, науки о воде не могут похвастаться большими успехами в разгадке особенностей структуры воды. До настоящего времени мы обладаем на этот счет лишь более или менее правдоподобными гипотезами, еще далекими от превращения их в общепринятую теорию воды, которая объяснила бы все ее аномальные особенности и более чем странное поведение».
Так называемые сложные ассоциированные молекулы пара (Н2О), воды (Н2О)2 и льда (Н2О)3, находятся в описанных кластерах в подвижном равновесии. В воде, иными словами, все время происходит переход молекул чисто воды в молекулы льда и наоборот, при этом их соотношение при каждой температуре всегда остается постоянным. Другое дело, что многочисленные конкретные схемы строения этих молекул все еще остаются гипотетическими (см. рис.2.14), так как возможности прямого наблюдения кластеров ограничены и экспериментаторы «компенсируют аппаратурные недостатки интуицией и теоретическими построениями». Разделить же кластер на отдельные молекулы, по мнению современных ученых, невозможно – «простая» вода «не торопится раскрывать свои внутренние секреты».
|
||||||
|
Последнее изменение этой страницы: 2021-01-08; просмотров: 176; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.221.53.5 (0.005 с.) |
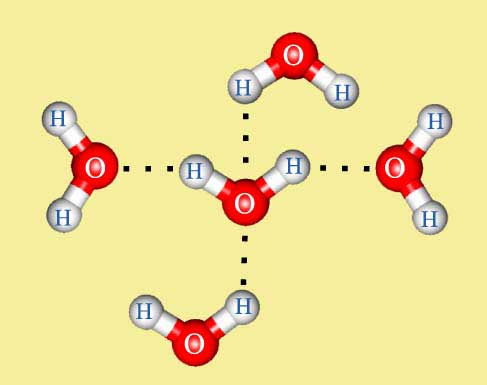
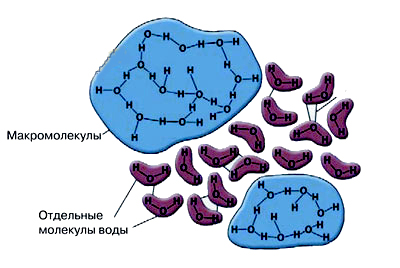 Рис.2.12. Кластеры (синий) – сложные комплексы молекул Н2О, скрепленных между собой внутри комплекса водородными связями.
Рис.2.12. Кластеры (синий) – сложные комплексы молекул Н2О, скрепленных между собой внутри комплекса водородными связями.