Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
II . Актуализация опорных знанийСодержание книги
Поиск на нашем сайте
КАРТА ЗАНЯТИЯ № 33 Учебный предмет: Химия Тема Углеводы Цели занятия: образовательные:познакомить обучающихся с классификацией углеводов, с особенностями их строения, со свойствами углеводов, с биологической ролью и применением углеводов; развивающие: продолжить развитие умений выявлять связь между составом и строением веществ, их свойствами и функциями; работать с дополнительной литературой, составлять опорные конспекты; воспитательные: продолжить эстетическое воспитание обучающихся, формирование у них навыков работы в группе, формирование научного мировоззрения. Норма времени: 2 часа Тип занятия: комбинированный Вид занятия: лекция с элементами презентации Форма организации учебной деятельности: индивидуальная, групповая План занятия: 1.Углеводы, их классификация. 2.Химические свойства глюкозы. 3.Применение глюкозы. Оснащение: проектор, экран, презентация, хим. реактивы, лаб.,посуда Литература: Основные источники:
Дополнительные источники: 1. Рудзитис Г.Е., Фельдман Ф.Г., Химия. 11 класс. – М.: Просвещение, 2014 2. Рудзитис Г.Е., Фельдман Ф.Г., Химия. 10 класс. – М.: Просвещение, 2014 3. Габриелян О. С., Остроумов И. Г. Химия для профессий и специальностей технического профиля: учебник для студ. учреждений сред. проф. образования. — М., 2014. 4. Габриелян О. С., Остроумов И. Г., Остроумова Е. Е. и др. Химия для профессий и специальностей естественно-научного профиля: учебник для студ. учреждений сред. проф. образования. — М., 2014. 5. Габриелян О. С., Остроумов И. Г. Химия для профессий и специальностей социально-экономического и гуманитарного профилей: учебник для студ. учреждений сред. проф. образования. — М., 2014. 6. Габриелян О. С., Остроумов И. Г., Сладков С. А., Дорофеева Н.М. Практикум: учеб. Пособие для студ. учреждений сред. проф. образования. — М., 2014. Интернет ресурсы:
Преподаватель: Корниенко Т.В. Тема: Углеводы
Ход занятия I. Организационный момент. Проверка готовности группы к занятию, проверка присутствующих на занятии. II. Актуализация опорных знаний Тестовая работа по теме «Сложные эфиры. Жиры. Мыло» (Приложение 1) III. Мотивация и целепологания Знакомством с углеводами мы завершаем изучение кислородсодержащих органических веществ. С соединениями этого класса вы уже знакомы из курса биологии и имеете представление о роли углеводов в природе, их значении для жизни. Сегодня мы рассмотрим классификацию углеводов и еще раз остановимся на их роли в природе, чтобы в конце занятия мы смогли ответить на вопрос: «Что же значат углеводы для жизни?» IV. Объяснение нового материала Вопрос 1.Углеводы, их классификация. Углеводами называют вещества с общей формулой Cx(H2O)y, где x и y – натуральные числа. Название «углеводы» говорит о том, что в их молекулах водород и кислород находятся в том же отношении, что и в воде.В животных клетках содержится небольшое количество углеводов, а в растительных – почти 70 % от общего количества органических веществ.
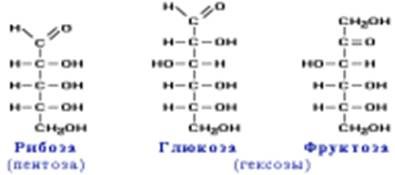
КЛАССИФИКАЦИЯ УГЛЕВОДОВ ПРОСТЫЕ СЛОЖНЫЕ Моносахариды (дисахариды, Полисахариды) Проблемный вопрос: Какие функциональные группы содержатся в углеводах – моносахаридах. Находим ответ на вопрос совместно. Исходя из химических свойств, характерных для глюкозы и фруктозы (качественные реакции) делаем вывод о наличии функциональных групп. Этот вопрос рассмотрим позже. Моносахариды – гетерофункциональные соединения, в состав их молекул входит одна карбонильная группа (альдегидная или кетонная) и несколько гидроксильных. Наиболее распространены моносахариды, в молекулах которых содержится пять углеродных атомов (пентозы) или шесть (гексозы).
Например:
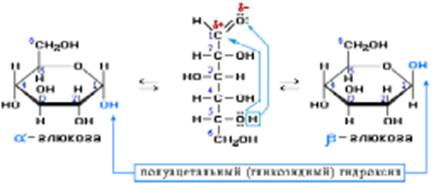
Из этих формул следует, что моносахариды – это альдегидоспирты Строение глюкозы C6H12O6 Экспериментально установлено, что в молекуле глюкозы присутствуют альдегидная и гидроксильная группы. В результате взаимодействия карбонильной группы с одной из гидроксильных глюкоза может существовать в двух формах: открытой цепной и циклической.
В растворе глюкозы эти формы находятся в равновесии друг с другом. Например, в водном растворе глюкозы существуют следующие структуры:
Циклические α- и β - формы глюкозы представляют собой пространственные изомеры, отличающиеся положением полуацетального гидроксила относительно плоскости кольца. В α-глюкозе этот гидроксил находится в транс-положении к гидроксиметильной группе -СН2ОН, в β-глюкозе – в цис-положении. С учетом пространственного строения шестичленного цикла формулы этих изомеров имеют вид: В твёрдом состоянии глюкоза имеет циклическое строение. Обычная кристаллическая глюкоза – это α- форма. В растворе более устойчива β-форма (при установившемся равновесии на неё приходится более 60% молекул). Доля альдегидной формы в равновесии незначительна. Для глюкозы характерна межклассовая изомерия – фруктоза. Строение фруктозы. Фруктоза — изомер и «близкий родственник» глюкозы. Она хорошо растворима в воде, имеет сладкий вкус (примерно в 3 раза слаще глюкозы). Фруктоза также наиболее часто встречается в циклических формах (α- или β) но, в отличие от глюкозы, в пятичленных. Фруктоза и глюкоза в больших количествах содержатся в сладких фруктах, пчелином меде.
Физические свойства глюкозы: Глюкоза – бесцветное кристаллическое вещество, хорошо растворимое в воде, сладкое на вкус (лат. «глюкос» – сладкий): 1) она встречается почти во всех органах растения: в плодах, корнях, листьях, цветах; 2) особенно много глюкозы в соке винограда и спелых фруктах, ягодах; 3) глюкоза есть в животных организмах; 4) в крови человека ее содержится примерно 0,1 %.
Получение глюкозы. А)В промышленности. · Гидролиз крахмала: (C6H10O5)n + nH2O t,H+→ nC6H12O6 крахмал глюкоза Б)В лаборатории. · Из формальдегида (1861 г А.М. Бутлеров): 6 HCOH Ca(OH)2→ C6H12O6 формальдегид В)В природе. · Фотосинтез: 6CO2 + 6H2O hν, хлорофилл → C6H12O6 + 6O2 Г)Другие способы. · Гидролиз дисахаридов: C12H22O11 + H2O t,H+→ 2C6H12O6 мальтоза глюкоза C12H22O11 + H2O t,H+→ C6H12O6 + C6H12O6 сахароза глюкоза фруктоза Вопрос 2.Химические свойства глюкозы. Спиртовое брожение: C6H12O6 → 2C2H5OH + 2CO2↑ 2. Молочнокислое брожение: 2C3H6O3 → C6H12O6 3. Маслянокислое брожение: C6H12O6 → C3H7COOH + 2H2↑+ 2CO2↑ II. Свойства альдегидов. 1. Реакция серебряного зеркала: СH2OH(CHOH)4-COH + Ag2O t.NH3→ СH2OH(CHOH)4-COOH + 2Ag↓ глюконовая кислота Лабораторные опыты: 10. Взаимодействие глюкозы со гидроксидом меди (II) при нагревании. 2. Окисление гидроксидом меди (II): СH2OH(CHOH)4-COH + 2Cu(OH)2 t → СH2OH(CHOH)4-COOH + Cu2O + 2H2O голубой красный 3. Восстановление: СH2OH(CHOH)4-COH + H2 t,Ni → СH2OH(CHOH)4CH2OH сорбит – шестиатомный спирт Свойства многоатомных спиртов. и при обычных условиях: Применение сахарозы. · Продукт питания; · В кондитерской промышленности; · Получение искусственного мёда. Контроль и самопроверка. Предлагается ответить на вопросы и выполнить самостоятельно (проверочный мини-тест). 1. Расположите вещества в порядке возрастания числа атомов углерода в составе молекулы: А. Сахарозы Б. Глюкозы В. Рибозы 2. Тетрозы, пентозы, гексозы – это: А. Дисахариды Б. Моносахариды В. Полисахариды 3. Самый сладкий моносахарид: А. Глюкоза Б. Фруктоза В. Рибоза VII. Рефлексия Обучающиеся отмечают точкой или галочкой на своих листах самооценивания свой уровень: ближе к «+» или к «-» внутри диполя А. МОИ ЗНАНИЯ (полученные на занятии)
Б. СТАРАНИЕ, ПРИЛЕЖАНИЕ (во время этого занятии)
Через минуту раздастся звонок, Увы, но к концу подошел наш урок Большое спасибо я всем говорю, Мы цели достигли – благодарю!
VIII. Домашнее задание О.1читать §8.5,сделать в тетради упр.2,с.187 Д.1читать §31-34,сделать в тетради тест стр.156
Приложение 1
Часть А А1. Общая формула сложных эфиров: а) RCHO; б) RCOOH; в) RCH₂OH; г) RCOOR. А2. К сложным эфирам относится: а) глицерин; б) этилацетат; в) диэтиловый эфир; г) метилэтиловый эфир. А3. Реакция между муравьиной кислотой и этанолом называется реакцией: а) гидролиза; б) этерификации; в) омыления; г) поликонденсации. А4. Укажите вещество, которое может реагировать с гидроксидом калия: а) этан; б) этиловый эфир уксусной кислоты; в) этанол; г) ацетон. А5. Жиры – это сложные эфиры: а) этанола и минеральных кислот; б) глицерина и минеральных кислот; в) этанола и высших карбоновых кислот; г) глицерина и высших карбоновых кислот. А6. RCOOR – это общая формула: а) карбоновых кислот; б) простых эфиров; в) спиртов; г) сложных эфиров. А7. К сложным эфирам не относится: а) метилацетат; б) этиловый эфир уксусной кислоты; в) этилформиат; г) метилэтиловый эфир. А8. Продуктами реакции этерификации являются; а) альдегид и вода; б) простой эфир и вода; в) сложный эфир и вода; г) карбоновая кислота и спирт. А9. В результате кислотного гидролиза сложного эфира образуются: а) карбоновая кислота и спирт; б) карбоновая кислота и альдегид; в) соль карбоновой кислоты и спирт; г) простой эфир и спирт. А10. Для приготовления маргарина жидкие масла подвергают: а) гидрированию; б) галогенированию; в) гидролизу; г) пиролизу. А11. В реакцию гидрирования вступают жиры, образованные глицерином и кислотой: 1) СН3СООН; 2) С17Н33СООН 3) С17Н35СООН;; 4) С15Н31СООН. 1) гидрирования; 3) этерификации; 2) гидратации; 4) изомеризации. 1) в бензине; 3) в диэтиловом эфире; 2) в бензоле; 4) в воде. 1) глицерин и мыло; 2) глицерин и предельные кислоты; 3) глицерин и непредельные кислоты; 4) глицерин и смесь кислот. 1) этерификации спирта и карбоновой кислоты; 2) гидролиза жиров в присутствии щелочи; 3) гидрогенизации жиров; 4) гидролиза жиров под действием воды. 1) натриевые соли; 2) калиевые соли; 3) остатки карбоновых кислот; 4) глицерин. а) кетонам; б) сложным эфирам; в) карбоновым кислотам; г) простым эфирам. А18. Жидкие растительные жиры (масла) можно превратить в твёрдые в результате: а) дегидрирования; б) окисления; в) гидрирования; г) гидратации. А19. В результате гидрирования жидких жиров образуются: а) твёрдые жиры; б) твёрдые жиры и предельные кислоты; в) твёрдые жиры и глицерин; г) твёрдые жиры и непредельные кислоты. А20. Вещество, которое может входить в состав твердого мыла: г).все перечисленные вещества Часть В КАРТА ЗАНЯТИЯ № 33 Учебный предмет: Химия Тема Углеводы Цели занятия: образовательные:познакомить обучающихся с классификацией углеводов, с особенностями их строения, со свойствами углеводов, с биологической ролью и применением углеводов; развивающие: продолжить развитие умений выявлять связь между составом и строением веществ, их свойствами и функциями; работать с дополнительной литературой, составлять опорные конспекты; воспитательные: продолжить эстетическое воспитание обучающихся, формирование у них навыков работы в группе, формирование научного мировоззрения. Норма времени: 2 часа Тип занятия: комбинированный Вид занятия: лекция с элементами презентации Форма организации учебной деятельности: индивидуальная, групповая План занятия: 1.Углеводы, их классификация. 2.Химические свойства глюкозы. 3.Применение глюкозы. Оснащение: проектор, экран, презентация, хим. реактивы, лаб.,посуда Литература: Основные источники:
Дополнительные источники: 1. Рудзитис Г.Е., Фельдман Ф.Г., Химия. 11 класс. – М.: Просвещение, 2014 2. Рудзитис Г.Е., Фельдман Ф.Г., Химия. 10 класс. – М.: Просвещение, 2014 3. Габриелян О. С., Остроумов И. Г. Химия для профессий и специальностей технического профиля: учебник для студ. учреждений сред. проф. образования. — М., 2014. 4. Габриелян О. С., Остроумов И. Г., Остроумова Е. Е. и др. Химия для профессий и специальностей естественно-научного профиля: учебник для студ. учреждений сред. проф. образования. — М., 2014. 5. Габриелян О. С., Остроумов И. Г. Химия для профессий и специальностей социально-экономического и гуманитарного профилей: учебник для студ. учреждений сред. проф. образования. — М., 2014. 6. Габриелян О. С., Остроумов И. Г., Сладков С. А., Дорофеева Н.М. Практикум: учеб. Пособие для студ. учреждений сред. проф. образования. — М., 2014. Интернет ресурсы:
Преподаватель: Корниенко Т.В. Тема: Углеводы
Ход занятия I. Организационный момент. Проверка готовности группы к занятию, проверка присутствующих на занятии. II. Актуализация опорных знаний
|
||||
|
Последнее изменение этой страницы: 2021-01-08; просмотров: 100; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.191.200.151 (0.013 с.) |