
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
II . Актуализация опорных знанийСодержание книги
Поиск на нашем сайте
КАРТА ЗАНЯТИЯ № 26 Учебный предмет: Химия Тема Глицерин как представитель многоатомных спиртов. Цели занятия: образовательные: изучить строение и свойства многоатомных спиртов развивающие: продолжить формирование умений: наблюдать за физическими и химическими явлениями, объяснять наблюдаемые явления. воспитательные: формирование интереса к предмету Норма времени: 2 часа Тип занятия: комбинированный Вид занятия: лекция с элементами беседы, презентации Форма организации учебной деятельности: групповая, парная План занятия: 1.Качественная реакция на многоатомные спирты. Применение глицерина. 2.Физические и химические свойства фенола. 3.Взаимное влияние атомов в молекуле фенола: взаимодействие с гидроксидом натрия и азотной кислотой. 4.Применение фенола на основе его свойств. Оснащение: проектор, экран, презентация, хим. реактивы, лаб. посуда, видеоролик Литература: Основные источники:
Дополнительные источники: 1. Рудзитис Г.Е., Фельдман Ф.Г., Химия. 11 класс. – М.: Просвещение, 2014 2. Рудзитис Г.Е., Фельдман Ф.Г., Химия. 10 класс. – М.: Просвещение, 2014 3. Габриелян О. С., Остроумов И. Г. Химия для профессий и специальностей технического профиля: учебник для студ. учреждений сред. проф. образования. — М., 2014. 4. Габриелян О. С., Остроумов И. Г., Остроумова Е. Е. и др. Химия для профессий и специальностей естественно-научного профиля: учебник для студ. учреждений сред. проф. образования. — М., 2014. 5. Габриелян О. С., Остроумов И. Г. Химия для профессий и специальностей социально-экономического и гуманитарного профилей: учебник для студ. учреждений сред. проф. образования. — М., 2014. 6. Габриелян О. С., Остроумов И. Г., Сладков С. А., Дорофеева Н.М. Практикум: учеб. Пособие для студ. учреждений сред. проф. образования. — М., 2014. Интернет ресурсы:
Преподаватель: Корниенко Т.В. Тема: Глицерин как представитель многоатомных спиртов.
Ход занятия I. Организационный момент. Проверка готовности группы к занятию, проверка присутствующих на занятии. II. Актуализация опорных знаний Тестовая работа по теме «Спирты » (Приложение 1) III. Мотив ация и целепологания Посмотрите, пожалуйста, на предметный столик. На нем находятся следующие предметы: шоколад, лекарственные препараты, крема, шампуни, мыло, антифриз. Почему на этот урок подготовлены столь непохожие по применению предметы? Конечно, эти предметы не случайны и имеют самое непосредственное отношение к нашему уроку. Но что их объединяет? IV. Объяснение нового материала Вопрос 1.Качественная реакция на многоатомные спирты. Применение глицерина. Многоатомные спирты – органические соединения, в молекулах которых содержится несколько гидроксильных групп (-ОН), соединённых с углеводородным радикалом Гликоли (диолы)
Этиленгликоль (этандиол) | |||||
| Формула | Модели молекулы | |||||
| шаростержневая | полусферическая | |||||
| HO-CH2CH2-OH | 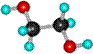
| 
| ||||
Физические свойства многоатомных спиртов
- Сиропообразная, вязкая бесцветная жидкость, имеет спиртовой запах, хорошо смешивается с водой, сильно понижает температуру замерзания воды (60%-ый раствор замерзает при -49 ˚С) –это используется в системах охлаждения двигателей – антифризы.
– Этиленгликоль токсичен – сильный Яд! Угнетает ЦНС и поражает почки.
Триолы

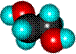
| Глицерин (пропантриол-1,2,3) | ||
| Формула | Модели молекулы | |
| шаростержневая | полусферическая | |
| HOCH2-СH(OH)-CH2OH | 
| 
|
–Бесцветная, вязкая сиропообразная жидкость, сладкая на вкус. Не ядовит. Без запаха. Хорошо смешивается с водой.
– Распространён в живой природе. Играет важную роль в обменных процессах, так как входит в состав жиров (липидов) животных и растительных тканей.
Номенклатура
В названиях многоатомных спиртов (полиолов) положение и число гидроксильных групп указывают соответствующими цифрами и суффиксами -диол (две ОН-группы), -триол (три ОН-группы) и т.д. Например:

Получение многоатомных спиртов
Получение двухатомных спиртов
В промышленности
1. Каталитическая гидратация оксида этилена (получение этиленгликоля): 
2. Взаимодействие дигалогенпроизводных алканов с водными растворами щелочей:

3. Из синтез-газа:
2CO + 3H2 250°,200МПа, kat → CH2(OH)-CH2(OH)
В лаборатории
1. Окисление алкенов:
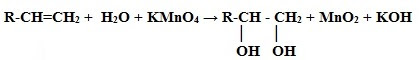
Получение трёхатомных спиртов (глицерина)
В промышленности
Омыление жиров (триглицеридов):  Химические свойства многоатомных спиртов:
Химические свойства многоатомных спиртов:
Кислотные свойства
1. С активными металлами:
HO-CH2-CH2-OH + 2Na → H2↑+ NaO-CH2-CH2-ONa (гликолят натрия)
2. С гидроксидом меди(II) – качественная реакция! 

Упрощённая схема
Основные свойства
С азотной кислотой
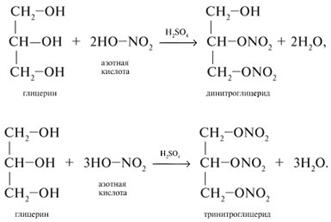 Тринитроглицерин - основа динамита
Тринитроглицерин - основа динамита
Применение
– Этиленгликоль производства лавсана, пластмасс, и для приготовления антифризов — водных растворов, замерзающих значительно ниже 0°С (использование их для охлаждения двигателей позволяет автомобилям работать в зимнее время); сырьё в органическом синтезе.
– Глицерин широко используется в кожевенной, текстильной промышленности при отделке кож и тканей и в других областях народного хозяйства. Сорбит (шестиатомный спирт) используется как заменитель сахара для больных диабетом. Глицерин находит широкое применение в косметике, пищевой промышленности, фармакологии, производстве взрывчатых веществ. Чистый нитроглицерин взрывается даже при слабом ударе; он служит сырьем для получения бездымных порохов и динамита ― взрывчатого вещества, которое в отличие от нитроглицерина можно безопасно бросать. Динамит был изобретен Нобелем, который основал известную всему миру Нобелевскую премию за выдающиеся научные достижения в области физики, химии, медицины и экономики. Нитроглицерин токсичен, но в малых количествах служит лекарством, так как расширяет сердечные сосуды и тем самым улучшает кровоснабжение сердечной мышцы.
Строение Фенола.
Функциональная гидроксильная группа присуща не только спиртам, но и другому классу органических соединений, которые называют фенолами.
У веществ этого класса гидроксил связан не с алкильным радикалом, а с фенилом, т.е. ароматическим радикалом. (Правило записать).
Фенолы – это органические соединения, в молекулах которых радикал фенил связан с одной или несколькими гидроксильными группами.
Простейший представитель этого класса органических соединений является
фенол – С6 Н5ОН.
Классификация и изомерия
классификация и изомерия фенолов в зависимости от числа ОН-групп различают одноатомные фенолы (например, вышеприведенные фенол и крезолы) и многоатомные.
Фенолам свойственна структурная изомерия (изомерия положения гидроксигруппы).
Физические свойства фенола
Фенол представляет собой белые игольчатые кристаллы с характерным запахом, быстро розовеющие на воздухе в результате окисления. Он малорастворим в холодной воде, но неограниченно – в горячей. В медицине до сих пор используют исторически сложившееся название этого вещества – карболовая кислота.
Вопрос 3.Взаимное влияние атомов в молекуле фенола: взаимодействие с гидроксидом натрия и азотной кислотой.
Рассмотрим как фенильная группа C6H5– и гидроксогруппа –ОН взаимно влияют друг на друга. Неподеленная электронная пара атома кислорода притягивается р-электронным облаком бензольного кольца, из-за чего связь в гидроксиле О–Н сильно поляризуется, поэтому фенол проявляется кислотные свойства сильнее, чем вода и спирты. Кислотные свойства у фенолов выражены ярче, чем у предельных спиртов. По кислотным свойствам фенол превосходит этанол в 106 раз. При этом во столько же раз уступает уксусной кислоте.
В бензольном кольце нарушается симметричность электронного облака, электронная плотность повышается в положении 2,4,6. Это делает более реакционноспособными связи С-Н в положениях 2,4,6 или орто– и пара– положениях бензольного кольца.

1.Свойства фенола, обусловленные наличием гидроксогруппы (влияние бензольного кольца):
● С активными металлами (просмотр видеофрагмента)
2C6H5- OH + 2Na → 2C6H5- ONa + H2↑
фенолят натрия
● Со щелочами (просмотр видеофрагмента)
C6H5- OH + NaOH (водн. р-р) ↔ C6H5- ONa + H2O
! Феноляты – соли слабой карболовой кислоты, разлагаются угольной кислотой:
C6H5-ONa + H2O + СO2 → C6H5-OH + NaHCO3
2.Свойства фенола, обусловленные наличием бензольного кольца (влияние гидроксогруппы).
Гидроксильная группа повышает электронную плотность в бензольном кольце, особенно, в орто - и пара- положениях (+ М -эффект ОН-группы):
● Нитрование. При использовании концентрированной азотной кислоты образуется 2,4,6-тринитрофенол (пикриновая кислота): 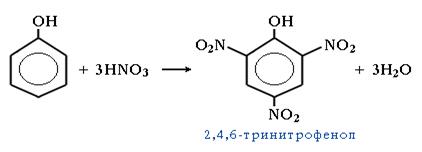
● Гидрирование фенола

циклогексиловый спирт (циклогексанол)
3.Качественные реакции на фенол:
● Фенол легко при комнатной температуре взаимодействует с бромной водой с образованием белого осадка 2,4,6-трибромфенола (просмотр видеофрагмента)
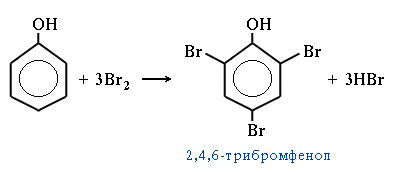
● Взаимодействие с хлоридом железа (III) – фиолетовое окрашивание (просмотр видеофрагмента)
6C6H5-OH + FeCl3 → [Fe(C6H5-OH)3](C6H5O)3 + 3HCl
FeCl3 - светло-жёлтый раствор
[Fe(C6H5-OH)3](C6H5O)3 - фиолетовый раствор
Вопрос 4.Применение фенола на основе его свойств.
Биологическое воздействие
Биологическая роль соединений фенола:
Положительная
• лекарственные препараты (пурген, парацетамол)
• антисептики (3-5 % раствор – карболовая кислота)
• эфирные масла (обладают сильными бактерицидными и противовирусными свойствами, стимулируют иммунную систему, повышают артериальное давление: - анетол в укропе, фенхеле, анисе - карвакрол и тимол в чабреце - эвгенол в гвоздике, базилике
• Флавоноиды (способствуют удалению радиоактивных элементов из организма)
Отрицательная (токсическое действие)
• фенолформальдегидные смолы
• пестициды, гербициды, инсектициды
• загрязнение вод фенольными отходами.
VII. Рефлексия.
Что удалось из того, что было запланировано? Что нового узнали? Продуктивно ли вы поработали, усвоили ли материал? Какой учебный материал был сложным для вас? Удовлетворены своей работой сегодня на уроке?
VIII. Домашнее задание О.1§8.1упр.7, с.168;
Д.1§19-20,тест стр.93,99
Приложение 1
Тест «Спирты»
Работа состоит из 1 части и включает 12 заданий, базового уровня. К каждому заданию дается 4 варианта ответа, из которых только один правильный. За выполнение каждого задания - 1 балл. Максимальное количество баллов – 12. На выполнение работы отводится 15 минут.
Баллы, полученные за выполненные задания, суммируются.
Желаю успеха!
Система оценивания работы.
| 12 -11 баллов – «5» | 8 - 7 баллов – «3» |
| 10 - 9 баллов – «4» | 6 и менее баллов – «2» |
Вариант 1.
Уберите «лишнее» вещество.
а) C3H7OH; б) C2H5OH; в) CH3COH; г) CH3OH.
3. Спирт, структурная формула которого CH3- CH 2 - CH - CH 2 - OH
׀
CH 3
называется:
а) 2-метилпропанол; б) пентанол-1;
в) 2-метилбутанол-1; г) метилбутанол-1;
Этанол НЕ реагирует с
а) водой; б) гидроксидом меди (II); в) оксидом меди (II); г) кислородом.
8. При нагревании выше 140 о C в присутствии Н2 SO 4 из этанола получается:
а) метан; б) этиленгликоль; в) этилен; г) ацетилен.
9. Водородные связи НЕ устанавливаются между молекулами:
а) метанола; б) пропанола; в) воды; г) водорода.
10. При дегидратации изопропилового спирта образуется:
а) этилен; б) ацетилен; в) пропилен; в) пропин.
11.Сырьем для многих химических производств является:
а) метанол; б) этанол; в) пропанол; в) бутанол.
Вариант 2.
Из спирта нельзя получить
а) сложный эфир; б) простой эфир; в) алкен; г) галоген.
10. В молекуле СН3О N а имеются следующие виды химической связи:
а ) только ковалентная; б) ковалентная полярная и ковалентная неполярная;
в)только ионная; г) ковалентная полярная и ионная.
11. Каким веществом метанол окисляется в формальдегид:
а) водородом; б) натрием; в) оксидом меди (II); г) пероксидом водорода.
12. Этиловый спирт НЕ используется:
а) в медицине; б) в косметической промышленности;
в) пищевой промышленности; г) в сельском хозяйстве.
Ответы.
| № варианта | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 |
| 1 | г | в | в | а | в | а | б | в | г | г | в | г |
| 2 | б | а | а | б | г | б | г | а | г | г | в | г |
КАРТА ЗАНЯТИЯ № 26
Учебный предмет: Химия
Тема Глицерин как представитель многоатомных спиртов.
Цели занятия:
образовательные: изучить строение и свойства многоатомных спиртов
развивающие: продолжить формирование умений: наблюдать за физическими и химическими явлениями, объяснять наблюдаемые явления.
воспитательные: формирование интереса к предмету
Норма времени: 2 часа
Тип занятия: комбинированный
Вид занятия: лекция с элементами беседы, презентации
Форма организации учебной деятельности: групповая, парная
План занятия:
1.Качественная реакция на многоатомные спирты. Применение глицерина.
2.Физические и химические свойства фенола.
3.Взаимное влияние атомов в молекуле фенола: взаимодействие с гидроксидом натрия и азотной кислотой.
4.Применение фенола на основе его свойств.
Оснащение: проектор, экран, презентация, хим. реактивы, лаб. посуда, видеоролик
Литература:
Основные источники:
- Естествознание. Химия: учеб. студ учреждений сред. Проф. Образования/.О.С. Габриелян, и.Г. Остроумова.-4-е изд., стер.- М.: Издательский центр «Академия», 2018-240с., [8] с. цв.вкл.
Дополнительные источники:
1. Рудзитис Г.Е., Фельдман Ф.Г., Химия. 11 класс. – М.: Просвещение, 2014
2. Рудзитис Г.Е., Фельдман Ф.Г., Химия. 10 класс. – М.: Просвещение, 2014
3. Габриелян О. С., Остроумов И. Г. Химия для профессий и специальностей технического профиля: учебник для студ. учреждений сред. проф. образования. — М., 2014.
4. Габриелян О. С., Остроумов И. Г., Остроумова Е. Е. и др. Химия для профессий и специальностей естественно-научного профиля: учебник для студ. учреждений сред. проф. образования. — М., 2014.
5. Габриелян О. С., Остроумов И. Г. Химия для профессий и специальностей социально-экономического и гуманитарного профилей: учебник для студ. учреждений сред. проф. образования. — М., 2014.
6. Габриелян О. С., Остроумов И. Г., Сладков С. А., Дорофеева Н.М. Практикум: учеб. Пособие для студ. учреждений сред. проф. образования. — М., 2014.
Интернет ресурсы:
- www. hemi. wallst. ru (Образовательный сайт для школьников «Химия»).
- www. alhimikov. net (Образовательный сайт для школьников).
- www. chem. msu. su (Электронная библиотека по химии).
- www. enauki. ru (интернет-издание для учителей «Естественные науки»).
- www.5ballov. ru/test (Тест для абитуриентов по всему школьному курсу биологии).
- www. informika. ru (Электронный учебник, большой список интернет-ресурсов).
- www. kozlenkoa. narod. ru (Для тех, кто учится сам и учит других; очно и дистанционно,биологии, химии, другим предметам).
Преподаватель: Корниенко Т.В.
Тема: Глицерин как представитель многоатомных спиртов.
Ход занятия
I. Организационный момент.
Проверка готовности группы к занятию, проверка присутствующих на занятии.
II. Актуализация опорных знаний
Тестовая работа по теме «Спирты » (Приложение 1)
|
| Поделиться: |





