
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Задачи на вычисление массы растворенного вещества, содержащегося В определенной массе раствора с известной массовой долей были достаточно стандартны. Однако успешность их решения невелика.
B9 (24%). После добавления 20 г воды к раствору, содержащему 10 г нитрата меди(II) в 100 г воды, массовая доля соли в полученном растворе составила ________% (Запишите число с точностью до десятых) Наиболее вероятной причиной ошибок было то, что школьники путают массу воды и массу раствора при расчете массовой доли. Нестабильность результатов выполнения части В показывает, что выпускники имеют пробелы по отдельным разделам школьного курса химии, что особенно проявляется при выполнении заданий повышенной сложности. В подготовке следующего потока выпускников необходимо обратить внимание при подготовке к экзамену на более четкое знание номенклатуры химических веществ, умение анализировать возможности их участия в различных типах реакций, навыки решения расчетных задач. Необходимо формировать и умения выполнять задания с кратким ответом. Часть C. С заданиями С-1 школьники справились успешнее всего, хотя и несколько хуже, чем в прошлом году. Принципиальных отличий в заданиях не было. Наиболее сложным уравнением в вариантах первой волны экзамена явилось следующие задания: С1 (55%). Используя метод электронного баланса, составьте уравнение реакции: FeSO 4 + KMnO 4 +…→…+ K 2 SO 4 + K 2 MnO 4 Большинство испытуемых в качестве среды выбрали серную кислоту, а в качестве продукта реакции сульфат железа (III) Степень окисления Mn изменяется от +7 до +6 в щелочной среде! FeSO 4 окисляется в щелочной среде до Fe (OH)3 FeSO4+KMnO4+3KOH→ Fe(OH)3 +K2SO4+K2MnO4 FeSO 4 – восстановитель, KMnO 4 – окислитель С1. Используя метод электронного баланса, составьте уравнение p еакции: Соединения хрома(III) при окислении в щелочной среде образуют хроматы (CrO 4 2-). Степень окисления хрома увеличивается от +3 до +6, следовательно NaCrO 2 является восстановителем, а окислителем будет служить Br 2, степень окисления которого снижается от 0 до -1. Электронный баланс: Cr +3 -3 e - → Cr +6 2 Br 2 +2 e - →2 Br - 3 2 NaCrO 2 +3 Br 2 +8 NaOH →2 Na 2 CrO 4 +6 NaBr +4 H 2 O
Самая заметная отрицательная динамика выявилась в выполнении задания С-2 (–14,3%). Тем самым уровень выполнения задания вернулся к 2006 году. Такой низкий результат, в какой то мере объяснялся тем, что задания этого года действительно были сложными, в большинстве из них требовалось увидеть возможность протекания нескольких ОВР, не всегда связанных со школьной программой, и правильно написать уравнения этих реакций.
Наиболее сложным заданием первой волны оказалось задание: С2 (1 0 %). Даны вещества: железо, железная окалина, разбавленная соляная кислота, конц. азотная кислота. Большинство школьников не знают формулу железной окалины. Fe +2HCl=FeCl2+H2 Fe3O4+10HNO3=3Fe(NO)3+NO2+5H2O Fe3O4+Fe=4FeO Fe3O4+8HCl=2FeCl3+FeCl2+4H2O С 2 (15%). Даны вещества: фосфор, вода, азотная кислота, серная кислота (конц). Напишите уравнения четырех возможных реакций между этими веществами. Сложность задания в том, что здесь нет возможности кислотно-основного или обменного взаимодействия, и хотя есть сильные окислители, но надо было увидеть окислительные возможности воды, восстановительные возможности фосфора, неоднозначность азотной кислоты в зависимости от концентрации. В выполнении этих заданий можно предложить следующий алгоритм: Кислотно-основные реакции. Есть ли в наборе явные кислоты, кислотные оксиды, кислые соли с одной стороны и основания, основные оксиды, основные соли с другой? Если да, запишите уравнения реакций между ними. Прочие реакции обмена. Учтите, что они протекают, если образуется газ, осадок, или слабый электролит. Окислительно-восстановительные реакции. Есть ли в наборе типичные окислители и типичные восстановители? Можете ли вы определить продукты реакции между ними? Возможны ли особые реакции отдельных веществ? Ответ на этот вопрос ученик может дать в зависимости от знаний свойств конкретных веществ. Другие замечания по заданию С2: школьники не видят возможность взаимодействия амфотерных оксидов и щелочей, не видят окислительные свойства нитрат-иона, восстановительные иодид-иона, путают продукты реакций с азотной кислотой, допускают ошибки в определении коэффициентов, особенно в уравнениях реакций с перманганатом, дихроматом, хлоратом калия. Задания С-3 (цепочка превращений органических веществ) были выполнены практически на уровне прошлого года (–1,7%). Большинство уравнений реакций, включенные в эти цепочки, отвечали базовому курсу органической химии, наиболее типичным свойствам органических веществ. К новым типам реакций, которые встретились в этом году, можно отнести реакции циклизации и разрушения циклов. Примером наиболее сложной цепочки может служить задание:
С3 (26%) Приведите уравнения реакций, с помощью которых можно осуществить следующие превращения 1,3-дибромбутан Здесь надо было учесть образование циклопропанового цикла на первой стадии, его разрыва на второй, затем образование ароматического кольца на четвертой стадии. Элементы правильного ответа: 1. CH 2 Br - CH 2 - CHBr - CH 3 + Zn ® 2. 3. 2CH3-CHBr-CH2CH3 + 2Na ® 2CH3CH2-CH(CH3)-CH(CH3)-CH2CH3 +2NaBr 4. CH3CH2-CH(CH3)-CH(CH3)-CH2CH3 5. 5
|
||||||
|
Последнее изменение этой страницы: 2021-01-08; просмотров: 61; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 52.15.128.243 (0.008 с.) |
 X 1 ® 2-бромбутан
X 1 ® 2-бромбутан 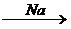 X 2 ®
X 2 ® 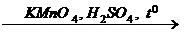 X 3
X 3 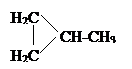 + ZnBr 2;
+ ZnBr 2;
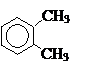 + 4H2;
+ 4H2;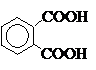 + 12MnSO4 + 6K2SO4 +28H2O;
+ 12MnSO4 + 6K2SO4 +28H2O;


