
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Напишите уравнения ядерных реакций:
Определите тип гибридизации и пространственное строение Следующих молекул и ионов:
3.5. Объясните с помощью метода молекулярных орбиталей возможность образования следующих молекул и ионов, определите порядок связи, установите, являются ли они диамагнитными или парамагнитными:
Химическая термодинамика Первое начало термодинамики: D U = Q – A, где U — внутренняя энергия, Q — теплота, A — работа. Закон Гесса: тепловой эффект химической реакции зависит только от начального и конечного состояния, но не зависит от пути превращения. Следствие из закона Гесса: D H (реакции) = S D Hf (продуктов) – S D Hf (реагентов), где H — энтальпия (D H = D U + p D V), D Hf — энтальпия образования вещества. Второе начало термодинамики:
Для изолированных систем: D S ³ 0. D S (реакции) = S S (продуктов) – S S (реагентов). Свободная энергия Гиббса: D G = D H – T D S, D G (реакции) = S D Gf (продуктов) – S D Gf (реагентов). Для самопроизвольных реакций D G < 0. 4.1. Пользуясь справочными данными, вычислите тепловой эффект 4.1.1. 2SO2(г.) + O2(г.) = 2SO3(г.) 4.1.2. 4NH3(г.) + 3O2(г.) = 2N2(г.) + 6H2O(г.) 4.1.3. 2С2H2(г.) + 5O2(г.) = 4CO2(г.) + 2H2O(г.) 4.1.4. С2H5OH(ж.) + 3O2(г.) = 2CO2(г.) + 3H2O(ж.) 4.1.5. 2KClO3(тв.) = 2KCl(тв.) + 3O2(г.) 4.1.6. 4HCN(г.) + 5O2(г.) = 2H2O(ж.) + 4CO2(г.) + 2N2(г.) 4.1.7. CO2(г.) + C(графит) = 2CO(г.) 4.1.8. C2H4(г.) + 3O2(г.) = 2CO2(г.) + 2H2O(г.) 4.1.9. WO3(тв.) + 2Al(тв.) = Al2O3(тв.) + W(тв.) 4.1.10. TiO2(тв.) + 2Mg(тв.) = Ti(тв.) + 2MgO(тв.) 4.1.11. 2H2O2(ж.) = 2H2O(ж.) + O2(г.) 4.1.12. (CuOH)2CO3(тв.) = 2CuO(тв.) + CO2(г.) + H2O(г.) 4.1.13. Fe2O3(тв.) + 3СO(г.) = 2Fe(тв.) + 3СO2(г.) 4.1.14. CH4(г.) + 2O2(г.) = CO2(г.) + 2H2O(г.) 4.1.15. 2C2H6(г.) + 7O2(г.) = 4CO2(г.) + 6H2O(г.) 4.1.16. 6CO2(г.) + 6H2O(ж.) = C6H12O6(тв.) + 6O2(г.)
4.1.17. 2Fe2O3(тв.) + 3С(графит) = 4Fe(тв.) +3СO2(г.) 4.1.18. С6H12O6(тв.) = 2С2H5OH(ж.) + 2CO2(г.) 4.1.19. 2H2S(г.) + SO2(г.) = 3S(ромб.) + 2H2O(г.) 4.1.20. 4NH3(г.) + 5O2(г.) = 4NO(г.) + 6H2O(ж.) Не производя вычислений, определите знак изменения энтропии в следующих реакциях: 4.2.1. H2(г.) + I2(г.) = 2HI(г.) 4.2.2. 2H2(г.) + O2(г.) = 2H2O(ж.) 4.2.3. PCl3(ж.) + Cl2(г.) = PCl5(тв.) 4.2.4. 2NH3(г.) = N2(г.) + 3H2(г.) 4.2.5. 2SO2(г.) + O2(г.) = 2SO3(ж.) 4.2.6. 3C2H2(г.) = C6H6(ж.) 4.2.7. 2NO(г.) + O2(г.) = 2NO2(г.) 4.2.8. 2H2S(г.) + 3O2(г.) = 2H2O(ж.) + 2SO2(г.) 4.2.9. NH4NO2(тв.) = N2(г.) + 2H2O(ж.) 4.2.10. 2CH3OH(г.) + 3O2(г.) = 4H2O(ж.) + 2CO2(г.) 4.2.11. 2N2O(г.) = 2N2(г.) + O2(г.) 4.2.12. 4NH3(г.) + 5O2(г.) = 4NO(г.) + 6H2O(ж.) 4.2.13. C(графит) + CO2(г.) = 2CO(г.) 4.2.14. 6Li(тв.) + N2(г.) = 2Li3N(тв.) 4.2.15. C(алмаз) = С(графит) 4.2.16. P2O5(тв.) + 3H2O(ж.) = 2H3PO4(тв.) 4.2.17. 4NH3(г.) + 5O2(г.) = 4NO(г.) + 6H2O(г.) 4.2.18. С(графит) + 2N2O(г.) = СO2(г.) + 2N2(г.) 4.2.19. Cu(OH)2(тв.) = CuO(тв.) + H2O(г.) 4.2.20. N2O4(г.) = 2NO2(г.) 4.3. Вычислите изменение свободной энергии Гиббса и определите 4.3.1. NaHCO3(тв.) = NaOH(тв.) + CO2(г.) 4.3.2. 2CH4(г.) + 2NH3(г.) + 3O2(г.) = 2HCN(г.) + 3H2O(ж.) 4.3.3. SiH4(г.) + 2O2(г.) = SiO2(тв.) + 2H2O(ж.) 4.3.4. H2S(г.) + 2O2(г.) = H2SO4(ж.) 4.3.5. 2Ag(тв.) + H2S(г.) = Ag2S(тв.) + H2(г.) 4.3.6. Ca3N2(тв.) + 6H2O(ж.) = 3Сa(OH)2(тв.) + 2NH3(г.) 4.3.7. C6H12O6(тв.) = 2C2H5OH(ж.) + 2CO2(г.) 4.3.8. 4Ag(тв.) + 2H2S(г.) + O2(г.) = 2Ag2S(тв.) + 2H2O(ж.) 4.3.9. NH4NO3(тв.) = N2O(г.) + 2H2O(ж.) 4.3.10. Mg3N2(тв.) = 3Mg(тв.) + N2(г.) 4.3.11. 2KCl(тв.) + 3O2(г.) = 2KClO3(тв.) 4.3.12. 3H2SO4(ж.) + Al2O3(тв.) = Al2(SO4)3(тв.) + 3H2O(ж.) 4.3.13. 4CuO(тв.) = 2Cu2O(тв.) + O2(г.) 4.3.14. PbO2(тв.) + Pb(тв.) = 2PbO(тв.) 4.3.15. 4NO2(г.) = 2N2O(г.) + 3O2(г.) 4.3.16. Al2O3(тв.) + 3H2(г.) = 2Al(тв.) + 3H2O(ж.) 4.3.17. 2Al2O3(тв.) + 3С(графит) = 4Al(тв.) + 3СO2(г.) 4.3.18. CH4(г.) + NH3(г.) = HCN(г.) + 3H2(г.) 4.3.19. 3C2H4(г.) = C6H6(ж.) + 3H2(г.) 4.3.20. SiCl4(ж.) + 2H2O(ж.) = SiO2(тв.) + 4HCl(г.)
|
|||||||||||||||
|
Последнее изменение этой страницы: 2020-12-09; просмотров: 546; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.17.162.247 (0.014 с.) |
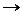 3 n + ...
3 n + ... 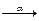 ...
3.3.2. 225Th
...
3.3.2. 225Th 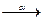 ...
... 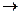 n +...
n +... 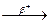 ...
3.3.4. 142Nd+ p
...
3.3.4. 142Nd+ p 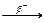 ...
... 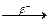 ...
3.3.6. 14N+12C
...
3.3.6. 14N+12C  , где S — энтропия.
, где S — энтропия.


