Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Розробка дидактичного забезпечення для вивчення теми “Алюміній” у класах з поглибленим вивченням хіміїСтр 1 из 5Следующая ⇒
Розробка дидактичного забезпечення для вивчення теми “Алюміній” у класах з поглибленим вивченням хімії
Курсова робота: студентки 5 курсу природничого факультету Завалішиної Оксани Науковий керівник: ст.викл. Винник О.Ф. Харків 2011 Зміст Вступ РОЗДІЛ І. Літературний огляд……………………………………………………3 1.1 Вивчення Алюмінію в загальноосвітній та профільній школах………...4 1.2 Тестування як метод контролю у школах з поглибленим вивченням хімії………………………………………………………………………………..4 РОЗДІЛ ІІ. Розробка дидактичного матеріалу для вивчення теми «Алюміній»…………………………………………………………………………17 2.1 Розробка наочних посібників………………………………………………...17 2.2 План - конспект уроку на тему «Алюміній як хімічний елемент і проста речовина. Фізичні та хімічні властивості алюмінію»………………………...18 2.3 Тестові завдання на тему: «Алюміній. Добування Алюмінію»………….23 Висновки Література
Вступ Актуальність теми: Профільне навчання хімії забезпечує загальноосвітню та початкову допрофесійну підготовку випускників спеціалізованих класів які мають бажання отримати майбутню професію, пов’язану з використанням хімічних знань, виховання особистості, здатної до самоосвіти і творчої самореалізації. Для ефективного навчання досить важливим є забезпечення якість дидактичних матеріалів та коректність їх використання. Як наочні матеріали можуть бути використані: плакати, таблиці, анкети, схеми, тести, фільми, мультимедійні презентації, анімації, моделі. Об'єкт: Методика використання дидактичних матеріалів при вивченні теми “Алюміній”. Предмет: Викладання теми “Алюміній” у хіміко-технологічних класах та класах з поглибленим вивченням хімії. Зміст, форми, методи і засоби формування знань з теми “Алюміній” в шкільному курсі хімії. Мета: Розробка дидактичних матеріалів для вивчення теми "Алюміній" у хіміко-технологічних класах. Завдання: · На основі аналізу програми природничого профілю навчання визначити місце теми “Алюміній” в системі вивчення неорганічної хімії; розробити дидактичні матеріали та конспект уроку на тему “Алюміній як хімічний елемент і проста речовина. Фізичні та хімічні властивості алюмінію”;
· розробити тестові завдання для контролю знань з теми «Алюміній. Виробництво Алюмінію». РОЗДІЛ І. Літературний огляд Вивчення теми «Алюміній» у загальноосвітній і профільній школах Перші відомості про Алюміній як хімічний елемент учні отримують у 7 класі вивчаючи тему “Хімічні елементи, їхні назви і символи” [11], у 8 класі особлива увага приділяється вивченню амфотерності алюміній гідроксиду. З металом та його властивостями діти знайомляться в 10 класі вивчаючи тему “Фізичні та хімічні властивості Алюмінію”. У профільній школі особлива увага приділяється вивченню екологічних проблем металургії та дається більше годин на рішення задач [12]. Класифікація тестів Розрізняють: 1. За процедурою створення: - Стандартизовані; - Не стандартизовані. 2. По засобах пред'явлення: - Бланкові; - Предметні; - Апаратурні; - Практичні; - Комп'ютерні. 3. За спрямованості: - Тести інтелекту; - Особистісні; - Тести досягнень. 4. За характером дій: - Вербальні; - Невербальні. 5. За провідною орієнтації: - Тести швидкості (містять прості задачі); - Тести потужності або результативності (містять важкі завдання); - Змішані тести (завдання різного рівня складності). 6. За ступенем однорідності завдань: - Гомогенні; - Гетерогенні. 7. За об'єктивності оцінювання: - Об'єктивні; - Проективні тести. 8. За спеціалізацією: - Широке орієнтування, що дозволяє оцінити ефективність процесу навчання, ступінь освоєння учнями системи знань, умінь і навичок у ході навчального процесу; - Вузьке орієнтування, спрямоване на виявлення досягнень учнів у процесі освоєння окремих предметів, окремих тем і т.д. 9. За цілями використання (тільки для тестів у системі освіти): - Попередній визначає тест (визначає знання на початку навчання); - Тест прогресу, досягнутого в процесі навчання; - Діагностичний тест. Мета тесту - визначення труднощів навчання. - Сумарний тест (містить питання, що представляють більш високий рівень складності), 10. За широтою використання (тільки для тестів у системі освіти):
- Для використання вчителем; - Для використання групою вчителів, або адміністрацією освітньої установи; - Для цілей відбору і формування груп; - Для атестації учнів. 11. За формою: - Тести закритого типу (завдання з вибором вірної відповіді з набору пропонованих); - Тести відкритого типу (введення передбачуваного відповіді на завдання самим тестуючим)[13]. Основні переваги та недоліки перевірки знань школярів за тестами: 1. Швидкість обробки одержаних результатів. За умови відпрацьованої технології можна довести цей процес до повністю автоматизованої перевірки із забезпеченням максимальної об'єктивності. Але водночас відчуваються втрати щодо культури мовлення та глибини засвоєння знань учня. Традиційні методи в цьому випадку приносять більше користі. 2. Об'єктивність одержаної оцінки Її незалежність від того, хто здійснює тестування. Але дана оцінка не може бути усвідомлена як оцінка саме сукупності знань учня через те, що існує категорія школярів, які традиційно не спроможні ефективно демонструвати свої знання через тестову методику (наприклад, «тугодуми» чи «тестофоби»). 3. Підміна навчальних цілей. Повний перехід виключно на тестову перевірку знань учнів швидко зробить не засвоєння, а саме контроль основною метою діяльності школяра. 4. Звуження змісту навчального предмету. У навчальних закладах існують предмети, зміст яких важко охопити системою тестів. Навіть в межах одного предмету не всі теми рівномірно перевіряються за допомогою тестів. Майже відсутні тестові завдання на перевірку вміння логічно мислити й міркувати. 5. Зниження рівня кваліфікації викладача. Використання готових тестів суттєво полегшує роботу викладача, звільняє його від рутинної роботи, створює умови для творчості. Але при цьому виникає проблема підтримання рівня професійної (предметної) кваліфікації. Перевірка тестових завдань та контрольних робіт здійснюється в автоматичному режимі і не надає професійного навантаження. Самий навчальний простір, який покривається тестовими завданнями, складає лише частину навчального предмету. І якщо викладач не буде використовувати спеціальних і додаткових засобів для свого професійного розвитку, він майже неминуче почне деградувати.
Розробка наочних посібників У класах з поглибленим вивченням хімії можна використати як наочні посібники набори, такі як: «Алюминий» Министерство просвещения РСФСР Главучтехпром Ф-ка №14 «Природа и школа». Тип. «Гудок» Зак.82-75
«Коллекция металлы и сплавы» Министерство просвещения РСФСР Главучтехпром «Природа и школа» Тип. Комб.14 1987.г3 1048. Ту 79 РСФСР 179-84
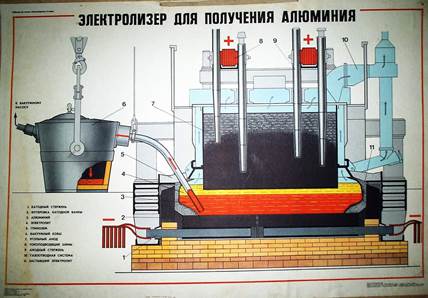
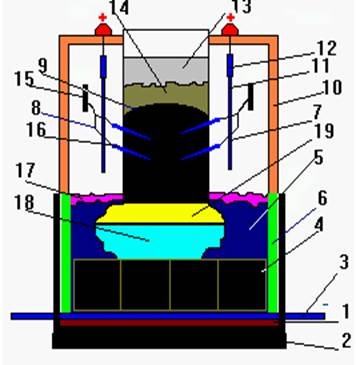
Також можна використовувати як наочність на уроках хімії при вивченні теми добування Алюмінію плакати «Электролизер для получения Алюминия»: 2.2 Розробка плану - конспекту уроку на тему «Алюміній як хімічний елемент і проста речовина. Фізичні та хімічні властивості алюмінію» Амфотерні властивості алюміній оксиду і алюміній гідроксиду - освітня: розширити й поглибити знання учнів про метали на прикладі Алюмінію – представника головної підгрупи ІІІ групи; розглянути фізичні й хімічні властивості Алюмінію; продовжити формувати в учнів уміння складати рівняння окисно-відновних реакцій.
- виховна: сформувати науковий світогляд учнів при вивченні фізичних та хімічних властивостей Алюмінію та його сполук, їх застосування; сприяти екологічному вихованню. - розвиваюча: 1) розвивати спостережливість учнів на уроці хімії; Тип уроку: Урок засвоєння нових знань та вмінь. Методи: загальні (ПІ), часткові (СНП), конкретні (бесіда, розповідь). Обладнання: періодична система хімічних елементів, таблиця розчинності, ряд активності металів, алюмінієвий дріт. Література: 1) Хімія. 10 клас: Розробки уроків (рівень стандарту) / А.В. Промоскаль. – Х.: Вид-во «Ранок», 2011. – 272 с. Хід уроку: І. Актуалізація опорних знань: 1. Пригадайте, що таке металічний зв'язок? Що знаходиться у вузлах кристалічних ґраток у металів? Одна легенда говорить, що одного разу до римського імператора Тиберія прийшов ювелір із металевою обідньою тарілкою, що не розбивається, виготовленою нібито з глини. Тарілка була дуже світлою й блищала, як срібло. За всіма ознаками вона мала бути алюмінієвою. При цьому ювелір стверджував, що тільки він і боги знають, як одержати цей метал з глини. Тиберій, побоюючись, що метал із легкодоступної глини може знецінити золото та срібло, і наказав, про всяк випадок, відрубати людині голову. Очевидно легенда досить сумнівна, тому що самородний Алюміній у природі не зустрічається через свою високу активність, і за часів Римської імперії не могло бути технічних засобів, які б дозволили здобути Алюміній із глинозему. Лише майже через 2000 років – у 1825 р. Ханс Християн Ерстед одержав кілька мг металічного Алюмінію.
Отже, сьогодні, як ви вже здогадалися мова йтиме за Алюміній. Отже, записуємо тему уроку: «Алюміній як хімічний елемент і проста речовина. Фізичні та хімічні властивості алюмінію. Амфотерні властивості алюміній оксиду і алюміній гідроксиду» - знати: фізичні й хімічні властивості Алюмінію та його сполук. - вміти: складати рівняння хімічних реакцій на прикладі хімічних властивостей Алюмінію та його сполук. Положення в Періодичній системі. Учні характеризують положення Алюмінію у Періодичній системі хімічних елементів Д.І. Менделєєва. Учні обговорюють будову атома Алюмінію. Також характеризують інші елементи цієї підгрупи, порівнюють їх з Алюмінієм. Алюміній — метал III групи другого періоду в Періодичній системі хімічних елементів Д.І.Менделєєва. Алюміній у сполуках виявляє ступінь окиснення +3, так як має на зовнішньому енергетичному рівні 3 валентних електрони. Одержують Алюміній електролізом Al2O3 у розплавленому кріоліті за температури близько 1000 0С. 1) З киснем: 4Аl + 3О2 = 2Аl2О3 2) З галогенами: 2Аl + ЗВr2 = 2АlВr3 3) З іншими неметалами при підвищенні температури: 2Аl + 3S = Аl2S3 (сульфід алюмінію) Алюмотермія: 2Аl + 3W3 = 3W + А12О3 Взаємодія з водою після зняття оксидної плівки: 2Аl + 6Н2О = 2Аl(ОН)3 + ЗН2 Після зняття оксидної плівки Алюміній розчиняється в лугах: 2Аl + 2NаОН + 2Н2О = 2NаАlО2 + 3Н2 Розчиняється в розведених кислотах: 2А1 + 6НС1 = 2АlСl3 + ЗН2 2А1 + ЗН2SО4 = Аl2(S04)3 + 3Н2 Алюміній пасивується при взаємодії з концентрованою нітратною кислотою, тому з нею Алюміній взаємодіє лише при нагріванні: Аl + 6НNO3(конц.) = Аl(NО3)3 + 3NО2 + 3Н2О Алюміній оксид Аl 2 O 3 Проявляє амфотерні властивості: Аl2O3 +6 НС1 = 2АlСl3 + 3Н2О Аl 2O3 + 2NаОН + 3Н2О = 2 Na[Al(OH)4] – у розчинах Аl 2O3 + 2NаОН = 2NaAlO2 + Н2О – у процесі сплавлення Алюміній гідроксид Al(OH)3 Проявляє амфотерні властивості: Аl (OH)3 + 3НС1 = АlСl3 + 3Н2О Аl (OH)3 + NаОН = Na[Al(OH)4] – у розчинах 2Аl (OH)3 + Nа2О = 2NaAlO2 + 3 Н2О – у розплаві Поширення в природі: За вмістом в земній корі (8.8%) алюміній займає 3 місце. У вільному стані алюміній не зустрічається. Основні природні сполуки Алюмінію: 1. Нефеліни — (Na,K)2О • АlО3 • 2Si2.
2. Кріоліт — А1F3 • 3NaF 3. Боксити — алюмінієва руда Аl2O3 • хH2O 4. Каолін — А12О3 • 2SiO2 • 2Н2О 5. Глиноземи — суміш каоліну з піском SiO2, вапняком СаСО3, магнезитом МgСО3. Застосування: — в електротехніці; 1.Напишіть рівняння хімічних реакцій, щоб здійснити ланцюжок перетворень: 1) Al → Аl 2 (SO4)3 → Аl (OH)3 → NaAlO2 Чит. §30-31.
Алюміній парамагнетик. 2.7. Алюміній, подібно до міді, досить інертний метал. Розробили П. Еру (Франція) і Ч. Хол (США). 5. Зразу після отримання алюмінію: 5.1. відстоюють та усереднюють в печах-міксерах; 5.2. розплав очищують від натрію та інших лужних металів; 5.3. через розплав пропускають кисень; 5.4. через розплав пропускають хлор; 5.5. швидко охолоджують рідким азотом. 6. Запишіть рівняння реакцій що відповідають перетворенням оксидів Алюмінію при автоклавному вилужнюванні бокситів за способом Байера: Al2O3+ 2NaOH ® 2NaAlO2 7. Запишіть рівняння електродних реакцій що відбуваються в електролізері для виробництва алюмінію: 7.1. катодної_________________________________________________; 7.2. анодної__________________________________________________. К+ Al3+ + 3 е ® Al0 А- 2 AlO33- - 6 е ® Al2O3 + 3О2 8. Запишіть рівняння реакції на якому ґрунтується дистиляція алюміній фториду. __________________________________________________________________ 3AlF Û 2Al + Al F3
9. Знайдіть відповідність між позначеннями:
Висновки 1. На основі аналізу літературних даних встановлено, що профільне навчання хімії забезпечує загальноосвітню та початкову допрофесійну підготовку випускників спеціалізованих класів, які мають бажання обрати майбутню професію, пов'язану з використанням хімічних знань, виховання особистості, здатної до самоосвіти і творчої самореалізації. 2. Розроблено конспект уроку засвоєння нових знань та розвитку умінь учнів на тему: «Алюміній як хімічний елемент і проста речовина. Фізичні та хімічні властивості алюмінію» 3. Розроблено тести для контролю з теми “Алюміній. Виробництво Алюмінію”. 4. Розроблено плакати, схеми. 5. Запропоновано методику використання програмно-методичного комплексу при вивченні даної теми.
Література 1. Анастази А., Урбина С. Психологическое тестирование. - 7-е изд. - СПб.: Питер, 2005. - 688 с. 2. Безпалько В. П. Образование и обучение с участием компьютеров (педагогика ІІІ тысячелетия). - М.: Воронеж: Изд. Московского психолого-социального института, 2002. - 352 с. 3. Бурлачук Л. Ф., Морозов С. М. Словарь- справочник по психодиагностике. - СПб.: Питер, 1999. - 528 с. 4. Долинер Л.И. Компьютерные тесты успеваемости как средство оптимизации учебного процесса // Вестник Московского университета. - 2004. - № 1. 5. Клайн Пол. Справочное руководство по конструированию тестов. Перевод Е. П. Савченко. - М.: «ПАН Лтд.», 1994. - 283 с. 6. Майоров А. Н. Теория и практика создания тестов для системы образования. - М.: Народное образование, 2000 - 352 с. 7. Малихін А. Тести у навчальному процесі сучасної школи // Рідна школа. - 2001. - №8. 8. Методичні рекомендації з організації тестового контролю освітньо-професійної підготовки вчителя. - Тернопіль: видавництво ТНПУ ім. В. Гнатюка, 2004. - 100 с. 9. Педагогическая диагностика. Под ред. К. Ингекампа. Перевод с нем. - М., 1991. - 525 с. 10. Бенеш Н.І. Тести для школи. Арман-ПВ, 2004 11. Хімія. Програма для загальноосвітніх закладів 7-11 кл. 2010р. 12. Хімія. Програма для шкіл з поглибленим вивченням хімії 2010р. 13. www.XuMuK.ru- Всеросійський сайт хіміків. Розробка дидактичного забезпечення для вивчення теми “Алюміній” у класах з поглибленим вивченням хімії
Курсова робота: студентки 5 курсу природничого факультету Завалішиної Оксани Науковий керівник: ст.викл. Винник О.Ф. Харків 2011 Зміст Вступ РОЗДІЛ І. Літературний огляд……………………………………………………3 1.1 Вивчення Алюмінію в загальноосвітній та профільній школах………...4 1.2 Тестування як метод контролю у школах з поглибленим вивченням хімії………………………………………………………………………………..4 РОЗДІЛ ІІ. Розробка дидактичного матеріалу для вивчення теми «Алюміній»…………………………………………………………………………17 2.1 Розробка наочних посібників………………………………………………...17 2.2 План - конспект уроку на тему «Алюміній як хімічний елемент і проста речовина. Фізичні та хімічні властивості алюмінію»………………………...18 2.3 Тестові завдання на тему: «Алюміній. Добування Алюмінію»………….23 Висновки Література
Вступ Актуальність теми: Профільне навчання хімії забезпечує загальноосвітню та початкову допрофесійну підготовку випускників спеціалізованих класів які мають бажання отримати майбутню професію, пов’язану з використанням хімічних знань, виховання особистості, здатної до самоосвіти і творчої самореалізації. Для ефективного навчання досить важливим є забезпечення якість дидактичних матеріалів та коректність їх використання. Як наочні матеріали можуть бути використані: плакати, таблиці, анкети, схеми, тести, фільми, мультимедійні презентації, анімації, моделі. Об'єкт: Методика використання дидактичних матеріалів при вивченні теми “Алюміній”. Предмет: Викладання теми “Алюміній” у хіміко-технологічних класах та класах з поглибленим вивченням хімії. Зміст, форми, методи і засоби формування знань з теми “Алюміній” в шкільному курсі хімії. Мета: Розробка дидактичних матеріалів для вивчення теми "Алюміній" у хіміко-технологічних класах. Завдання: · На основі аналізу програми природничого профілю навчання визначити місце теми “Алюміній” в системі вивчення неорганічної хімії; розробити дидактичні матеріали та конспект уроку на тему “Алюміній як хімічний елемент і проста речовина. Фізичні та хімічні властивості алюмінію”; · розробити тестові завдання для контролю знань з теми «Алюміній. Виробництво Алюмінію».
|
|||||||||||
|
Последнее изменение этой страницы: 2020-12-09; просмотров: 89; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.191.13.255 (0.101 с.) |