
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Представленные ниже основные законы химии помогут вам справиться с решением задач.Содержание книги
Поиск на нашем сайте
Массовая доля химического элемента в веществе находится по отношению атомной массы химического элемента, умноженной на количество его атомов в этом соединении, к молекулярной массе вещества. Например, для определения w кислорода (оксигена) в молекуле углекислого газа СО2 вначале найдем молекулярную массу всего соединения. Она составляет 44. В молекуле содержится 2 атома кислорода. Значит w кислорода рассчитываем так: w(O) = (Ar(O) · 2) / Mr(СО2)) х 100%, w(O) = ((16 · 2) / 44) х 100% = 72,73%.
Молярная масса – это масса одного моля вещества. Моль, в свою очередь, – количество вещества, в котором содержится определенное количество мельчайших частиц, которые участвуют в химических процессах.
Вещества с постоянным составом названы дальтонидами в честь английского химика Джона Дальтона. Состав дальтонидов описывается химическими формулами с целыми стехиометрическими коэффициентами, например Н2О, НCl, СН4, СO2, С2Н5ОН. Из закона постоянства состава следует, что при образовании сложного вещества элементы простых веществ соединяются друг с другом в строго определенных массовых долях. Массовая доля элемента ωЭ показывает, какую часть составляет масса данного элемента от массы всего вещества, где n – число атомов; ArЭ – относительная атомная масса элемента; Mr – относительная молекулярная масса вещества.
Задание 1. Приведите примеры физических тел и веществ, присутствие которых в природе (воде, почве, воздухе) является загрязнением. Какой вид загрязнения является более заметным: загрязнение физическими телами (например, осколками бутылок, обрывками бумаги) или загрязнение веществами (например, метан в атмосфере или соли свинца в воде)? Согласны ли вы с тем, что более заметное загрязнение является и более вредным? Почему? Задание 2. В 2000 году человечество выбросило в атмосферу такое количество углекислого газа, что содержание углерода в нем составило примерно 6 млрд. тонн. Сколько тонн углекислого газа было выброшено в 2000 году? Задание 3. Двигатель внедорожника выбрасывает в воздух около 400 г углекислого газа на каждый километр пути. Сколько м3 СО2 выбрасывает двигатель внедорожника за один день, если среднегодовой пробег составляет 20 тыс. км? ФИЗИКА Задание 4. Почему птицы безнаказанно садятся на провода высоковольтной линии электропередачи? Задание 5. Почему на нефтебазах не наливают нефтепродукты в цистерны до самого края? Задание 6. Почему сады не рекомендуется разводить в низинах? Критерии оценки практической работы: - выполнение работы в полном объеме с соблюдением необходимой последовательности; - описание работы соответствует требованиям, изложение последовательное, логичное, грамотное; - выводы сделаны грамотно, используют химические и физические обоснования, соответствуют заявленной цели работы.
Выводы по работе (воспользуйтесь данными вопросами):
Рекомендуемая литература 1. Бизяркина Е.Н. Проблемы экологически устойчивого развития. М.: ИПР РАН, «Полиграф-центр», 2017. - С. 255 2. Игнатов В.Г., Кокин А.В. Пути обеспечения региональной экологической безопасности в сбалансированном природопользовании.//Государственное и муниципальное управление. Ученые записки СКАГС, №2, 2018. С.17-27. 3. Использование и охрана природных ресурсов в России. Бюллетень НИА "Природные ресурсы", N 9-10, 2003 г. 4. Мекуш Г.Е. Экологическая политика и устойчивое развитие. М.: МаксПресс, 2017. 5. Повестка на 21 век. Конференция ООН по охране окружающей Среды и развитию, Рио-де-Жанейро, июнь 1992 г. Извлечения. М.: Центр координации и информации Социально-экологического союза, 1997 г., 31 с. 6. Шальнев В.А. Проблемы взаимодействия общества и природы: взгляд географа. - Ставрополь: Изд-во СГУ, 2016. - 110 с.
Электронные издания:
7. www.donland.ru 8. www.avkokin.ru 9. www.Interfax-ERA.ru 10. www.viperson.ru Практическая работа №6 Тема. Сравнительное описание естественных природных систем и агроэкосистем. Цель: закрепить знания о структуре экосистем, научить составлять описание природных и искусственных экосистем, объяснять различия между ними и их значение;
|
||||
|
Последнее изменение этой страницы: 2020-11-28; просмотров: 963; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.189.182.15 (0.009 с.) |

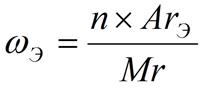 .
.


