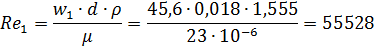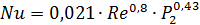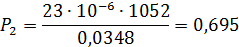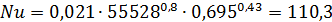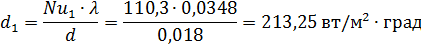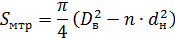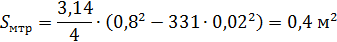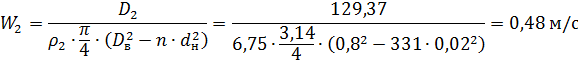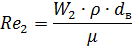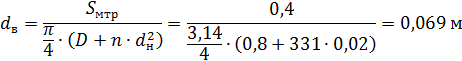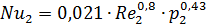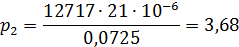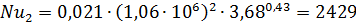Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Материальный баланс котла – утилизатораСодержание книги Поиск на нашем сайте
Расчет равновесной степени окисления NO в NO2 Процесс окисления NO протекает по уравнению реакции:
Данная реакция протекает с уменьшением числа моль, и имеет большой экзотермический эффект. Согласно правилу Ле-Шателье для повышения степени превращения и смещения равновесия в сторону продуктов эту реакцию желательно проводить при повышенных давлениях и пониженной температуре. Расчет равновесного состава газа при окислении NO в NO2 можно провести используя величину равновесной степени окисления xр, которая показывает отношение количества прореагировавшего NO к его количеству исходной смеси. Процесс окисления оксида азота (ӀӀ) кислородом (уравнение (1)) характеризуется константой равновесия, обычно выражаемой через парциальные давления компонентов:
Температура зависимость константы равновесия реакции окисления оксида азота (ӀӀ) уравнение (1) может быть вычислена с большой степенью точности по уравнению Боденштейна[4]:
где Т – температура нитрозного газа, К. Для расчета равновесной степени окисления оксида азота выразим парциальные давление газов, входящие в уравнение равновесия, через общее давление в зависимости от начальной концентрации газа. Введем обозначения: 2 a –начальная концентрация NO, моль.доли; b – начальная концентрация О2, мол.доли; x р – равновесная степень окисления NO, доли единицы; P общ – общее давление газа, МПа. Общее количество исходного газа примем за единицу. Равновесные концентрации компонентов газовой смеси, найдены согласно реакции, сведены в таблице 5 ниже. [4]. Таблица 5 – Количество исходного газа.
Тогда парциальные давления компонентов газа в момент равновесия будут равны:
Подставляя значения парциальных давлений в уравнение равновесия (2), получим:
Расчет равновесных концентраций газа по этой формуле дает правильные результаты лишь при температуре выше 200⁰С, так как при более низких температурах происходит образование оксида азота (ӀV) и оксида азота (ӀӀӀ), ведущее к уменьшению объема, не учитываемому данной формулой. Подставляя в данное уравнение значение начальных концентраций исходных компонентов, общее давление газа, а также константу равновесия и решая его относительно xр, можно определить равновесную степень превращения NO в NO2, а также равновесный состав газовой смеси при заданных условиях. [4]. Температура нитрозных газов на выходе из котла-утилизатора 250⁰С. Константа равновесия реакции окисления оксида азота (ӀӀ) при данной температуре, согласно уравнению, составляет (для давления, выраженного в МПа):
Определим равновесную степень окисления NO при t = 250⁰С и V NO(Н.Г.) = 238,19 ×22,4 = 5335,47 нм3/ч, V O2(Н.Г.) = 122,93 ×22,4 = 2753,69 нм3/ч, V N2(Н.Г.) = 1647,38 ×22,4 = 36901,51 нм3/ч, V H2O(Н.Г.) = 481,36 ×22,4 = 10782,43 нм3/ч. V (Н.Г.)= 5335,47+2842,34+36901,31+10782,47= 55773,09 нм3/ч. Таблица 6 – Состав нитрозного газа на выходе из контактного аппарата
Тогда: 2 а = 0,0957 мол.доли а = 0,04785 мол.доли b = 0,0494 мол.доли Подставляя в уравнение (4) значения a, b, P общ, K р, и решая его относительно x р, получаем значение равновесной степени окисления NO:
Из этого уравнения определяем xp = 0,95 д.е. Расчет степени окисления NO в NO2 в котле-утилизаторе Средняя температура нитрозного газа в котле-утилизаторе:
Секундный расход газа в рабочих условиях:
где 55773,09 – расход нитрозного газа на входе в котел-утилизатор, нм3/ч; 564,5 – средняя температура нитрозного газа в котле-утилизаторе, 0,716 – рабочее давление нитрозного газа в котле-утилизаторе, МПа. Время пребывания газа в окислительном объеме котла-утилизатора: t = где Vсв(24,00) – свободный объем котла-утилизатора, м3. Как было установлено Боденштейном, окисление оксида азота протекает по уравнению третьего порядка. Дифференциальное уравнение скорости окисления оксида азота кислородом имеет следующий вид:
где k1, k2 – константы скорости прямой и обратной реакции, МПа-2×с-1; РNO, РO2, РNO2 – парциальные давления компонентов, МПа. Когда окисление оксида азота протекает практически необратимо. диссоциация диоксида азота можно пренебречь. В этом случае уравнение скорости окисления оксида азота примет следующий вид:
Обозначим 2а – начальная концентрация NO, мол.доли; b – начальная концентрация O2, мол.доли; Отсюда получим:
После подстановки этих значений в уравнение (6) оно примет следующий вид:
Приняв 2k1 = k, имеем:
После интегрирования получим:
Обозначая через
где k – константа скорости реакции окисления NO в NO2, МПа-2×с-1; a – половина начальной концентрации NO, мол.доли; Pобщ – общее давление в системе, МПа; t – время пребывания газа в окислительном объеме, с; a – степень окисления NO в NO2, д.е.; g = b/a; b – начальная концентрация O2, мол.доли. Значения констант скорости реакции окисления NO в NO2 k представлены в таблице 7. Выше 300⁰С константа скорости стремиться к постоянному значению. Таблица 7 – Константы скорости окисления NO в NO2 кислородом при различных температурах.
Расчет степени окисления NO в NO2 в котле-утилизаторе. Константа скорости реакции окисления NO в NO2 k при средней температуре газа в котле-утилизаторе, равной 564,5°С, составляет 205,47 МПа-2×с-1. Подставляя значения k(МПа-2×с-1), а = 0,04785 мол.доли, P(МПа), t(с), b = 0,0544 мол.доли, g = b/a = 0,0544/0,04785 = 1,14 д.е. в уравнении, получаем:
Из этого уравнения определяем a = 0,42 д.е. Степень приближения к равновесию реакции составляет:
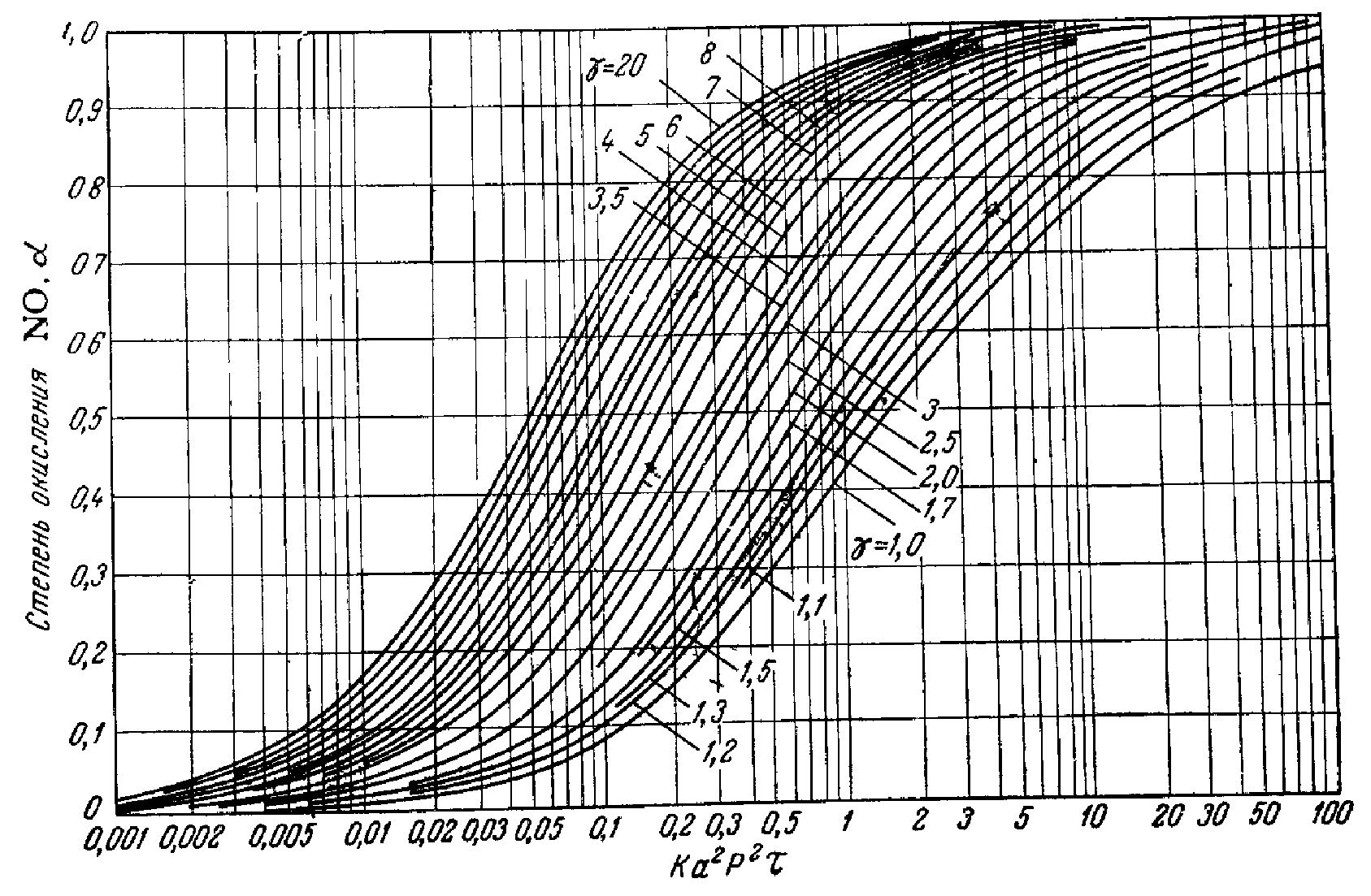
Определение степени окисления NO в NO2 кислородом с использованием номограммы Каржавина
Рисунок 2 – Номограмма Каржавина.
По рисунку определяем, что a» 42 д.е. По реакции окисляется NO: 7712,83 × 0,42 = 3239,38 кг/ч. Остается NO: 7712,83 – 3239,38 = 4473,45 кг/ч 4473,45 /30 = 149,12 кмоль/ч 149,12 ×22,4 = 3340,29 нм3/ч где 30 – молярная масса NO г/моль. В результате окисления NO по реакции образуется NO2: 3239,38 ×2×46/2/30 = 4967,05 кг/ч. 4967,05 /46 = 107,97 кмоль/ч 107,97 ×22,4 = 2418,53 нм3/ч, где 46 – молярная масса NO2 г/моль. По реакции расходуется кислорода: 3239,38 ×32/2/30 = 1727,67 кг/ч. Остается кислорода: 4246,04 – 1727,67 = 2518,37 кг/ч; 2518,37 /32 = 78,70 кмоль/ч; 78,70 ×22,4 = 1762,88 нм3/ч, где 32 – молярная масса O2, г/моль. Тогда расход газа на выходе из котла-утилизатора составит: 3340,29 +2418,53 +1762,88 +39830,17+11638,16= 58990,03 нм3/ч, 4473,45+2518,37+49787,71+9352,09+4967,05= 71098,67кг/ч Таблица 8 – Состав нитрозного газа на выходе из котла-утилизатора
Таблица 9 – Материальный баланс процесса окисления NO кислородом в котле-утилизаторе.
Тепловой баланс Приход тепла Тепло, вносимое нитрозными газами в котел-утилизатор:
где Теплоемкость компонентов нитрозного газа на входе в котел-утилизатор при температуре 897⁰С
Тепло, выделяющееся в котле-утилизаторе при окислении NO до NО2 кислородом:
где Изменение стандартной энтальпии при образовании вещества
где 3340,29 и 2418,53 – количество NO и NО2 в нитрозном газе, выходящем из котла-утилизатора, кмоль/ч; 5758,91 – количество NO в нитрозном газе, поступающем в котел-утилизатор, кмоль/ч.
Тепло, вносимое питательной водой в межтрубное пространство котла-утилизатора:
где
где Х – масса питательной воды, переходящий в пар, кг/ч. Общий приход тепла в аппарат составит:
Расход тепла Тепло, уносимое нитрозными газами из котла-утилизатора:
где Теплоемкости компонентов нитрозного газа на выходе из котла-утилизатора при температуре 250⁰С
Тепло, уносимое перегретым паром пароперегревателя:
где i Энтальпия перегретого пара при температуре 250⁰С и давлении 1,5 МПа составляет 2921 кДж/кг:
где Х – масса образующегося перегретого пара, кг/ч. Примем, что теплопотери в котле-утилизаторе равны 3%, тогда общий расход тепла составит:
В общем виде уравнение теплового баланса котла-утилизатора может быть записано в виде:
где Тогда, питательной водой в межтрубное пространство котла-утилизатора вносится тепла:
Перегретым паром из межтрубного пространства котла-утилизатора уносится тепла:
Теплопотери составляют:
Результаты теплового расчета заносим в таблицу.
4 Кинетический расчет[СВЛ3] Основное уравнение теплообмена:
отсюда:
где Q – количество тепла, передаваемого от более нагретого тепла к более холодному. F – поверхность теплообмена; k – коэффициент теплопередачи; ∆tср – движущая сила теплопередачи. 1.Определение движущей силы теплопередачи:
879°→250° 250°←130° ∆tб=629° ∆tм=120°
Средняя разность температур определяется по формуле:
Чтобы найти
Поэтому: 2.Определим количество труб в теплообменнике: Допустим, что Re=60000, а трубы
Где n – число труб в теплообменнике; d – диаметр трубы в см; μ – динамическая вязкость азота.
По справочнику:
3.Находим скорость азота w, при количестве труб n =331 шт.
Где: Sтр – площадь поперечного сечения трубного пространства в м2
Уточняем значение измерения Re для азота:
4.Определяем критерии Нуссельта при Re:
5.Определим коэффициент теплоотдачи для азота:
6.Находим площадь поперечного сечения межтрубного пространства:
Где: Dв – внутренний диаметр корпуса теплообменника, принимаем его 0,8м; dн – диаметр трубки 0,02м.
7.Оределим скорость конденсата в межтрубном пространстве:
8.Определим критерий Рейнольдса для межтрубного пространства:
9.Определим критерии Нуссельта для межтрубного пространства:
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2020-11-28; просмотров: 928; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.21.244.240 (0.011 с.) |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

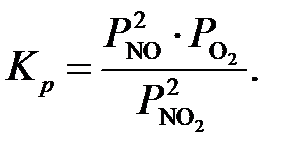
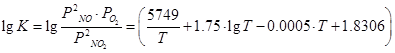
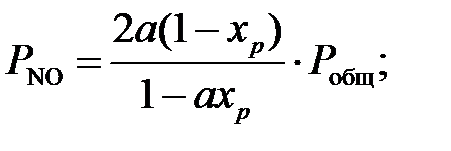
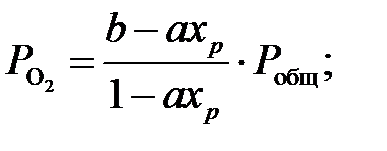
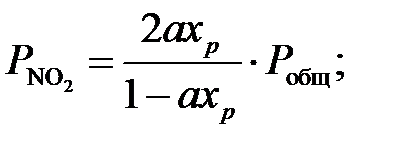
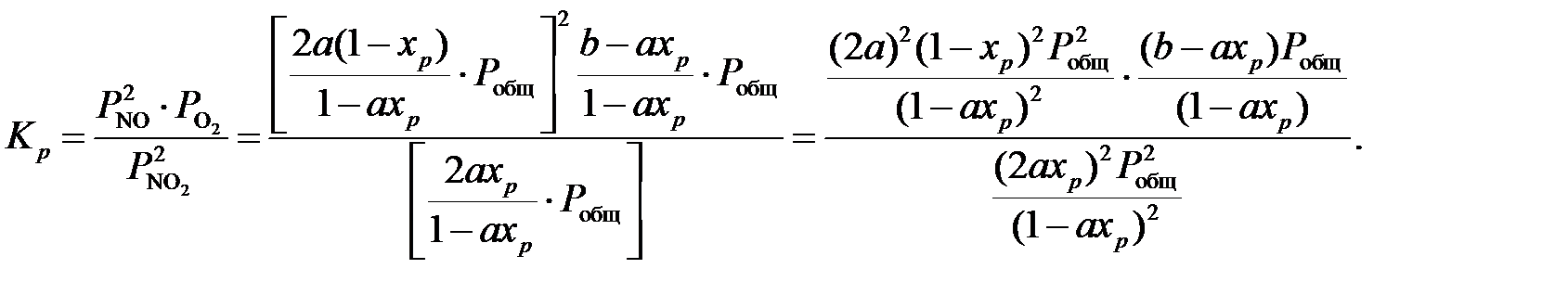
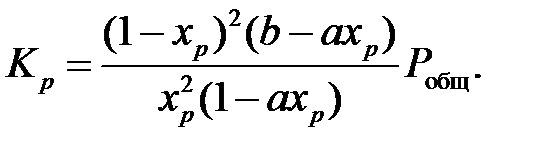
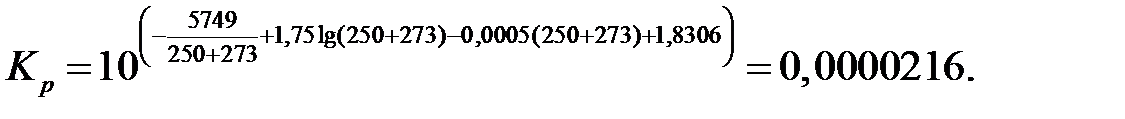
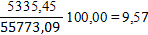
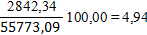
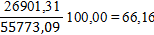
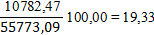
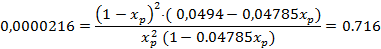
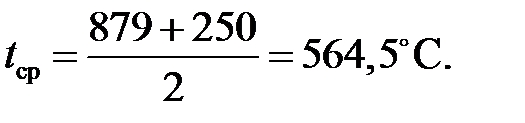
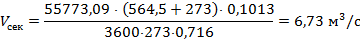
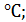
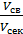 =
= 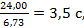
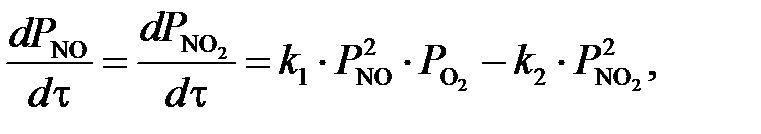
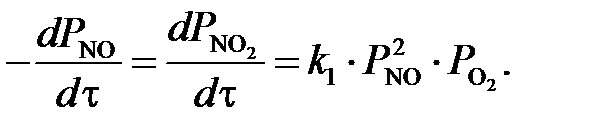
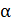 – степень окисления NO, д.е.; Робщ – общее давление газа, МПа. [4].
– степень окисления NO, д.е.; Робщ – общее давление газа, МПа. [4].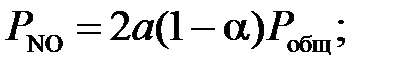
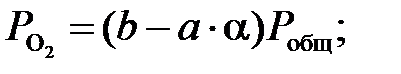
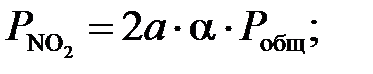
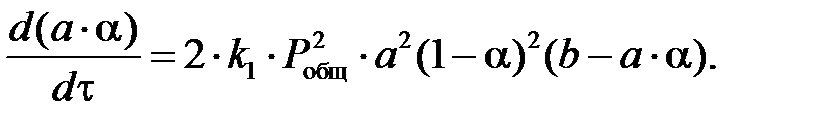
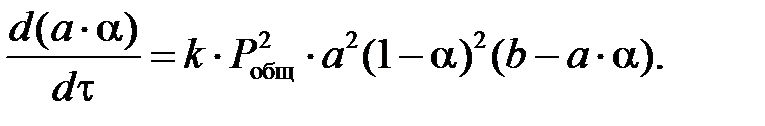
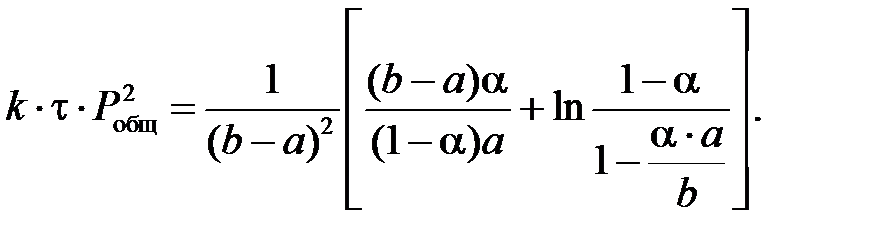
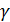 отношение концентрации кислорода к половине концентрации оксида азота (g = b/a) и подставляя в уравнение () значение
отношение концентрации кислорода к половине концентрации оксида азота (g = b/a) и подставляя в уравнение () значение 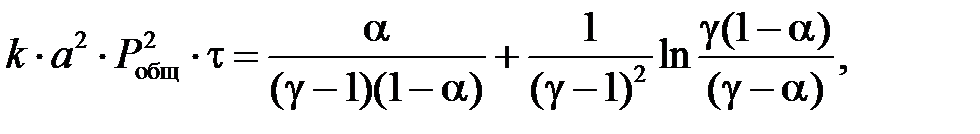
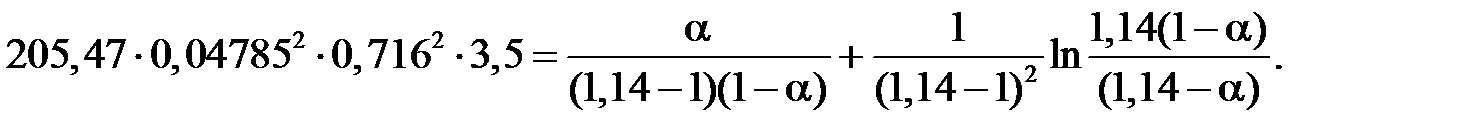
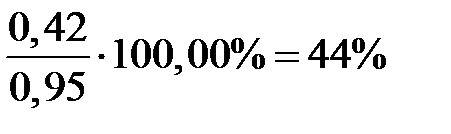
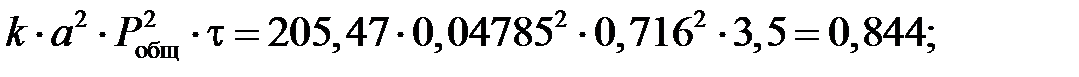
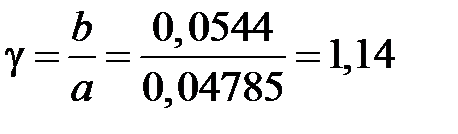
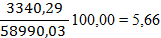
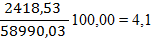
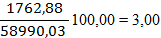
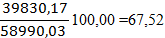
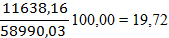
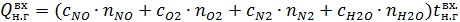 ,
,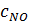 ,
, 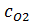 ,
, 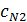 ,
, 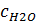 и
и 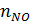 ,
, 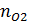 ,
, 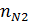 ,
, 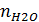 – теплоемкости (Дж/(моль
– теплоемкости (Дж/(моль  К)) и количества (кмоль/ч) NO, O2, N2 и H2O на выходе в котел-утилизатор соответственно;
К)) и количества (кмоль/ч) NO, O2, N2 и H2O на выходе в котел-утилизатор соответственно; 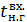 – температура нитрозного газа на входе в котел-утилизатор, ⁰С.
– температура нитрозного газа на входе в котел-утилизатор, ⁰С.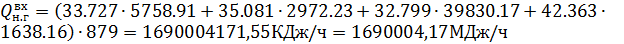 .
.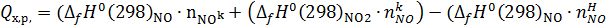 )
) 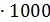 ,
,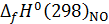 и
и 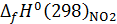 – изменение стандартной энтальпии при образовании NO и NО2, кДж/моль; nн, nk – начальные и конечные количества вещества, кмоль/ч.
– изменение стандартной энтальпии при образовании NO и NО2, кДж/моль; nн, nk – начальные и конечные количества вещества, кмоль/ч.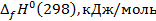
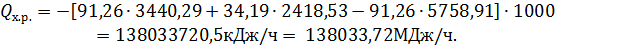
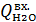 =i
=i 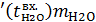 ,
,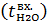 – энтальпия питательной воды, кДж/кг;
– энтальпия питательной воды, кДж/кг; 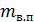 – масса питательной воды кг/ч;
– масса питательной воды кг/ч;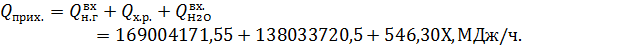
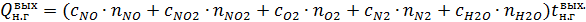 ,
,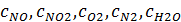 и
и 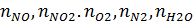 – теплоемкости (Дж/(моль
– теплоемкости (Дж/(моль 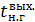 – температура нитрозного газа на выходе из котла-утилизатора, ⁰С.
– температура нитрозного газа на выходе из котла-утилизатора, ⁰С.
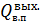 =i
=i  ,
,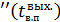 –- энтальпия водяного пара, кДж/кг;
–- энтальпия водяного пара, кДж/кг; 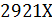 ,
,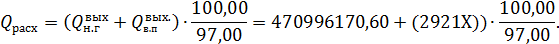
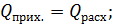
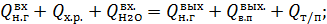
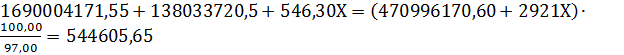 .
.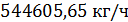 – перегретого пара образовалось в котле-утилизаторе и пароперегревателе.
– перегретого пара образовалось в котле-утилизаторе и пароперегревателе.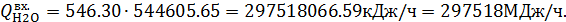
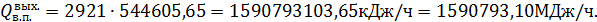
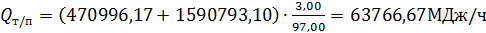 .
.
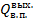
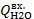
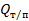
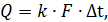
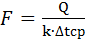 ,
,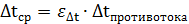
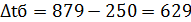
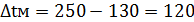
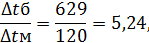
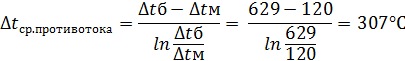
 определяем P и R:
определяем P и R: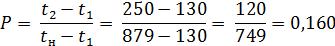
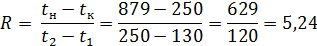
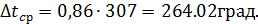
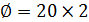 мм,
мм,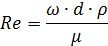
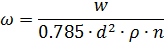
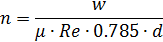
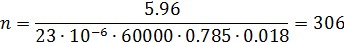
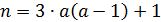
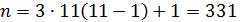 шт.
шт.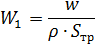
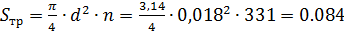 м2
м2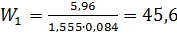 м/с.
м/с.