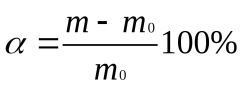Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Опыт 1. Определение изоэлектрической точки желатина.Содержание книги
Поиск на нашем сайте
Влияние pH среды на набухание желатина определяют следующим образом:
Таблица 13.1
вычисляют по формуле:a - степень набухания
где m – масса набухшего желатина, m0– масса сухого желатина.
Опыт 2. Влияние электролитов на степень набухания желатина.
Влияние кислоты, щелочи и солей на набухание определяют следующим образом: 1. В 7 калиброванных пробирок вносят одинаковое количество желатина по высоте пробирки (примерно 1 мл). 2. В каждую пробирку наливают по 5 мл указанных в таблице растворов. 3. Содержимое пробирок перемешивают стеклянной палочкой, чтобы частицы желатина опустились на дно. Определяют высоту осадка желатина до набухания. 4. Пробирки оставляют в штативе на 30 минут. 5. По истечении этого времени каждую пробирку еще раз встряхивают, дают осадку осесть и измеряют высоту набухшего осадка желатина. Результаты записываете в таблицу:
Таблица 13.2
На основании полученных данных делают вывод: 1. о влиянии кислоты, щелочи и солей на процесс набухания 2. о влиянии природы анионов на процесс набухания. Контрольные вопросы:
1.Что называется изоэлектрической точкой? 2.В каком из растворителей: воде, спирте, толуоле, физиологическом растворе – желатин будет набухать, а в каком – нет? Почему? 3.Что такое набухание ВМС и что называется степенью набухания? 4.Чем обусловлено направление движения частиц под действием электрического поля? 5.К какому электроду будет перемещаться при электрофорезе β – лактоглобулин в растворе с рН равном 7, если его изоэлектрическая точка равна 5,2. Почему? 6.В растворе содержится смесь белков: α – глобулин крови, фибриноген крови и рибонуклеаза. При каком значении рН можно электрофоретически разделить эти белки? Список литературы 1. Физическая химия: Учебник для хим. спец. вузов / Под редакцией А.Г. Стромберга. – М.: Высшая школа, 2001. – 527с. 2. Гельфман М.И., Ковалевич О.В., Юстратов В.П. Коллоидная химия. – СПб.: Изд-во «Лань», 2003. – 336 с. 3. Хмельницкий Р.А. Физическая и коллоидная химия. – М.: Высшая школа, 1988. – 400 с. 4. Болдырев А.И. Физическая и коллоидная химия. – М.: Высшая школа, 1983. – 408 с. 5. Зимон А.Д., Лещенко Н.Ф. Коллоидная химия: Учебник для вузов. – М.: ВЛАДМО, 1999. – 320 с. 6. Заплишный В.Н. Физическая и коллоидная химия. – Краснодар: ГУП «Печатный двор Кубани», 2001. – 344 с.
ПРИЛОЖЕНИЕ Стандартные энтальпии образования D Н ° 298, энтропии S º298 и энергии Гиббса образования Δ G ° 298 некоторых веществ
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2020-11-28; просмотров: 615; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.116.118.214 (0.007 с.) |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||