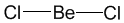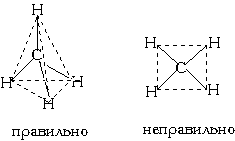Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Тема урока: Формы молекул в пространстве.
Цель урока: Рассмотреть формы молекул в пространстве. План. Пространственная форма молекул. Содержание темы. Формулы Льюиса многое говорят об электронном строении и устойчивости молекул, но пока ничего не могут сказать об их пространственном строении. В теории химической связи существуют два хороших подхода к объяснению и предсказанию геометрии молекул. Они хорошо согласуются между собой. Первый подход называется теорией отталкивания валентных электронных пар (ОВЭП). Несмотря на “страшное” название, суть этого подхода очень проста и понятна: Химические связи и неподеленные электронные пары в молекулах стремятся расположиться как можно дальше друг от друга. Поясним на конкретных примерах. В молекуле BeCl2 есть две связи Be—Cl. Форма этой молекулы должна быть такой, чтобы обе эти связи и атомы хлора на их концах располагались как можно дальше друг от друга:
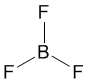
Это возможно только при линейной форме молекулы, когда угол между связями (угол ClBeCl) равен 180о. Другой пример: в молекуле BF3 имеется 3 связи B—F. Они располагаются как можно дальше друг от друга и молекула имеет форму плоского треугольника, где все углы между связями (углы FBF) равны 120о :
Еще один пример: в молекуле CH4 имеется 4 связи C—H. Все эти 4 связи расположатся максимально далеко друг от друга только тогда, когда молекула примет форму тетраэдра, у которого в центре находится атом C, а в вершинах - атомы H. Кстати, в "квадратной" молекуле расстояние между атомами водорода было бы меньше, поэтому реальная молекула CH4 имеет форму тетраэдра:
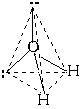
В молекуле CH4 угол НСН такой же, как в математическом тетраэдре: 109о28’. Последний пример: молекула H2O в своем составе имеет две связи O—H и две неподеленные пары электронов. Вывод: эта молекула также должна иметь форму, похожую на тетраэдр.
Реально этот тетраэдр слегка искажен, потому что неподеленные пары отталкиваются между собой несколько сильнее, чем от поделенных пар, и чем поделенные пары отталкиваются друг от друга. Поэтому реальный угол HOH составляет не 109о, а немногим менее 105о. Однако по центрам атомов, как можно видеть, молекула воды имеет угловую форму. Если ввести обозначения: н.п - неподеленная пара, п.п - поделенная пара, то относительное отталкивание между ними дает такой ряд:
(н.п/н.п) > (н.п/п.п) > (п.п/п.п). Теория отталкивания валентных электронных пар (ОВЭП) проста и наглядна. Она опирается на классическую геометрию и позволяет правильно предсказывать форму молекул.
Список литературы
1. Габриелян О.С. Химия. Методическое пособие. 10-11 классы. М.: «Дрофа», 2005г. 2. Еремин В.В., Кузьменко Н.Е., Тренин В.И., химия. 10 класс: учебник для общеобразовательных учреждений(базовый уровень). – М.: Дрофа, 2009г. 3. Еремин В.В., Кузьменко Н.Е.,Дроздов А.А., химия. 11 класс: учебник для общеобразовательных учреждений базовый уровень). – М.: Дрофа, 2009г. 4. Рудзитис Г.Е., Фельдман Ф.Г, химия. 10 класс: учебник для общеобразовательных учреждений (базовый уровень). – М.: Просвещение, 2005 5. Рудзитис Г.Е., Фельдман Ф.Г, химия. 11 класс: учебник для общеобразовательных учреждений (базовый уровень). – М.: Просвещение, 2005 Перечень цифровых образовательных ресурсов и Web-сайтов Интернет 1. http://school-collection.edu.ru/. - единая коллекция цифровых образовательных ресурсов:
|
|||||
|
Последнее изменение этой страницы: 2020-11-22; просмотров: 119; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.138.102.178 (0.007 с.) |