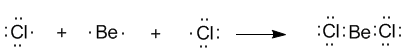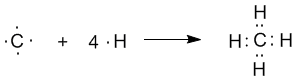Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Перечень Web-сайтов,рекомендуемых для использования в работе: ⇐ ПредыдущаяСтр 3 из 3
1. http//www.chem.msu.su/rus/school/ - сайт журнала «Химия: методика преподавания в школе» 2. http://www.chem.msu.su/rus/school/ - школьные учебники по химии для 8-11 классов общеобразовательной школы 3. http://c-books.narod/ru- литература по химии 4. http://experiment.edu.ru/catalog.asp- естественнонаучные эксперименты 5. chem.msu.su –портал фундаментального химического образования России 6.alhimik.ru – образовательный сайт по химии
Д.З. Изучите конспект и ответьте на вопросы: Какие формы могут иметь молекулы в пространстве? Уважаемый студент сфотографируйте конспект и пришлите на электронный адрес ( dima.levchenko02@ramler.ru)
Группа№23, химия,урок№98. Тема программы: Стоение вещества. Тема урока: Гибридизация атомных орбиталей sp, sp 2, sp 3. Цель урока: Рассмотреть гибридизацию атомных орбиталей sp, sp 2, sp 3. План. ГИБРИДИЗАЦИЯ (то есть “смешивание”) атомных орбиталей. Отличие sp, sp 2, sp 3. Содержание темы. Образование одинаковых связей из атомных орбиталей разного вида потребовало введения такого понятия, как ГИБРИДИЗАЦИЯ (то есть “смешивание”) атомных орбиталей. Почему это понятие стало необходимо? Вернемся к уже знакомой нам молекуле BeCl2. Ее образование вполне понятно из электронного строения атомов бериллия и хлора, которое изображается формулами Льюиса:
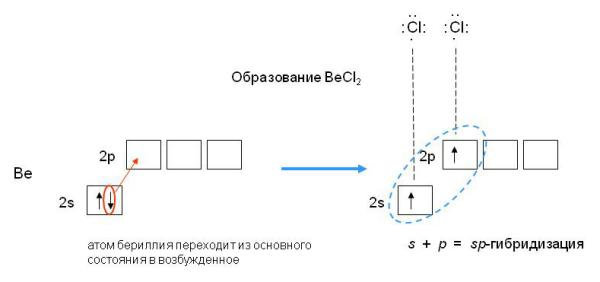
Электронная конфигурация валентной оболочки бериллия 2s2. Для реакции с двумя атомами хлора необходим переход электронов бериллия в возбужденное состояние:
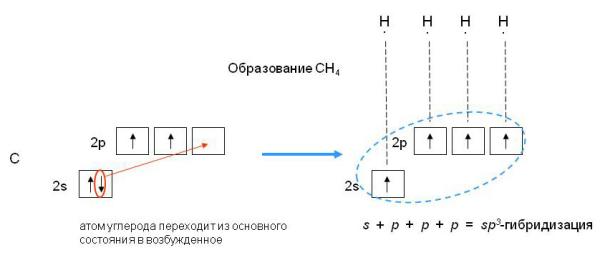
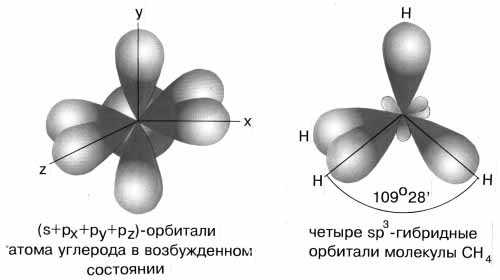
Если бы один атом хлора связывался с бериллием за счет 2s-электрона бериллия, а другой - за счет 2p-электрона бериллия, то связи Be—Cl не были бы равноценными. Однако на самом деле обе связи имеют одинаковую длину, прочность и расположены под углом 180о. Чтобы объяснить равноценность связей Be—Cl, говорят о sp-гибридизации валентных атомных орбиталей бериллия, при которой одна s-орбиталь и одна p-орбиталь (они обведены овалом на орбитальной диаграмме) как бы смешиваются и выравниваются по форме и энергии, давая две од Рис.3-8. sp2-гибридизация валентных орбиталей бора в соединении BF3. Три sp2-гибридные орбитали бора лежат в одной плоскости под углом 120o. Наконец, когда смешиваются одна s- и три p-орбитали, возникают sp3-гибридизованные молекулы, имеющие геометрию тетраэдра Примером может служить молекула метана СН4.
Рис. 3-9. sp3-гибридизация валентных орбиталей углерода. Четыре sp3-гибридные орбитали углерода направлены в вершины правильного тетраэдра. Атом углерода находится в центре тетраэдра. Углы между всеми связями равны и составляют 109°28'. Существует важное правило:
|
|||||
|
Последнее изменение этой страницы: 2020-11-22; просмотров: 78; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.118.26.90 (0.007 с.) |