Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Реакции с применением меченных ат и Аг
Реакции с использованием меченных антител и антигенов составляют основу методов экспресс-диагностики инфекционных заболеваний, так как выявляют минимальное содержание Аг и АТ в исследуемых образцах. В качестве меток могут быть использованы различные ферменты, красители флюорохромы и изотопы.
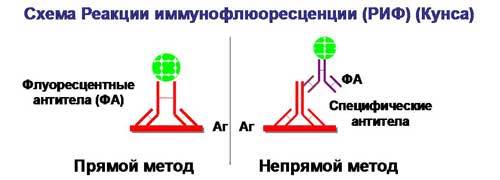
Реакция иммунофлюоресценции (РИФ) Данный метод является экспрессным и высокочувствительным. Существуют две его разновидности. При прямом методе к исследуемой взвеси микробов, фиксированной на стекле, добавляют сыворотку, меченную флуорохромом. Образующийся комплекс антиген-антитело при освещении ультрафиолетовыми (сине-фиолетовыми) лучами дает ярко-зеленое свечение. При непрямом РИФ используют обычные диагностические сыворотки против какого-либо вида микробов. Добавление этой сыворотки к испытуемой взвеси микробов вызывает образование комплекса антиген-антитело. Этот комплекс выявляется с помощью универсальной флюоресцирующей сыворотки, содержащей антитела к гаммаглобулиновой фракции крови того вида животного, от которого была получена диагностическая сыворотка. Светящийся комплекс выявляют при люминесцентной микроскопии.
Рис. 7. Реакция иммунофлюоресценции (схема).
Рис. 4. Пневмококки, выявленные РИФ (люминесцентная микроскопия).
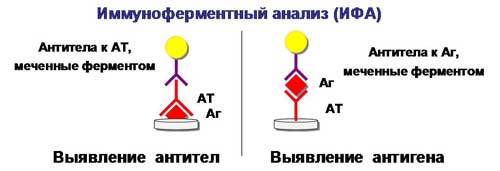
Иммуноферментный анализ (ИФА) В основе иммуноферментного анализа лежит известная иммунная реакция антигена и антитела. Один из этих реагентов является определяемым веществом, а другой - узнающим, обладающим известной стандартной специфичностью (избирательностью) по отношению к определяемому веществу. Для выявления образовавшихся иммунных комплексов (антиген-антитело) используется фермен т, которым предварительно метится узнающий компонент (антиген или антитело). Сам фермент, естественно, не виден, поэтому визуализация присутствия вещества, определяемого методом ИФА, достигается применением посредника - хромогена. Это особое химическое соединение, которое хорошо растворимо в воде, и раствор которого бесцветен. Превращение бесцветного хромогена в цветное вещество хромофор происходит под действием фермента, для которого хромоген является субстратом.
Рис. 8. Иммуноферментный анализ (схема).
Рис. 5. Иммуноферментный анализ (ИФА) (схема).
Рис. 6. Результат ИФА. Желтый цвет раствора в лунке является положительным результатом.
30) Иммунный статус – это структурное и функциональное состояние иммунной системы индивидуума, определяемое комплексом клинических и лабораторных иммунологических показателей. Таким образом, иммунный статус характеризует анатомо-функциональное состояние иммунной системы, т.е. ее способность к иммунному ответу на определенный антиген в данный момент времени. Наличие у человека иммунной системы автоматически подразумевает его способность к иммунному ответу, но сила и форма иммунного ответа на один и тот же антиген у разных людей могут варьировать в широких пределах. Поступление антигена в организм у одного человека вызывает преимущественно антителообразование, у другого – развитие гиперчувствительности, у третьего – в основном формирование иммунологической толерантности, и т.д. Иммунный ответ на один и тот же антиген у разных лиц может варьировать не только по форме, но и по силе, т.е. по степени выраженности, например, по уровню антител, устойчивости к инфекции и др. По иммунореактивности различаются не только отдельные индивидуумы, но у одного и того же человека иммунореактивность может колебаться в различные периоды его жизни. Так, иммунный статус взрослого и ребенка, особенно новорожденного или первого года жизни, когда иммунная система еще функционально незрелая, существенно различается. У детей легче индуцировать иммунологическую толерантность, у них ниже титры сывороточных антител при иммунизации. Иммунный статус молодого и пожилого человека тоже различен. Это частично связано с состоянием тимуса, который рассматривается как «биологические часы» иммунной системы. Возрастная инволюция тимуса ведет к медленному угасанию Т-клеточных реакций по мере старения, снижению способности к распознаванию «своего» и «чужого», поэтому в старости, в частности, выше частота злокачественных новообразований. С возрастом нарастает также частота обнаружения аутоантител, в связи с чем старение иногда рассматривается как хронически текущая аутоагрессия.
Иммунный статус подвержен не только возрастным, но и суточным колебаниям в зависимости от биоритма. Эти колебания обусловлены изменениями гормонального фона и другими причинами. Таким образом, при оценке иммунного статуса следует учитывать значительную вариабельность иммунологических показателей даже в норме. Иммунная система филогенетически относится к числу молодых (наряду с нервной и эндокринной) и очень лабильных к различным внешним воздействиям. Практически любое, даже самое незначительное, внешнее воздействие на организм человека ведет к изменению состояния его иммунной системы. На иммунный статус оказывают влияние следующие факторы: · Климато-географические · Социальные · Экологические (физические, химические, биологические) · «Медицинские» (влияние лекарственных веществ, оперативные вмешательства, стресс и т.д.) Среди климато-географических факторов на иммунный статус оказывают влияние температура, влажность, солнечная радиация, длина светового дня и др. Например, фагоцитарная реакция и кожные аллергические пробы менее выражены у жителей северных регионов, чем у южан. Вирус Эпштейна-Барр у людей белой расы вызывает инфекционное заболевание – мононуклеоз, у лиц негроидной расы – онкопатологию (лимфома Беркитта), а у лиц желтой расы – совсем другую онкопатологию (назофарингеальная карцинома), причем только у мужчин. Жители Африки менее подвержены заболеванию дифтерией, чем европейское население. К социальным факторам, оказывающим влияние на иммунный статус, относятся питание, жилищно-бытовые условия, профессиональные вредности и т.п. Важное значение имеет сбалансированное и рациональное питание, поскольку с пищей в организм поступают вещества, необходимые для синтеза иммуноглобулинов, для построения иммунокомпетентных клеток и их функционирования. Особенно важно, чтобы в рационе присутствовали незаменимые аминокислоты и витамины, особенно А и С. Значительное влияние на иммунный статус организма оказывают жилищно-бытовые условия. Проживание в плохих жилищных условиях ведет к снижению общей физиологической реактивности, соответственно иммунореактивности, что нередко сопровождается повышением уровня инфекционной заболеваемости. Большое влияние на иммунный статус оказывают профессиональные вредности, поскольку человек проводит на работе значительную часть своей жизни. К производственным факторам, которые могут оказывать неблагоприятное воздействие на организм и снижают иммунореактивность, относят ионизирующую радиацию, химические вещества, микробы и продукты их жизнедеятельности, температуру, шум, вибрацию и т.д. Источники радиации получили в настоящее время очень широкое распространение в различных отраслях промышленности (энергетика, горно-химическая, аэрокосмическая и др.). Неблагоприятное влияние на иммунный статус оказывают соли тяжелых металлов, ароматические, алкилирующие соединения и другие химические вещества, в том числе моющие средства, дезинфектанты, пестициды, ядохимикаты, широко применяемые в практике. Таким профессиональным вредностям подвержены работники химических, нефтехимических, металлургических производств и др.
Неблагоприятное влияние на иммунный статус организма оказывают микробы и продукты их жизнедеятельности (чаще всего белки и их комплексы) у работников биотехнологических производств, связанных с производством антибиотиков, вакцин, ферментов, гормонов, кормового белка и др. Такие факторы, как низкая или высокая температура, шум, вибрация, недостаточная освещенность, могут снижать иммунореактивность, оказывая опосредованное действие на иммунную систему через нервную и эндокринную системы, которые находятся в тесной взаимосвязи с иммунной системой. Глобальное действие на иммунный статус человека оказывают экологические факторы, в первую очередь, загрязнение окружающей среды радиоактивными веществами (отработанным топливом из ядерных реакторов, утечка радионуклидов из реакторов при авариях), широкое применение пестицидов в сельском хозяйстве, выбросами химических предприятий и автотранспорта, биотехнологических производств. На иммунный статус оказывают влияние различные диагностические и лечебные медицинские манипуляции, лекарственная терапия, стресс. Необоснованное и частое применение рентгенографии, радиоизотопного сканирования может влиять на иммунную систему. Иммунореактивность изменяется после травм и хирургических операций. Многие лекарственные препараты, в том числе антибиотики, способны оказывать побочное иммунодепрессивное действие, особенно при длительном приеме. Стресс приводит к нарушениям в работе Т-системы иммунитета, действуя, в первую очередь, через ЦНС, Несмотря на вариабельность иммунологических показателей в норме, иммунный статус можно определить путем постановки комплекса лабораторных тестов, включающих оценку состояния факторов неспецифической резистентности, гуморального (В-система) и клеточного (Т-система) иммунитета. Оценка иммунного статуса проводится в клинике при трансплантации органов и тканей, аутоиммунных заболеваниях, аллергиях, для выявления иммунологической недостаточности при различных инфекционных и соматических заболеваниях, для контроля эффективности лечения болезней, связанных с нарушениями иммунной системы. В зависимости от возможностей лаборатории оценка иммунного статуса чаще всего базируется на определении комплекса следующих показателей:
1. общего клинического обследования 2. состояния факторов естественной резистентности 3. гуморального иммунитета 4. клеточного иммунитета 5. дополнительных тестов.
При общем клиническом обследовании учитывают жалобы пациента, анамнез, клинические симптомы, результаты общего анализа крови (включая абсолютное число лимфоцитов), данные биохимического исследования. Знакомство врача с пациентом начинается, как правило, с ознакомления с его паспортными данными (возраст) и предъявляемыми жалобами. Уже на этом этапе врач может узнать о профессии и стаже работы пациента (наличие профессиональных вредностей). Из высказываемых жалоб следует обратить внимание на рецидивирующую оппортунистическую инфекцию, аллергию. При сборе анамнеза важно выяснить, какие заболевания перенес пациент в детстве, особенно вирусные и паразитарные, часто оставляющие после себя иммунодефициты. Учитывают наличие наследственных заболеваний, аллергий, злокачественных новообразований. Полезно также расспросить пациента о перенесенных травмах и операциях, о наличии хронических соматических заболеваний и тех лекарственных препаратах, которые он принимает. При осмотре и пальпации больного обращают внимание на чистоту кожных покровов, состояние центральных (тимус) и периферических (лимфатические узлы, селезенка) органов иммунной системы (размер, спаянность с окружающими тканями, болезненность). Учитывается общий анализ крови, который дает представление о состоянии иммунокомпетентных клеток (абсолютное число лимфоцитов, фагоцитов). Приоценке состояния факторов естественной резистентности определяют фагоцитоз, комплемент, интерфероновый статус, колонизационную резистентность. Функциональную активность фагоцитов определяют по их подвижности, адгезии, поглощению, дегрануляции клеток, внутриклеточному киллингу и расщеплению захваченных частиц, образованию активных форм кислорода. С этой целью используют такие тесты, как определение фагоцитарного индекса, НСТ-тест (нитросиний тетразолий), хемилюминесценцию и др. Состояние системы комплемента определяют в реакции гемолиза(результат учитывают по 50%-му гемолизу). Интерфероновый статус выявляют путем титрования на культуре клеток уровня интерферона в сыворотке крови. Колонизационную резистентность определяют по степени дисбиоза различных биотопов организма (чаще всего толстой кишки).
31-32) Оценка иммунного статуса проводится в клинике при трансплантации органов и тканей, аутоиммунных заболеваниях, аллергиях, для выявления иммунологической недостаточности при различных инфекционных и соматических заболеваниях, для контроля эффективности лечения болезней, связанных с нарушениями иммунной системы. В зависимости от возможностей лаборатории оценка иммунного статуса чаще всего базируется на определении комплекса следующих показателей: 1. общего клинического обследования
2. состояния факторов естественной резистентности 3. гуморального иммунитета 4. клеточного иммунитета 5. дополнительных тестов.
При общем клиническом обследовании учитывают жалобы пациента, анамнез, клинические симптомы, результаты общего анализа крови (включая абсолютное число лимфоцитов), данные биохимического исследования. Знакомство врача с пациентом начинается, как правило, с ознакомления с его паспортными данными (возраст) и предъявляемыми жалобами. Уже на этом этапе врач может узнать о профессии и стаже работы пациента (наличие профессиональных вредностей). Из высказываемых жалоб следует обратить внимание на рецидивирующую оппортунистическую инфекцию, аллергию. При сборе анамнеза важно выяснить, какие заболевания перенес пациент в детстве, особенно вирусные и паразитарные, часто оставляющие после себя иммунодефициты. Учитывают наличие наследственных заболеваний, аллергий, злокачественных новообразований. Полезно также расспросить пациента о перенесенных травмах и операциях, о наличии хронических соматических заболеваний и тех лекарственных препаратах, которые он принимает. При осмотре и пальпации больного обращают внимание на чистоту кожных покровов, состояние центральных (тимус) и периферических (лимфатические узлы, селезенка) органов иммунной системы (размер, спаянность с окружающими тканями, болезненность). Учитывается общий анализ крови, который дает представление о состоянии иммунокомпетентных клеток (абсолютное число лимфоцитов, фагоцитов). Приоценке состояния факторов естественной резистентности определяют фагоцитоз, комплемент, интерфероновый статус, колонизационную резистентность. Функциональную активность фагоцитов определяют по их подвижности, адгезии, поглощению, дегрануляции клеток, внутриклеточному киллингу и расщеплению захваченных частиц, образованию активных форм кислорода. С этой целью используют такие тесты, как определение фагоцитарного индекса, НСТ-тест (нитросиний тетразолий), хемилюминесценцию и др. Состояние системы комплемента определяют в реакции гемолиза(результат учитывают по 50%-му гемолизу). Интерфероновый статус выявляют путем титрования на культуре клеток уровня интерферона в сыворотке крови. Колонизационную резистентность определяют по степени дисбиоза различных биотопов организма (чаще всего толстой кишки). Гуморальный иммунитет определяют по уровню иммуноглобулинов классов G, M, A, D, E в сыворотке крови, количеству специфических антител, катаболизму иммуноглобулинов, гиперчувствительности немедленного типа, показателю В-лимфоцитов в периферической крови, бласттрансформации В-лимфоцитов под действием В-клеточных митогенов и другим тестам. Для определения концентрации иммуноглобулинов разных классов в сыворотке крови обычно используют радиальную иммунодиффузию по Манчини.Титр специфических антител (изогемагглютинины групп крови, антитела, образующиеся после вакцинации, естественные антитела) в сыворотке определяют в различных иммунологических реакциях (агглютинация, РПГА, ИФА и другие тесты). Для определения катаболизма иммуноглобулинов используют радиоизотопные метки. Число В-лимфоцитов в периферической крови устанавливают путем определения специфических рецепторов на клетках с помощью моноклональных антител (кластерный анализ) или в реакции розеткообразования (ЕАС-РОК эритроциты в присутствии антител и комплемента образуют розетки с В-лимфоцитами). Функциональное состояние В-лимфоцитов определяют в реакции бласттрансформации путем стимуляции клеток митогенами, такими как туберкулин, лаконас и др. При оптимальных условиях культивирования В-лимфоцитов с митогенами показательтрансформации в бласты может достигать 80%. Подсчет бластов проводят под микроскопом, с использованием специальных гистохимических методов окраски или же с помощью радиоактивной метки – по включению в ДНК клетки тимидина, меченного тритием. Состояние клеточного иммунитета оценивают по количеству Т-лимфоцитов, а также субпопуляций Т-лимфоцитов в периферической крови, бласттрансформации Т-лимфоцитов под действием Т-клеточных митогенов, определению гормонов тимуса, уровню секретируемых цитокинов, а также постановкой кожных проб с аллергенами, контактной сенсибилизацией динитрохлорбензолом. Для постановки кожных аллергических проб используются антигены, к которым в норме должна быть сенсибилизация, например проба Манту с туберкулином. Способность организма к индукции первичного иммунного ответа может дать контактная сенсибилизация динитрохлорбензолом. Для определения числа Т-лимфоцитов в периферической крови используют реакцию розеткообразования Е-РОК, поскольку эритроциты барана образуют с Т-лимфоцитами спонтанные розетки, а для определения числа субпопуляций Т-лимфоцитов – реакцию розеткообразования ЕА-РОК. Реакция розеткообразования используют в связи с тем, что на мембране Т-хелпера имеется рецептор к Fc-фрагменту иммуноглобулина М, а на мембране Т-супрессора – рецептор к Fc-фрагменту иммуноглобулина G, поэтому Т-хелперы образуют розетки с эритроцитами, связанными с антиэритроцитарными антителами класса IgM, а супрессоры образуют розетки с эритроцитами, связанными с антиэритроцитарными антителами класса IgG. Однако реакция розеткообразования для дифференциации Т-лимфоцитов уступили место более точному и современному методу определения популяций и субпопуляций Т-лимфоцитов – кластерному анализу, основанному на использовании моноклональных антител к рецепторам лимфоцитов. После определения числа субпопуляций Т-лимфоцитов рассчитывают соотношение хелперов и супрессоров, т.е.Т4 /Т8 лимфоцитов, которое в норме составляет примерно 2. Бласттрансформацию Т-лимфоцитов, т.е. их функциональную активность, определяют путем стимуляции Т-клеточными митогенами, такими как конканавалин А или фитогемагглютинин. Под влиянием митогенов зрелые лимфоциты трансформируются в лимфобласты, которые можно подсчитать под микроскопом или обнаружить по радиоактивной метке. Для оценки состояния функции тимуса чаще всего применяют определение уровней альфа1-тимозина и тимулина, являющихся отражением функции эпителиальных клеток стромы тимуса. Для определения уровня секретируемых иммуноцитокинов (интерлейкины, миелопептиды и др.) используют иммуноферментные методы, основанные на применении моноклональных антител к двум различным эпитопам цитокина. С этой целью можно также применять реакцию торможения миграции лейкоцитов. В качестве дополнительных тестов для оценки иммунного статуса можно использовать такие тесты, как определение бактерицидности сыворотки крови, титрование С3-, С4-компонентов комплемента, определение содержания С-реактивного белка в сыворотке крови, определение ревматоидных факторов и других аутоантител. Таким образом, оценка иммунного статуса проводится на основании постановки большого числа лабораторных тестов, позволяющих оценить состояние как гуморального и клеточного звеньев иммунной системы, так и факторов неспецифической резистентности. Очевидно, что некоторые из применяемых тестов сложны в исполнении, требуют дорогостоящих иммунохимических реагентов, современного лабораторного оборудования, а также высокой квалификации персонала, в связи с чем они выполнимы ограниченным числом лабораторий. Поэтому все тесты разделены на две группы: тесты 1-го и 2-го уровня. Тесты 1-го уровня могут быть выполнены в любой клинической иммунологической лаборатории первичного звена здравоохранения, они используются для первичного выявления лиц с явно выраженной иммунопатологией. Для более точной диагностики используются тесты 2-го уровня.
33) Иммунодефицит В иммунной системе, как и в любой другой системе организма, возможны различные поломки, в результате которых она начинает функционировать неправильно, в результате чего иммунитет снижается, и развивается иммунная недостаточность (иммунодефицит). Иммунодефицит – это нарушения нормального иммунного статуса, обусловленные дефектом одного или нескольких механизмов иммунного ответа.
Иммунодефицит - это нарушение структуры и функции какого-либо звена целостной иммунной системы, потеря организмом способности сопротивляться любым инфекциям и восстанавливать нарушения своих органов. Кроме того, при иммунодефиците замедляется или вообще останавливается процесс обновления организма.
При иммунодефиците человек становится беззащитным не только перед обычными инфекциями, как грипп или дизентерия, но также перед бактериями и вирусами, которые ранее не могли вызвать заболевания, так как иммунная система не позволяла им размножаться в большом количестве. Один из примеров - пневмоциста - бактерия, живущая в легких практически каждого человека. При здоровой иммунной системе она не причиняет человеку никакого вреда, но при иммунодефиците может вызвать серьезное поражение легких - пневмоцистную пневмонию.
Кроме того, иммунодефицит приводит к обострению тех хронических заболеваний, которые были у человека, но не имели ярко выраженных симптомов и, может быть, никогда бы не привели к серьезным проблемам со здоровьем.
Иммунодефицит - врожденный или приобретенный дефект иммунной системы, проявляющийся резким снижением количества отдельных популяций иммунокомпетентных клеток или нарушением синтеза иммуноглобулинов (агаммаглобулинемия).
Повреждение или недостаточность функции одного или нескольких звеньев в иммунной системе приводит к нарушению иммунного ответа, к той форме иммунопатологии, которая получила название иммунодефицитных состояний.
Все иммунодефицитные состояния делятся на две большие группы:
- врожденный (наследственно обусловленный) иммунодефицит и
- приобретенный иммунодефицит.
В основе наследственно обусловленного иммунодефицитного состояния (первичной иммунологической недостаточности) лежат генетически детерминированные дефекты клеток иммунной системы.
В то же время приобретенный иммунодефицит (вторичная иммунологическая недостаточность) является результатом воздействия факторов внешней среды на клетки иммунной системы. К наиболее полно изученным факторам приобретенного иммунодефицита относятся облучение, фармакологические средства и синдром приобретенного иммунодефицита (СПИД) человека, вызванный вирусом иммунодефицита человека (ВИЧ).
Врожденный (наследственно обусловленный) иммунодефицит (первичная иммунологическая недостаточность) определяется как специфической иммунной недостаточностью, так и неспецифической иммунной недостаточностью.
Причинами заболеваний, обусловленных специфической иммунной недостаточностью, служат нарушения функций T-лимфоцитов или B-лимфоцитов - основы приобретенного иммунитета. Неспецифические иммунодефициты связаны с нарушениями в таких элементах иммунной системы, как комплемент и фагоциты, действующих при иммунном ответе неспецифично.
Нарушения в работе иммунной системы могут быть связаны и с комплексными нарушениями, затрагивающими многие звенья иммунитета.
При иммунодефицитном состоянии наблюдается повышенная чувствительность к инфекциям. Наиболее часто возникающие у таких больных инфекции можно разделить на две категории.
При нарушениях, связанных с иммуноглобулинами, компонентами комплемента и фагоцитарной активностью, резко возрастает восприимчивость к повторным инфекциям, вызываемыми бактериями, которые обладают капсулой (пиогенными, или гноеродными бактериями).
В случаях нарушений в системе T-клеточного иммунитета повышается чувствительность к микроорганизмам (от дрожжей до вирусов), широко распространенных и в норме безвредных: у здоровых людей к ним быстро развивается резистентность, но у больных с недостаточностью T-клеточной функции они способны вызвать летальные инфекции. Это так называемые оппортунистические инфекции.
Иммунодефицит врожденный Клинические проявления первичных иммунодефицитов.
Характерные:
- Рецидивирующие инфекции верхних дыхательных путей - Тяжелые бактериальные инфекции - Хронические инфекции, плохо поддающиеся лечению
Частые:
- Задержка развития - Инфекции, вызванные редкими микроорганизмами - Поражение кожи: сыпь, себорейный дерматит, пиодермия, абсцессы, алопеция, зудящие дерматиты, телеангиэктазии - Стойкий кандидоз рта - Рецидивирующий бронхит, пневмония - Аутоиммунные заболевания - Уменьшение лимфоузлов и миндалин - Гематологические нарушения: апластическая или гемолитическая анемия, нейтропения, тромбоцитопения
Редкие: - Похудание, лихорадка - Хронический конъюнктивит - Увеличение лимфоузлов - Гепатоспленомегалия - Тяжелые вирусные инфекции, например вызванные вирусами простого герпеса или varicella-zoster - Артралгия, артрит - Хронический энцефалит - Рецидивирующий менингит - Гангренозная пиодермия - Осложнения вакцинации - Бронхоэктазы - Позднее отпадение пуповины - Хронический стоматит, пародонтит
Существует множество иммунодефицитов, обусловленых разными причинами. В настоящее время идентифицировано более 70 врожденных (первичных) иммуннодефицитов. Обычно это тяжелые заболевания у детей, вызываемые дефектами какого-либо звена иммунной системы. Дефекты могут затрагивать разные иммунокомпетентные клетки, в том числе Т- и В-лимфоциты и макрофаги. Примером преимущественного поражения Т-клеточного звена иммунитета может служить синдром Ди Джорджи, который сопровождается недоразвитием тимуса. Дефекты Т-клеток повышают чувствительность организма к разнообразным микроорганизмам (от дрожжей до вирусов), которые в норме безвредны.
Нарушения в макрофагах также приводят к тяжелым патологиям, например, к хроническому гранулематозу. Известны патологии, связанные с выработкой антител В-лимфоцитами. При этом возрастает восприимчивость организма к повторным инфекциям, вызываемым гноеродными бактериями.
Врожденные иммунодефициты встречаются довольно редко (в среднем 1 случай на 25000-100000 человек).
34) Различают аутоиммунные реакции и аутоиммунные заболевания, в основе которых лежит взаимодействие компонентов иммунной системы с собственными здоровыми клетками и тканями. К аутоиммунным заболеваниям иногда относят и болезни иммунных комплексов. Аутоиммунные реакции наблюдаются в норме у здоровых лиц, а также при патологии. В первом случае они протекают непрерывно, и их действие сводится к удалению отмирающих, стареющих, больных, модифицированных какими-либо воздействиями клеток. Они являются начальным компонентом развертывания иммунного ответа на различные антигены. Эти реакции полезны для организма и не перерастают в болезнь. Аутоиммунные болезни, или аутоаллергия, встречаются реже. В основе этих патологических состояний лежат аутоиммунные реакции с забарьерными перекрестно реагирующими антигенами, образование «запретных» клонов иммунокомпетентных клеток, реагирующих с собственными нормальными тканями, генетически запрограммированная слабость иммунного ответа на конкретный антиген, недостаточность Т-супрессоров, блокада рецепторов лимфоцитов и другие причины. Они могут быть также следствием приема лекарственных препаратов. Аутоиммунные заболевания бывают органоспецифическими, неорганоспецифическими и смешанными. К органоспецифическим относят болезни, при которых аутоантитела специфичны к одному или группе обладающих антигенными свойствами структурных элементов клеток и тканей одного органа. Чаще всего это забарьерные антигены, врожденная толерантность к которым отсутствует, например, в случае тиреоидита Хашимото, первичной микседемы, тиреотоксикоза, пернициозной анемии и др. К органонеспецифическим заболеваниям относятся патологические процессы, при которых аутоантитела реагируют, как указывалось, со структурными элементами клеток и тканей данного или даже другого организма, имеющего перекрестные антигенные структуры, примером которых могут служить антинуклеарные антитела при системной красной волчанке, ревматоидном артрите. Смешанные болезни включают оба вышеперечисленных механизма.
Довольно часто можно обнаружить нормальные аутоантитела, не вызывающие видимых симптомов заболевания. Они встречаются у совершенно здоровых людей, например, ревматоидный и антинуклеарные факторы. Довольно трудно бывает доказать, что видимая клиническая картина заболевания представляет собой следствие аутоиммунного процесса. Обнаружение антител к аутоантигенам еще не позволяет сделать вывод о причинно-следственной связи заболевания с аутоиммунными реакциями. Для подтверждения этого необходимо: выявить иммунный ответ на аутоантиген, имеющий отношение к заболеванию; идентифицировать его; пассивно перенести заболевание и спровоцировать болезнь соответствующим антигеном в эксперименте на животных.
Классическим примером аутоиммунного заболевания считается аутоиммунный тиреоидит Хашимото. Это незаметно начинающееся, диффузное увеличение щитовидной железы, которое сопровождается снижением ее функции. Женщин заболевание поражает чаще, чем мужчин. Гистологически обнаруживают обширную лимфоидную инфильтрацию с небольшими остатками железистой ткани. Практически во всех случаях аутоиммунного тиреоидита обнаруживаются высокие титры антител к антигенам щитовидной железы, прежде всего к тиреоглобулину и микросомальному антигену. Антитела определяют в РПГА или реакции иммунофлюоресценции (РИФ). Часто обнаруживаются также антинуклеарные антитела. Патогенез тиреоидита Хашимото до конца не выяснен. Несмотря на то, что аутоантитела к антигенам щитовидной железы относятся к классу IgG и могут проходить через плаценту, у детей, родившихся от больных матерей, не обнаруживаются заметные симптомы заболевания. При тиреоидите Хашимото появляются лимфоциты, сенсибилизированные к тиреоглобулину и микросомному антигену, поэтому можно считать, что в основе заболевания лежат главным образом иммунные реакции, опосредованные клетками. При определенных условиях антитела к поверхностным антигенам клетки могут не разрушать ее, а, наоборот, стимулировать. Это наблюдается при тиреотоксикозе. Сыворотка крови больных с тиреотоксикозом способна стимулировать активность щитовидной железы. Стимулирующий фактор обладает свойствами специфических антител к щитовидной железе. Он блокирует связывание тиреостимулирующего гормона с мембраной клеток щитовидной железы, а сам действует как тиреостимулирующий гормон. Стимулирующий фактор проходит через плаценту, поэтому у детей, родившихся от матерей с тиреотоксикозом, выявляют неонатальный гипертиреоз, который проходит через несколько недель после рождения по мере распада материнского IgG. Иммунные реакции могут иметь значение в разрушении клеток при остром и хроническом гепатите. Аутоиммунные реакции лежат в основе патогенеза таких заболеваний, как первичный билиарный цирроз, хронический активный гепатит и криптогенный цирроз печени. Для хронически активного гепатита типично сочетание гипергаммаглобулинемии с инфильтрацией тканей печени лимфоцитами и плазматическими клетками. В высоком проценте случаев обнаруживаются антинуклеарные и антимитохондриальные антитела, а также часто сопутствующие хроническим воспалительным заболеваниям печени антитела к гладкой мускулатуре и ревматоидному фактору. Органоспецифические аутоантитела находят в сыворотке крови примерно 20% больных, тогда как специфически сенсибилизированные клетки печени, выявляемые с помощью флуоресцирующих антител, обнаруживаются в 80% случаев. Очевидно, печень функционирует как иммуносорбент для органоспецифических аутоантител. Вероятно, в основе иммунопатологии лежит сенсибилизация лимфоцитов антигенами печени. Лимфоциты больных с хроническим активным гепатитом выделяют фактор торможения миграции лейкоцитов в присутствии специфического печеночного антигена. Хронический активный гепатит представляет собой прогрессирующее заболевание. Системная красная волчанка – заболевание кожи и соединительной ткани внутренних органов, в основе которого лежит васкулит, обусловленный иммунными комплексами. Клинические симптомы зависят от того, какая система органов поражена, и отличаются исключительным разнообразием. На передний план выступают патологические изменения кожи, суставов и почек. Возможно увеличение селезенки и лимфатических узлов, а также симптомы со стороны ЖКТ и нервной системы. В крови отмечается лейкопения. Иммунологическим критерием заболевания служат аутоантитела IgG к нативной двухцепочечной ДНК, которые находят почти во всех случаях. Можно обнаружить также антитела к другим ядерным и органоспецифическим антигенам в зависимости от локализации поражений. Часто наблюдаются иммуногемолитические осложнения. Концентрация компонентов комплемента С3 и С4 в сыворотке снижена, уровень IgG повышен. Видимо, вследствие вирусной инфекции или дисрегуляции В-клеток при красной волчанке образуются аутоантитела к ДНК, которые, реагируя с соответствующим антигеном ядер, образуют растворимые иммунные комплексы, связывающие комплемент. Эти комплексы и служат причиной васкулита и нефропатии, характерных для красной волчанки. При этом заболевании выявляется частичная недостаточность клеточного иммунитета в сочетании с избыточной активностью гуморального. Ревматоидный артрит – это общее хроническое воспалительное заболевание с преимущественным поражением суставов. Оно протекает с повторными обострениями и ремиссиями или посточнно прогрессирует, приводя к тугоподвижности суставов, прежде всего кистей и стоп. При ревматоидном артрите происходит отложение активирующих комплемент
|
|||||||||
|
Последнее изменение этой страницы: 2020-11-23; просмотров: 110; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.221.41.214 (0.114 с.) |