Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
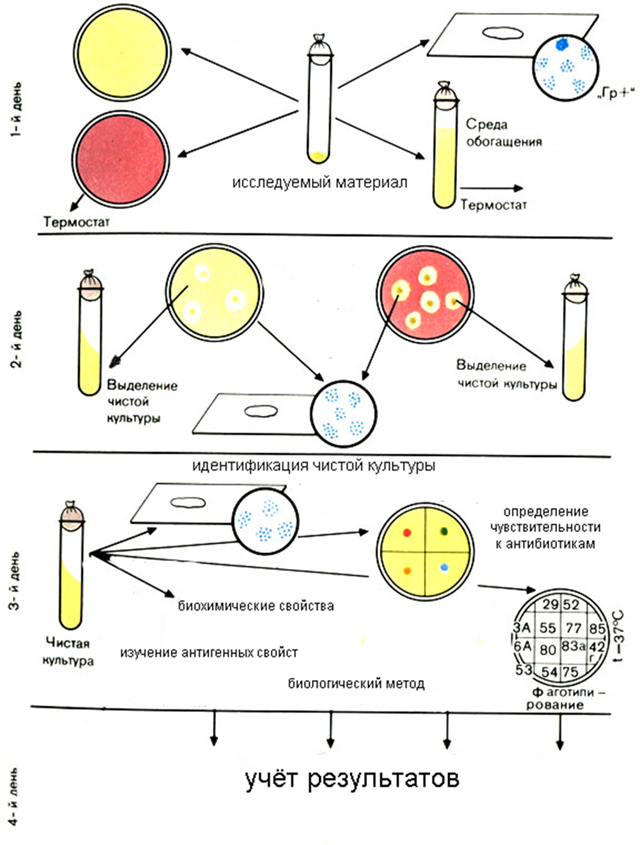
Семинар 7 «Методы выделения чистой культуры анаэробов» ⇐ ПредыдущаяСтр 5 из 5
Окислительный метаболизм (дыхание)
Дыхание – процесс получение энергии в реакциях окисления-восстановления, соп-ряженных с реакциями окислительного фосфорилирования, при котором донорами электронов могут быть органические (у ор-ганотрофов) и неорганические у (лито-трофов) соединения, а акцептором – только неорганические соединения Если акцептором электронов является молекулярный кислород, то это АЭРОБЫ Если акцептором электронов является нитрат или сульфат, то это АНАЭРОБЫ Нитратное дыхание встречается у факультативных анаэробов Бактерии, имеющие сульфатное дыхание (Desulfovibrio и Desulfotomaculum) медицинского значения не имеют
Отношение бактерий к кислороду
Облигатные анаэробы – не используют кислород для получения энергии. Тип метаболизма – бродильный (иcключение: Desulfovibrio и Desulfotomaculum) · Строгие анаэробы. Кислород для них токсичен. Энергию получают маслянокислым брожением (например, C.botulinum, C.tetani) · Аэротолерантные - не используют кислород для получения энергии, но могут существовать в его атмосфере (молочнокислые бактерии) Различное физиологическое отношение микроорганизмов к кислороду связано с наличием у них ферментных систем, позволяющих существовать в атмосфере кислорода. Для нейтрализации токсичных форм кислорода микроорганизмы, способные существовать в его атмосфере, имеют: супероксиддисмутазу, пероксидазу, каталазу. · Облигатные аэробы и факультативные анаэробы имеют супероксиддисмутазу и каталазу · Аэротолерантные микроорганизмы не имеют супероксиддисмутазы, ее функцию выполняет высокая концентрация солей марганца. Перекись водорода у этих микроорганизмов разрушается пероксидазой · Строгие анаэробы не имеют ни пероксидазы, ни каталазы, но супероксиддисмутаза встречается у многих анаэробов и коррелирует с их устойчивостью к кислороду Супероксиддисмутаза расщепляет за-кисный радикал на перекись водорода и молекулярный кислород. Перекись водорода может расщепляться каталазой (облигатные аэробы и факуль-тативные анаэробы) или пероксидазой (аэротолерантные микроорганизмы).
Методы создания анаэробных условий · Физические · Химические · Биологические
Физические методы создания анаэробных условий
1. Для удаления растворенного в питательных средах кислорода производят их регенерацию путем кипячения в течение 15-20 минут на водяной бане с последующим быстрым охлаждением да 45-50°С. После посева для предотвращения проникновения кислорода в жидкую питательную среду ее поверхность заливают стерильным вазелиновым маслом или парафином. 2. Посев содержащего анаэробы патологического материала в высокий столбик плотной или полужидкой питательной среды, которая разливается в пробирки в объеме 10-12 мл. Кислород воздуха диффундирует обычно на расстояние 1,5-2,0 см от поверхности, а в глубине создаются благоприятные условия для роста облигатных анаэробов 3. Эвакуационно-заместительный метод заключается в удалении воздуха из герметически закрытых сосудов (анаэростатов, анаэробных боксов) с помощью вакуумного насоса с последующей заменой его инертным газом (азот, аргон, гелий) или бескилородной газовой смесью, состоящей из 80% азота, 10% двуокиси углерода и 10% водорода. В ряде случаев используют природный (магистральный газ). Для поглощения остатков кислорода из газовой смеси используют палладиевый катализатор. Для поглощения водяных паров на дно анаэростата помещают 5-6 г хлористого кальция, 10-12 г силикагеля или 20-30 г хлористого натрия.
Химические методы создания анаэробных условий 1. Применение щелочных растворов пирогаллола для поглощения кислорода в замкнутой воздушной среде. Для поглощения кислорода из 220 мл воздуха применяют смесь, состоящую из 1 мл 20% раствора пирогалллола и 1 мл насыщенного раствора карбоната натрия 2. Для поглощения кислорода из замкнутого пространства можно применять гидросульфит натрия. Для связывания кислорода в 1 л объема берут 100 мл свежеприготовленного 20% раствора Na2SО4 и 16% КОН. Эти реагенты связывают кислород быстрее, чем пирогаллол 3. Для связывания остатков кислорода в предназначенный для роста анаэробов питательных средах используют вещества - редуценты, к которым относятся тиогликат натрия (0,01-0,02%), аскорбиновая кислота (0,1%), различные сахара (0,1-3%), цистин и цистеин (0,03-0,05%), муравьино-кислый натрий (0,25-0,75%) и др.
4. Применение газогенерирующих систем для создания анаэробных условий в замкнутой воздушной среде (микроанаэростатах, эксикаторах, прозрачных газонепроницаемых пакетах). Для образования водорода и двуокиси углерода, необходимых для роста облигатных анаэробов, используют специальные таблетки, которые активируются добавлением воды. Водород, генерируемый таблетками боргидрида натрия, связывает кислород воздуха в присутствии палладиевого катализатора с образованием воды. Углекислый газ вырабатывается при взаимодействии лимонной кислоты с бикарбонатом натрия.
Биологические методы создания анаэробных условий: 1. Совместное выращивание анаэробов и аэробов (метод Фортнера). При этом на одну половину чашки Петри с плотной питательной средой засевают исследуемый материал, а на другую – культуру аэробного или факультативно-анаэробного микроорганизма, способного активно поглощать кислород. После посева чашку закрывают крышкой, края которой для герметизации заливают парафином или заклеивают пластилином. В качестве активного поглотителя кислорода из замкнутого пространства часто используют культуру «чудесной палочки» (Serratia marcescens). При недостаточной герметизации чашки этот микроорганизм образует ярко-красный пигмент, а при сохранении строго анаэробных условий вырастают бесцветные или бледно-розовые колонии. 2. Помещение в питательную среду кусочков печени, головного мозга, почек и других внутренних органов. При этом тканевые клетки активно поглощают и адсорбируют на себе кислород, в результате чего в среде создаются анаэробные условия. Примером питательной среды, сконструированной по этому принципу, является содержащая кусочки печени среда Китта-Тароцци. К тому же в печеночной ткани содержится большое количество веществ с SН-группой (цистеин, глютатион и др.), обладающих сильным редуцирующим действием. 3. Культуры некоторых облигатных анаэробов можно поддерживать путем пассажа на лабораторных животных.
Методы выделения чистых культур облигатных анаэробов: 1. Метод Цейсслера. Исследуемый материал рассевают штрихами по поверхности плотной питательной среды, помещают в анаэробные условия и выдерживают в термостате при 37°С в течение 24-72 ч. Изолированные колонии анаэробов пересевают в среду для контроля стерильности (СКС) или среду Китта-Тароцци. 2. Метод Вейнберга. Несколько капель исследуемого материала вносят в пробирку с 4-5 мл изотонического раствора NaCl, перемешивают запаянным капилляром и переносят в пробирку с охлажденным до 45-50°С сахарным агаром, разлитым высоким столбиком. После перемешивания этим же капилляром последовательно засевают еще две пробирки с сахарным агаром и быстро охлаждают под струей холодной воды. Выросшие через 24-72 ч в глубине агара изолированные колонии анаэробов засевают в среду Китта-Тароцци или СКС. 3. Метод Вейона-Виньяля. Готовят разведения исследуемого материала в пробирках с сахарным агаром. Из каждой пробирки разведенный материал насасывают в пастеровские пипетки, после чего запаивают их концы. После получения микробного роста пипетку надпиливают в соответствующем месте, разламывают с соблюдением правил стерильности и переносят изолированную колонию в среду Китта-Тароцци или СКС
4. Метод Перетца. Готовят разведения исследуемого материала. Содержимое пробирки с соответствующим разведением выливают в стерильную чашку Петри, на дне которой на двух стеклянных или деревянных палочках лежит стеклянная пластинка размером 6Χ6 см. Среду заливают сбоку таким образом, чтобы она заполнила пространство между пластинкой и дном чашки Петри. При появлении микробного роста стеклянную пластинку удаляют, а изолированную колонию засевают в пробирку со средой Китта-Тароцци или СКС для получения чистой культуры. Наиболее простой и удобной разновидностью метода Перетца является метод «перевернутых чашек». При этом каждое разведение исследуемого материала в пробирке с сахарным агаром заливают в крышку чашки Петри и закрывают стерильным донышком чашки, избегая образования пузырей воздуха. Щель между краями крышки и дном чашки Петри заливают расплавленным парафином. Термостатируют при 37°С до появления изолированных колоний анаэробов.
Питательные среды для выделения анаэробов 1. Среда Китта-Тароцци. Бычью печень или мясо нарезают мелкими кусочками, заливают троекратным количеством питательного бульона рН 7,2 – 7,6, кипятят 30 мин. Бульон фильтруют. Печень промывают на сите водой, распределяют в пробирки по 3-4 кусочка в каждую, заливают 7-8 мл бульона (содержит 0,5 % глюкозы). Бульон кипятят 20 мин на водяной бане. Сверху на поверхность среды наливают стерильное масло слоем 1-1,5 см. 2. Среда Вильсона-Блера. 100 мл 3% МПА с 1% глюкозы расплавляют на водяной бане, добавляют 10 мл 20% натрия сульфита и 1 мл 8 % растовра железа хлорида. 3. Среда Виллиса-Хоббса. Смешивают 400 мл бульона Хоттингера, 4,8 г агара, 4,8 г лактозы, 1,8 мл нейтирального красного. После стерилизации добавляют 15 мл суспензии куриного желтка с физиологическим раствором и 60 мл стерильного обезжиренного молока.
Семинар 8 «Методы культивирования и выделения чистых
Методы выделения чистых культур, основанные на механическом методе · Метод последовательных разведений (метод Пастера) Заключается в том, что из исследуемого материала делают ряд последовательных разведений в жидкой питательной среде. Для этого каплю посевного материала вносят в пробирку со стерильной жидкой средой, из нее каплю переносят в следующую пробирку и так засевают до 8…10 пробирок. С каждым разведением количество микробных клеток, попадающих в среду, будет уменьшаться и можно получить такое разведение, в котором во всей пробирке со средой будет находиться только одна микробная клетка, из которой разовьется чистая культура микроорганизма. Так как в жидких средах микробы растут диффузно, т.е. легко распределяются во всей среде, то изолировать одну микробную клетку от другой трудно. Таким образом, метод Пастера не всегда обеспечивает получение чистой культуры. Поэтому в настоящее время этот метод используется, главным образом, для предварительного уменьшения концентрации микроорганизмов в материале перед посевом его в плотную среду для получения изолированных колоний.
· Метод пластинчатых разведений (метод Коха) Метод пластинчатых разводок – основан на последовательном разведении исследуемого материала мясопептонным агаром с последующей разливкой пробирок с разведенным материалом в чашки Петри · Метод Дригальского при посеве материала, обильно обсемененного микрофлорой, используют 2–3 чашки для последовательного посева шпателем. · Метод штриховых посевов
Исследование мочи методом секторных посевов (метод Gould) Бактериальной петлей диаметром 2 мм, емкостью 0,005 мл берут каплю мочи и делают 30-40 штрихов на сектор А чашки Петри. Прожигают петлю и производят 4 штриха через сектор А в сектор I. Аналогичным образом из сектора I засевают сектор II, а из сектора II - сектор III. Чашки инкубируют при 37 оС 24 часа. При отсутствии роста на кровяном агаре инкубацию пролонгируют до 3 суток. Учет результатов проводят по специальной таблице. Посев проводят на питательный агар, 5% кровяной агар и 0,25% сахарный бульон. При латентном течении уроинфекции или в случае антибиотикотерапии рекомендуется дополнительно производить посев 0,1 мл мочи на плотные питательные среды и в пробирку с 0,25% бульоном.
Методы выделения чистых культур, основанные на биологическом методе · Спорообразование · Кислотоустойчивые микроорганизмы · Подвижность бактерий · Чувствительность к действию химических веществ и антибиотиков · По типу дыхания · Чувствительность лабораторных животных
|
||||||||
|
Последнее изменение этой страницы: 2020-11-23; просмотров: 51; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.191.245.117 (0.018 с.) |