
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Типы электрофореграмм и их особенности
Изменение содержания отдельных белков плазмы крови в процентном отношении по сравнению с нормой особенно важно для диагностики и наблюдения за патологическими процессами в развитии. При острых воспалительных процессах в организме (пневмония, острые инфекционные заболевания, сепсис, полиартрит) характерно, помимо уменьшения %-ной доли альбуминов, возрастание доли α1, α2 - глобулинов. При нефрозах, нефритах, нефросклерозах отмечается значительное уменьшение альбуминов и возрастание α2, β - глобулинов на фоне умеренного понижения γ – глобулинов. Для гепатитов, токсических поражений печени, гемолитических процессов характерно умеренное понижение альбуминов, увеличение γ - глобулинов и резкое увеличение β – глобулинов, для механических желтух - умеренное увеличение α2, β и γ – глобулинов. Это делает электрофоретический анализ белков крови особенно актуальным для диагностики развивающегося процесса на основе конкретных изменений, как в основных группах белков, так и специфических белков в их составе. По внешнему виду, по характеру распределения фракций после электрофореза кривые распределения белков крови могут быть представлены в виде определенных типов электрофореграмм в зависимости от общих признаков, характерных для ряда патологических процессов. Типы электрофореграмм /протеинограмм/ объединяют сходные изменения в распределении белков при различных патологических состояниях. Протеинограммы, характерные для заболеваний, связанных с острыми воспалительными процессами. Этот тип электрофореграмм характеризуется уменьшением содержания фракции альбумина, выраженность которой соответствует распространенности и остроте процесса. Одновременно характерным для этого типа электрофореграмм является возрастание уровней фракций α1 и α2 - глобулинов, с которыми связаны основные группы белков так называемой острой фазы. На поздних сроках может быть зарегистрировано увеличение содержания γ-глобулинов. Может быть увеличено содержание β-глобулинов. Такой тип протеинограммы характерен для начальных стадий пневмонии, острых полиартритов, экссудативного туберкулеза, острых инфекционных заболеваний, сепсиса, обширного инфаркта миокарда и др.
Протеинограммы, характерные для хронических воспалительных процессов. Протеинограмма таких заболеваний показывает умеренное уменьшение фракции альбумина, при увеличении пиков α2 и γ - глобулинов, т.к. при переходе заболевания в хроническую форму снижается образование ряда фракций белков острой фазы, что приводит к выраженному перераспределению этого типа белков на электрофореграмме.Могут быть увеличены β-глобулины. Этот тип распределения белков соответствует поздней стадии пневмонии, хроническому туберкулезу легких, хроническому эндокардиту, холециститу, циститу и др. Протеинограммы, характерные для гепатитов, отражает умеренное уменьшение содержания альбумина, увеличение уровня γ - глобулинов и менее выраженное β - глобулинов. Этот тип электрофореграмм встречается при состояниях токсического повреждения печени, гепатитах, гемолитических процессах, может быть при злокачественных новообразованиях, дерматозах. Протеинограммы, соответствующие циррозу печени. Отмечается значительное снижение содержания альбуминов при сильном увеличении γ-глобулиновой фракции, указанный тип протеинограмм выявляется при циррозах печени, сепсисах, при некоторых формах полиартрита и коллагенозов. Протеинограммы, характерные для механической желтухи. Отличается комплексом изменений; уменьшение уровня альбуминов и умеренное увеличении содержания α2, γ и β - глобулинов. Этот тип электрофореграмм присущ обтурационной желтухе, а также желтухам, вызванным развитием рака желчевыводящих путей и головки поджелудочной железы. Протеинограмы характерные для нарушения функциипочечного фильтра. Значительное уменьшение содержания альбуминов регистрируется на фоне повышения концентрации α2 и β - глобулинов при умеренном снижении уровня γ - глобулинов. Этот тип протеинограмм свойственен генуинному или липоидному нефрозам, нефритам, кахексии, токсикозам беременности, а также ряду других заболеваний. П ротеинограммы, соответствующие злокачественнымновообразованиям. Обнаруживается резкое снижение содержания альбуминов при значительном увеличении всех глобулиновых фракций. Наибольшего пика подъема достигает уровень γ - глобулинов. Этот тип протеинограмм сопровождает метастатические новообразования с различной локализацией первичной опухоли.
Протеинограммы, характерные для γ - глобулиновых плазмоцитом. Отличаются значительным уменьшением содержания альбуминов α2и β - глобулинов при увеличении концентрации γ - глобулинов. Они типичены для макроглобулинемии и некоторых ретикулезов.
ВЛИЯНИЕ ОТДЕЛЬНЫХ БЕЛКОВ НА РЕЗУЛЬТАТ
Анализ белкового спектра плазмы крови методом электрофореза позволяет выявить закономерную связь между качественными и количественными изменениями в их распределении и динамикой патологического процесса, зависящего не только от природы заболевания, но и от особенностей его проявления. В настоящее время известен ряд индивидуальных белков, изменения которых характерны для определенных патологических процессов и именно они могут влиять на характер получаемых в результате электрофореза кривых. Белки острой фазы Понятие белки острой фазы объединяет большую группу белков (до 3О) участвующих в формировании ответа организма на повреждающее воздействие, развитие воспалительного процесса, действие медиаторов воспаления /кинины, биогенные амины, простагландины/. В эту группу входят белки, связанные с процессами восстановления гомеостаза всего организма в целом. Они могут быть представлены по группам в связи с уровнем увеличения их содержания в зависимости от стадии воспалительного процесса и временного интервала их появления в крови и наибольшей информативности. Эти белки способны изменять характер распределения и величину пиков основных фракций белков на электрофореграмме. Содержание белков четвертой группы может оставаться в пределах нормальных значений, но эти белки принимают участие в реакциях, сопровождающих острую фазу воспаления /а2-макроглобулин, иммуноглобулины/. Пятая группа белов – это белки, содержание которых в условиях острого воспалительного процесса может быть ниже нормы. Уменьшение концентрации отдельных белков пятой группы в острый период на 30-60% может быть обусловлено снижением синтеза, увеличением их потребления, изменением их распределения в организме. Несмотря на различие биологических функций,все эти белки выполняют важную роль в районе повреждения и непосредственно участвуют в реакциях, направленных на удаление повреждающего фактора, локализацию очага повреждения, стабилизацию процессов,восстановление нарушенной структуры.
Белки острой фазы.
Индивидуальные белки Ряд белков, изменения содержания которых характерны для развития патологического процесса, могут изменить картину распределения основных белков крови при электрофорезе. При необходимости они могут быть определены дополнительно иммунологическими методами. Преальбумин и ретинол-связывающий белок /РСБ/. Относятся к транспортным белкам крови. Норма до 0,4г/л. Преальбумин - показатель нарушения синтетической способности печени, маркер недостатка питания, дефицита аминокислот. РСБ увеличивается при хронической почечной недостаточности, снижается при заболеваниях печени, погрешностях и недостатке питания. α1 - антитрипсин - белок острой фазы, является основным ингибитором сериновых протеаз. Генетически обусловленное снижение содержания α1 - антитрипсина является причиной предрасположенности к бронхопульмональным заболеваниям /эмфизема, хронический бронхит, бронхоэктатическая болезнь/.В детском возрасте дефицит α1 - антитрипсина – служит причиной холестаза и цирроза печени, желтух. Белок имеет несколько изоформ, которые можно получить при помощи электрофореза. Норма 1,4-3,2г/л. α1 - кислый гликопротеин /орозомукоид/.Связывает в транспортирует прогестерон и тестостерон; влияет на адгезию тромбоцитов. Резкое повышение его в послеоперационном периоде указывает на локальную инфекцию, абсцесс или сепсис. Концентрация этого белка может быть увеличена при ревматоидном артрите, системной красной волчанке, метастазах опухолей, инфаркте миокарда; снижена - при голодании, тяжелых поражениях печени, белок-теряющих энтеропатиях. Норма: 0,4-1,3 г/л. α2- макроглобулин - ингибирует протеолитические ферменты, синтезируется вне печени. Содержание белка увеличено при невротическом синдроме, циррозе, микседеме, сахарном диабете, бронхопневмонии, беременности; снижено при ревматическом полиартрите, остром панкреатите, язве желудка и 12-типерстной кишки, инфаркте миокарда, активном фибринолизе, почечно- и желчекаменной болезнях. Норма: 1,2-3,2 г/л.
α1 – микроглобулин. В сыворотке образует комплексы. Используется для оценки степени клубочковой фильтрации. α - фетопротеин - фетальный белок. Маркер злокачественных опухолей – первичного рака печени и тератобластомы яичников; при беременности является маркером нормального развития эмбриона и используется для пренатальной диагностики. Увеличение содержания α-фетопротеина в крови может проявиться на электрофореграмме в виде отдельного пика между альбумином и α1 –глобулином. При циррозе печени алкогольного происхождения, кривая изменений этого белка в динамике имеет пилообразный характер. a2 - микроглобулин. Определяется в сыворотке и в моче. В сыворотке - для контроля течения и лечения лимфопролиферативных заболеваний /лимфогранулематоз, хронический лимфолейкоз, множественная лимфома/, в сыворотке и в моче определяется для оценки функции почек. Почечная недостаточность, при которой клубочковая фильтрация менее 80 мл/мин, ведет к его увеличению в сыворотке и снижению в моче. Норма: в сыворотке менее 2,4 мг/л,в моче до 250 мкг/л. Миоглобин - маркер инфаркта миокарда. При инфаркте миокарда увеличение его концентрации в сыворотке обнаруживается уже через два часа после приступа боли. Уровень миоглобина в сыворотке, увеличен при краш-синдроме, эпилептических припадках, лихорадке, почечной недостаточности, лихорадках при инфекциях /грипп, тиф, столбняк/, мышечной патологии, включая наследственные формы. Тропонин-Т, Тропонин1 - структурные белки поперечно-полосатой мышцы. В норме в плазме отсутствуют. Появляются в сыворотке при повреждении мышц. Высокочувствительные и высокоспецифичные маркеры инфаркта миокарда. Церулоплазмин - медьсодержащий белок, обладающий свойствами фермента. Депонирует ионы меди, окисляет двухвалентное железо в трехвалентное. Норма 300-580 мг/л. Повышен при реакциях острой фазы, во время беременности, у лиц, принимающих эстрогенсодержащие контрацептивы, при холестазе из-за нарушения выведения меди. Увеличение содержания специфично при меланоме и шизофрении. Снижение содержания отмечается при болезни Вильсона-Коновалова, а также при невротическом синдроме, энтеропатии с потерей белка, тяжелых поражениях печени. Гаптоглобин связывает и транспортирует свободный гемоглобин-α в клетки ретикулоэндотелия. Содержание снижается при поражениях паренхимы печени, гемолитической анемии, и увеличивается при острых воспалительных процессах, сахарном диабете. Норма до 0,35 г/л. Гемпексин - гемсвязывающий сывороточный α-гликопротеид. Норма 0,5 г/л. Увеличен при гемолитической анемии, сахарном диабете, мышечной дистроФии, злокачественных новообразованиях. Трансферрин – основная функция - перенос железа к клеткам. Оценка содержания трансферрина в плазме используется для дифференциальной диагностики анемий. Повышение его содержания отмечается при скрытом железодефиците. Уменьшение концентрации при реакции острой фазы, неэффективном эритропоэзе /талассемия, мегалобластные анемии/, гемохроматозе, потерях белка и нарушениях его синтеза.
Ферритин. Концентрация этого белка в крови соответствует общим запасам железа в организме. Содержание в сыворотке меньше 15 мкг/л указывает на недостаток железа. Повышение уровня встречается при гипохромной анемии, гемо- трансфузии, гемохроматозе, неэффективном эритропоэзе. С-реактивныи белок /СРБ/ - основной белок острой фазы, содержание в норме менее 0,005 г/л. Синтезируется в печени, при тяжелых воспалениях синтез возрастает в тысячу раз /в первые 6-12 ч./, быстро снижается при эффективном лечении или переходе процесса в хроническую форму. Используется для диагностики сепсиса у новорожденных. В первый день жизни уровень СРБ повышен у 80 % инфицированных новорожденных. Может быть использован для дифференциальной диагностики бактериальных и вирусных инфекций. Высокое содержание СРБ наблюдается при: системных васкулитах, тяжелых бактериальных инфекциях (сепсис, пневмония, пиелонефрит, послеоперационные инфекции), активном ревматоидном артрите, активной болезни Крона, тромбозе глубоких вен, остром панкреатите, метастазирующих некрозирующих опухолях. Фибронектин - концентрация в плазме - до 6,5 мг/л. Повышение концентрации в плазме регистрируется у больных со злокачественными новообразованиями различной локализации, наиболее часто при опухолях печени, поджелудочной железы или желчевыводящих протоков. Фибриноген - нормальная концентрация в крови 1,8-5 г/л. Повышение его содержания сопровождает острые и хронические воспалительные процессы: болезни почек /острый и хронический пиелонефрит, гломерулонефрит, невротический синдром/. Содержание этого белка возрастает при лихорадке, воспалении, некрозе тканей, инфекционных заболеваниях, травмах, ожогах, обширных хирургических вмешательствах, коллагенозах; остром инфаркте миокарда, лучевой болезни, некоторых злокачественных опухолях, особенно при раке легкого. Гипофибриногенемия наблюдается при тяжелой почечной недостаточности, циррозе печени, отравлении гепатогенными ядами, состоянии после обильных кровотечений, ожогов, а также при лейкозах, метастазах опухоли в костный мозг, употреблении ряда лекарств. Комплемент. Состоит из, большой группы сывороточных глобулинов; система комплемента вместе с антителами и специализированными клетками участвует в защите организма от инфекций. СЗ - и С4 - компоненты комплемента – белки острой фазы. Дефицит компонента СЗ - сопровождает аутоиммунные заболевания со значительным полиморфизмом, особенно часто с гломерулонефритом и системной красной волчанкой, возвратные инфекции; дефицит компонента С4 – характерен для болезней иммунных комплексов: системная красная волчанка, полимиозит, гломерулонефрит. Парапротеины /моноклональные иммуноглобулины/. Это Ig или их фрагменты, не способные выполнять функцию антител. Парапротеины определяются при электрофорезе белков по наличию узкого пика /М-градиент/ обычно в зоне γ – глобулинов, однако полоса М-градиента может мигрировать от γ – глобулинов до альбумина. Встречаются двойные М-градиенты. Парапротеины регистрируются при множественной миеломе, и при таких заболеваниях иммунной системы как макроглобулинемия Вальденстрема, острый плазмобластный лейкоз, болезни тяжелых цепей, лимфомы с парапротеинемией. В случае множественной миеломы при выявлении на электрофорезе сыворотки парапротеинов обязательным является электрофоретическое исследование мочи /появление белка Бен-Джонса /.
Криоглобулины - патологические белки плазмы, обладающие повышенной способностью к коагуляции - превращение в желеобразное состояние при температуре ниже 37°С. Они могут появиться при миеломе, макроглобулинемии Вальденстрема, хроническом лимфолейкозе, инфекционных заболеваниях /сифилисе, мононуклеозах, туберкулезе/, вирусных аутоиммунных заболеваниях, циррозе печени, коллагенозах.
Структура и свойства ферментов. Ферменты – это белки, участвующие в процессах, протекающих в органах и системах живых организмов, выполняя роль катализаторов. Ферменты обеспечивают многообразие биохимических реакций и жизнедеятельность организмов. Будучи белками, ферменты обладают всеми особенностями, присущими этому классу соединений. Пространственное формирование структуры фермента и свертывание молекулы в виде спирали обеспечивает структуру молекулы, которая поддерживается за счет водородных, дисульфидных, ионных и полярных связей. у. Ряд ферментов, как и белков, имеет четвертичную структуру. В этом случае молекула фермента состоит из нескольких субъединиц, каждая из которых обладает первичной, вторичной и третичной структурой. По своему строению ферменты могут быть простыми и сложными белками. Простые ферменты при гидролизе дают только смесь аминокислот; сложные, кроме аминокислот в своем составе имеют компонент небелковой природы. Белковая часть сложного фермента носит название – «апофермент»; небелковая – «кофермент». Апофермент и кофермент в отдельности не обладают ферментативными свойствами. Только объединившись в одну молекулу, они обладают каталитической способностью и могут работать в качестве фермента. В сложных ферментах кофермент часто представлен витамином или его производным. Поэтому гиповитаминоз всегда приводит к нарушению обменных процессов за счет дефекта ферментных систем. В организме ферменты выполняют роль биологических катализаторов и обладают основными свойствами истинных катализаторов: 1. ферменты активируют соединения и делают возможным протекание реакций, которые или идут с очень низкой скоростью или не идут без участия катализатора; 2. сам фермент в процессе реакции не изменяется; 3. для протекания ферментативной реакции необходимо малое количество фермента.
В процессе работы фермент образует с субстратом (преобразуемым соединением) фермент-субстратный комплекс.
На поверхности молекулы фермента расположены «центры связывания». Каждый центр связывания – это участок молекулы, имеющий определенную последовательность специфичных аминокислот обеспечивает образование фермент-субстратного комплекса. В результате такого взаимодействия фермента с субстратом в молекуле субстрата происходит ослабление внутримолекулярных связей и повышение уровня энергии, что служит началом преобразования структуры субстрата. Формирование фермент-субстратного комплекса – это начальная стадия ферментативного процесса, протекание которого определяется временем образования этого комплекса, концентрацией субстрата и временем образования продукта реакции (конечного продукта). С увеличением концентрации субстрата скорость реакции возрастает до определенной величины, после чего становится постоянной. Скорость ферментативной реакции и ее связь с субстратом может быть охарактеризована с помощью константы Михаэлиса-Ментен ( Помимо центров «связывания» на поверхности молекулы фермента расположены – центры «активации» – участки аминокислот, имеющих определенную последовательность и позволяющих за счет взаимодействия с ними изменять активность фермента. Активация фермента может быть также достигнута путем изменения пространственной формы его молекулы – за счет конформационных изменений. Конформационные изменения могут переводить молекулу фермента из неактивного состояния в активное за счет отщепления части молекулы, присоединения, наиболее полного раскрытия и доступности центра связывания. Одним из важных свойств ферментов является их специфичность по отношению к субстрату, которая может быть абсолютной и относительной. Ферменты, обладающие абсолютной специфичностью способны катализировать превращения только одного соединения; обладающие групповой специфичностью – соединения разные по составу, но относящиеся к одному виду. При относительной специфичности ферменты могут катализировать превращения близких по строению соединений. Некоторые ферменты обладают стериоспецифичностью. Они способны катализировать превращение только определенных стереоизомеров: Д-изоформы, но не L-изоформы, или наоборот. Для многих ферментов характерно наличие «изоферментов». Изоферменты – это группа ферментов, катализирующих одну и ту же реакцию, но различающихся по ряду физико-химических свойств. Эти различия включают: аминокислотный состав, электрофоретическую подвижность, иммунобиологические реакции, соотношения полипептидных цепей, пространственную ориентацию. Чаще всего – это различия в формировании четвертичной структуры. К ферментам, имеющим изоформы, относятся лактатдегидрогеназа, креатинкиназа, малатдегидрогеназа и другие. Соотношения изоформ в разных тканях могут существенно различаться, а также изменяться при патологических состояниях. Эти особенности изоферментов используются в диагностике заболеваний. Изоферменты могут быть определены методами электрофореза, хроматографии и иммунохимическими методами.
Активность ферментов. Каталитическая активность ферментов зависит от ряда показателей, одним из которых является количество и особенности субстрата. С этими параметрами связана как скорость образования фермент-субстратного комплекса, так и скорость ферментативной реакции. Для нормального протекания реакции необходимо количество субстрата, превышающее константу Михаэлиса-Ментен в 5-10 раз. При большем увеличении количества субстрата скорость ферментативной реакции может падать за счет «субстратного» торможения. Ферментативная реакция зависит от рН и от температуры среды. Величина рН влияет на процесс связывания фермента с субстратом, на образование и распад фермент-субстратного комплекса. Поэтому для ферментов характерно понятие «оптимума рН» Для большинства ферментов «оптимум рН» – это область физиологических значений рН, характерных для плазмы крови в условиях нормы: 7-8. Однако, есть ферменты оптимум рН для которых лежит в области рН=2 (пепсин, трипсин) и ферменты, активность которых проявляется при достаточно высоких значениях рН, как, например, щелочная фосфатаза, оптимум рН для действия этого фермента – 10,5. Величина рН очень важна для сохранения активности ферментов, поэтому необходимо использовать подходящие буферные растворы для стабилизации и поддержания постоянного значения рН реакционной среды, необходимого для работы данного фермента. Для большинства ферментов концентрация буферного раствора может варьировать от 0,01 до 0,1 моль/л. Для нормального протекания ферментативного процесса имеет значение температура, так как от нее зависит скорость ферментативной реакции. При этом необходимо обращать внимание на продолжительность периода инкубации и на стабильность фермента в этих условиях. Чаще всего при анализе ферментов поддерживается температурный оптимум, характерный для нормального состояния человеческого организма Ферменты, будучи белками, реагируют на изменения температурного режима – при повышении температуры активность ферментов может увеличиваться. Однако, при достаточно длительном повышении температуры (выше Соединения, присутствие которых приводит к изменению конформации фермента, изменению его активности и состояния активного центра, называют кофакторами. Кофакторы имеют разную степень сродства по отношению к ферментам и центрам активации. По своей природе кофакторами могут быть ионы металлов: цинка, магния, кальция, меди, марганца, железа, натрия, калия, и биологически активные вещества различного происхождения. Вещества, способные трансформировать ферменты из неактивного состояния в активное называют активаторами, индукторами, стимуляторами. Активаторы могут изменять структуру и длину молекулы фермента, переводя его из неактивной формы в активную (соляная кислота и пепсин), а также присоединятся к активному центру (катионы и анионы минеральных солей). Активация фермента может быть достигнута воздействием нескольких ионов. Вещества, приводящие к снижению или подавлению активности ферментов, называются ингибиторами. Ионы металлов в зависимости от концентрации могут выступать как в роли активаторов, так и в роли ингибиторов. Ингибиторы бывают необратимые и обратимые; конкурентные и неконкурентные. Соли тяжелых металлов, реагируя с ферментом, приводят к необратимому ингибированию его активности. Обратимое ингибирование может быть конкурентным и неконкурентным. При конкурентном ингибированиии активность фермента может быть восстановлена добавлением избытка субстрата. Обратимое ингибирование ферментов сыворотки часто исчезает при ее разведении, что и является одной из причин повышения активности ферментов сыворотки при ее разведении. Неконкурентное ингибирование может быть вызвано фосфорорганическими соединениями. При определении ферментов в моче, ее необходимо диализовать, так как в моче присутствуют ингибиторы, затрудняющие это определение. На активность ферментов могут влиять лекарственные препараты и продукты их метаболизма. Это необходимо учитывать при определении ферментативной активности в крови. Все вышеуказанное имеет значение при анализе ферментативной активности и определяет условия, при которых возможна оценка активности.ферментов Чаще всего присутствие и количество фермента определяется по специфичности и скорости катализируемой им реакции. Активность фермента (но не его концентрация) определяется косвенно на основании оценки катализируемого процесса, при этом определяется либо убыль субстрата, либо прирост продукта реакции за единицу времени. Фермент может оцениваться на основании количественного определения продуктов катализируемой им реакции. После достижения равновесия ферментативной реакции – определение проводят по «конечной точке», веществу, появляющемуся в результате реакции. Наиболее удобны реакции, при которых происходит практически полное использование субстрата, его преобразование в метаболит. Методы определения фермента по «конечной точке» мало чувствительны к изменениям условий реакции, особенно, если они незначительны (рН, температура). Пригодность фермента для оценки активности данным методом можно оценить по константе Михаэлиса: чем меньше константа Михаэлиса, тем выше сродство фермента с субстратом и, тем больше фермент пригоден для определения его активности по «конечной точке». Фермент можно оценить по убыли субстрата в течение определенного промежутка времени протекания ферментативной реакции – метод по «начальной точке» определения фермента. Метод оценки фермента, связанный с изменением концентрации субстрата в малые фиксированные отрезки времени носит название «кинетический метод». При кинетическом методе определяют изменения в нескольких точках за минуту и проводят расчет по формуле Бугера-Ламберта-Бера. При данном способе определения активности фермента возможно "двухточечное измерение" когда на исследуемом участке кривой дважды определяют абсорбцию- в начале и в конце измерения. За единицу активности фермента принимают международную единицу МЕ или Ед, которая представляет количество фермента, катализирующего превращение 1 микромоля (мкмоль или mмоль) субстрата за 1 минуту. Каталитическая активность выражается числом единиц на 1 литр любой биологической жидкости или 1 мг белка – Ед/л или Ед/мг белка. В системе СИ единица фермента – это катал (кат) – количество фермента, катализирующее превращение 1 моля субстрата за 1 секунду. Используют также нанокатал (нкат), или микрокатал (мккат). Активность фермента может быть выражена в нкат/л или нкат/мг белка. 1 Ед/л = 16,67 нкат/л 1 нкат = 0,06 Ед/л
Метаболизм ферментов. Метаболизм ферментов протекает сходно с аналогичными процессами, характерными для других белков. В плазме происходит их инактивация, и дальнейшие превращения ферменты претерпевают в клетках ретикулоэндотелиальной системы, где при участии тканевых протеаз осуществляется их катаболизм. Незначительное количество ферментов уходит через пищеварительный тракт, а также через мочевыводящие пути. Последний путь малоэффективен, так как в норме через почечный фильтр могут проходить соединения с молекулярной массой не более 60-70 кДа. Ферменты, находящиеся в желчи, по большей части имеют эндотелиальное происхождение и не связаны с ферментами плазмы. Ферментология. Ферментология изучает все процессы, связанные с ферментами, рассматривая их структуру, биологическую активность в норме и при патологии, считая, что патология во многом является результатом последовательных нарушений структуры и функции ферментов. Ферментология включает в себя несколько направлений анализа ферментов, каждое из которых имеет свою значимость для жизнедеятельности. Ферменты могут быть использованы в лабораторной практике в качестве высокоочищенных аналитических реагентов для количественного определения метаболитов. Чаще всего они используются в практике клинической лаборатории в виде готовых наборов промышленного производства, которые сопровождаются инструкцией по их применению. Менее специфические ферменты могут быть использованы для тех же целей, но за счет систем, обеспечиваемых сопряженными реакциями, т. е. использования нескольких ферментов, создающих ряд последовательных реакций. Оценка конечного результата проводится разными способами, в том числе и фотометрическими методами. При анализе цельной крови всегда в этих случаях необходима ее депротеинизация, при работе с сывороткой – добавление детергентов.
Ферментопатология. Изучение нарушений ферментов (количественное и качественное) в патогенезе заболеваний определяет все аспекты ферментопатологии. Одна из основных составляющих жизнедеятельности – согласованная деятельность ферментных систем. При нарушении согласованности возникает болезнь. Нарушение ферментативной активности определяется структурной организацией молекулы фермента, ее сохранности как молекулы в целом, так и составных частей: апофермента и кофермента. Причинами ферментопатий служат: 1. отсутствие, недостаток, аномальная структура апофермента за счет: · повреждение или изменение матрицы ДНК, РНК; · недостаток энергообеспечения синтеза; · нарушение этапов регуляции синтеза; · недостаток пластического материала (аминокислот); · повреждение на уровне клеток и клеточных структур. 2. отсутствие, недостаток, аномальная структура коферментов за счет: · нарушения поступления витаминов, коферментов; · нарушение резорбции витаминов в ЖКТ; · нарушение фосфорилирования витаминов в кишечнике; · нарушения, приводящие к гиповитаминозу; · деструкция клеток. Ферментопатии могут быть первичными и вторичными. Первичные ферментопатии являются результатом изменений или аномалий, возникающих на генетическом уровне за счет нарушений в структуре ДНК, процессах транскрипции и трансляции, что является причиной молекулярных болезней. Первичные ферментопатии приводят к отсутствию активного фермента в ткани или органе; резкому снижению активности фермента; и в очень редких случаях к повышению его активности. При отсутствии активного фермента возникают и развиваются наследственные дефекты обмена, при этом происходит накопление неиспользованного субстрата, и в то же время уменьшение продукта реакции, который в свою очередь является субстратом для дальнейших преобразований (следующей реакции) или источником для синтеза биологически активного соединения. При отсутствии активного фермента или значительного снижения его активности при первичных ферментопатиях могут отмечаться нарушения: · со стороны субстрата: v накопление неутилизируемого субстрата в клетках, биологических жидкостях; v нарушение обмена субстрата, как метаболита; v накопление аномальных продуктов обмена субстрата; v развитие вторичного метаболического блока; v интоксикация и нарушение функций организма в целом. Одновременно в случае отсутствия активных форм фермента или значительного снижения его активности возникают нарушения, связанные с продуктом реакции: · уменьшение содержания продукта реакции; · нарушение образования биологически активных веществ (метаболитов); · дефицит биологически активных веществ (метаболитов); · нарушение регуляции метаболических процессов; · нарушение функции жизненно важных органов. Ферментопатии первичного происхождения протекают с различной степенью выраженности. Если субстрат, который накапливается при ферментопатии, не токсичен, а продукт реакции не используется для синтеза биологически активных веществ и, следовательно, не развивается дефицит биологически активных веществ, то ферментопатия чаще всего протекает бессимптомно. Бессимптомные ферментопатии характеризуются отсутствием функциональных расстройств, отсутствием клинических проявлений. Они могут быть обнаружены при обследовании как, например, доброкачественная фруктозурия, почечная глюкозурия.
|
|||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2020-11-11; просмотров: 345; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.217.182.45 (0.117 с.) |
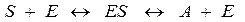
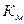 ), так как она может служить показателем активности фермента и катализируемой им реакции. Константа Михаэлиса-Ментен численно равна величине субстрата, при которой скорость ферментативной реакции – половина от максимальной. При низких концентрациях субстрата скорость ферментативной реакции изменяется прямо пропорционально содержанию субстрата, а при высоких концентрациях субстрата она достигает максимума и не меняется, что является результатом насыщения фермента субстратом.
), так как она может служить показателем активности фермента и катализируемой им реакции. Константа Михаэлиса-Ментен численно равна величине субстрата, при которой скорость ферментативной реакции – половина от максимальной. При низких концентрациях субстрата скорость ферментативной реакции изменяется прямо пропорционально содержанию субстрата, а при высоких концентрациях субстрата она достигает максимума и не меняется, что является результатом насыщения фермента субстратом.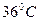 -
- 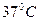 .При проведении измерений активности ферментов необходимо следить за температурой, сохраняя ее постоянство в пределах
.При проведении измерений активности ферментов необходимо следить за температурой, сохраняя ее постоянство в пределах 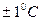 .
.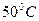 ) активность ферментов снижается, а при дальнейшем повышении температуры может наступить денатурация белка. В настоящее время в справочном материале часто приводят таблицы индивидуальной зависимости активности фермента от изменений температурного режима.
) активность ферментов снижается, а при дальнейшем повышении температуры может наступить денатурация белка. В настоящее время в справочном материале часто приводят таблицы индивидуальной зависимости активности фермента от изменений температурного режима.


