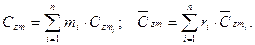Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Первое начало термодинамики как математическоеСодержание книги
Поиск на нашем сайте
Выражение закона сохранения энергии Первое начало термодинамики — математическое выражение закона сохранения и превращения энергии применительно к тепловым процессам в его наиболее общей форме. Открытию закона сохранения и превращения энергии предшествовали многочисленные экспериментальные и теоретические исследования в области физики и химии, развитие принципа, исключающего построение вечного двигателя первого рода (1775 г.), открытие закона Гесса (1840 г.) и принципа эквивалентности (1842-1850 гг.) как завершающего этапа в открытии закона сохранения энергии. Суть I начала термодинамики заключается в том, что работа может совершаться только за счет теплоты или какой-либо другой формы энергии. Внутренняя энергия системы является однозначной функцией ее состояния и изменяется только под влиянием внешних воздействий. При этом все возможные виды внешнего энергетического взаимодействия сводятся лишь к передаче теплоты и работы. Это значит, что изменение внутренней энергии тела или системы тел (DU=U2-U1) равно алгебраической сумме подведенных извне количеств теплоты Q*1,2 и внешней работы (L*1,2), выполненной телом в процессе. U2-U1=Q*1,2-AL*1,2; (3.31) Q*1,2=U2-U1+AL*1,2 (3.32) или в дифференциальной форме: dQ*=dU+A×dL*, (3.33) где А — тепловой эквивалент работы (далее его опускаем). А=1 Дж/(Н×м) в системе СИ; в МКСС А=1/427 ккал/(кг×м). Уравнения первого начала термодинамики в приведенной форме называются уравнениями первого начала термодинамики по внешнему балансу теплоты и работы. Действительно, приведенные уравнения отражают только взаимодействие тел с окружающей системой. Они не учитывают и не отражают те необратимые потери, которые есть в реальных условиях взаимодействия тела с окружающей средой. Внешняя (эффективная) работа dL* определяется разностью термодинамической работы dL и необратимых потерь работы dL**: dL*=dL-dL**. (3.34) Потерянная в необратимых процессах работа dL** полностью превращается в теплоту внутреннего теплообмена dQ**, которая передается этому же телу или телам внешней системы dL**=dQ**>0. (3.35)
Следовательно, полное количество теплоты dQ, полученное телом, будет определяться как сумма теплоты dQ*, подведенной извне, и теплоты внутреннего теплообмена dQ**: dQ=dQ*+dQ** или dQ=dQ*+dQ**=dU+dL*+dL**; dL*+dL**=dL; dQ=dQ*+dQ**=dU+dL. (3.36) Последнее уравнение называется уравнением первого начала по балансу рабочего тела. Оно может использоваться для анализа реальных процессов. Первое начало термодинамики простого тела Простым телом называют тело, состояние которого вполне определяется двумя независимыми переменными (Р, u; u, t; Р, t). Для таких тел термодинамическая работа определяется как обратимая работа изменения объема: dL=P×dV; d l =dL/G=P×du. При изучении процессов перемещения газов или жидкостей из области одного давления в область другого в расчеты вводится потенциальная работа: dw = -u×dP = P×du-d(Pu). I начало термодинамики по балансу рабочего тела для замкнутого пространства и единицы количества вещества запишется: dq=dq*+dq**=dU+d l =dh+dw=dU+P×du=dh-u×dP, (3.37) где h=U+P×u — энтальпия (см. параграф 3.1.2). По внешнему балансу теплоты и работы запишется: Q*1,2=dU+d l *=dh+dw*. (3.38) Понятие теплоёмкости Теплоемкостью называется отношение количества тепла по балансу рабочего тела к изменению температуры этого тела в рассматриваемом процессе (z), включающем внешний и внутренний теплообмен.
Величина qz в уравнении зависит не только от интервала температур t2 — t1, но и от вида процесса подвода теплоты. Индекс z обозначает тот параметр, который сохраняется постоянным в данном процессе. В термодинамике обычно пользуются понятием теплоемкости при Р=idem и u=idem. u=idem P=idem Различают теплоемкость массовую, мольную и объемную: массовая теплоемкость: Cz Дж/(кг×К); мольная теплоемкость: объемная теплоемкость: средняя теплоемкость: Сzm Если Сz является линейной функцией от температуры, то Cz=a0+ +a1×tma, т. е. Сzm=Cz(tma). Например, в (h, t) координатах при P=idem (рис. 3.9): Сp=tgj=
Рис. 3.9. Определение массовой тепло- емкости при постоянном давлении Если теплоемкость не является линейной функцией от температуры, то осреднение производится известными методами Гаусса, Чебышева, Ньютона. В случае смеси идеальных газов в расчетные соотношения термодинамики входит теплоемкость смеси.
Рис. 3.10. Схемы смешения при постоянном объеме и давлении Различают две схемы смешения: при V=idem и P=idem (рис. 3.10). При V=idem смешение осуществляется при неизменном уровне внутренней энергии, а при P=idem — при неизменном уровне энтальпии. На основании I начала термодинамики определяется средняя температура смеси:
где
|
||||||
|
Последнее изменение этой страницы: 2020-10-24; просмотров: 198; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.145.214.68 (0.007 с.) |

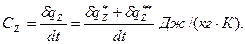 (3.39)
(3.39)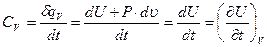 , (3.40)
, (3.40)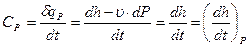 . (3.41)
. (3.41)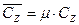 Дж/(кмоль×К);
Дж/(кмоль×К);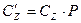 Дж/(м3×К);
Дж/(м3×К);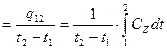
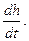
 Средняя теплоемкость определяется из уравнения по таблицам средних теплоемкостей. Меньшие интервалы находятся методом интерполирования.
Средняя теплоемкость определяется из уравнения по таблицам средних теплоемкостей. Меньшие интервалы находятся методом интерполирования.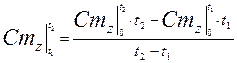 (3.42)
(3.42)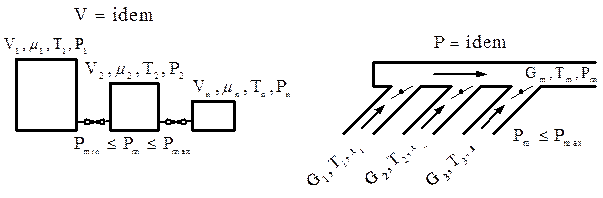
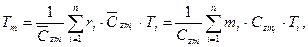
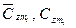 — средние мольные (объемные) и весовые теплоемкости компонентов в интервале температур (Ti — Tm) берутся из справочных таблиц;
— средние мольные (объемные) и весовые теплоемкости компонентов в интервале температур (Ti — Tm) берутся из справочных таблиц;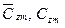 — средние мольные (объемные) и весовые теплоемкости смеси в том же интервале температур (Ti — Tm):
— средние мольные (объемные) и весовые теплоемкости смеси в том же интервале температур (Ti — Tm):