
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Г.А. Тихановская, Е.А. ФокичеваСодержание книги
Поиск на нашем сайте
Г.А. Тихановская, Е.А. Фокичева
ФИЗИКО-ХИМИЧЕСКИЕ ОСНОВЫ РАЗВИТИЯ И ТУШЕНИЯ ПОЖАРОВ Часть 1 Утверждено редакционно - издательским советом ВоГТУ в качестве учебного пособия
Вологда УДК ББК Т
Рецензенты: Т.Л. Бланк, канд. хим. наук, доцент Вологодской молочнохозяйственной академии им. Н.В. Верещагина; М.Б. Гусев, главный эксперт ЭКЦ УМВД России по Вологодской области Тихановская, Г.А. Физико-химические основы развития и тушения пожаров: учеб. пособие / Г.А. Тихановская, Е.А. Фокичева. – Вологда: ВоГТУ, 2012. - 109 с.
Учебное пособие по курсу «Физико-химические основы развития и тушения пожаров» часть I предназначено для студентов направления бакалавриата 280700 «Техносферная безопасность», профиль «Защита в чрезвычайных ситуациях». Пособие составлено в соответствии с программой курса и может быть использовано как руководство для самостоятельной работы студентов. В пособии включено краткое изложение курса по теме «Горение», руководство к лабораторным работам и тематические тесты для проверки знаний. Может быть использовано как при текущей проверке усвоения материала, так и при подготовке к экзаменам студентами направления «Техносферная безопасность».
УДК ББК
ВоГТУ, 2012 Тихановская Г.А., Фокичева Е.А. 2012 ПРЕДИСЛОВИЕ Учебное пособие «Физико-химические основы развития и тушения пожаров» составлено для студентов направления бакалавриата «Техносферная безопасность», профиль «Защита в чрезвычайных ситуациях». Пособие включает общетеоретические основы курса, теоретические вопросы и методологию изучения процессов горения и пожаротушения. Тематические тесты затрагивают все аспекты рассматриваемого курса и могут быть использованы для закрепления материала и при подготовке к экзаменам. ВВЕДЕНИЕ Горение используется человеком на протяжении более миллиона лет и является одной из древнейших технологий. В настоящее время около 90% всей энергии, потребляемой нашей цивилизацией (выработка электроэнергии, получение топлива, транспорт и т.д.), обеспечивается процессами горения. Но неконтролируемый процесс горения (пожар) обладает огромной разрушающей силой и приводит к катастрофическим последствиям. Пожары – самые распространенные чрезвычайные происшествия. Действие их многостороннее: взрывы, обрушения конструкций, радиационное и химическое загрязнение атмосферы, почвы, гибель флоры и фауны. Пожары сопровождаются потреблением кислорода из воздуха, образованием продуктов горения, в том числе и токсичных, и поступление их в атмосферу, использованием воды для целей пожаротушения, распространением водяных паров и отработанной воды с растворенными в них токсичными продуктами на обширную территорию. В основе большинства из указанных процессов лежат физико-химические закономерности, поэтому является необходимым рассмотрение фундаментальных концепций, связанных с вопросами химии горения, стехиометрическими расчетами, законами термодинамики, теории скоростей химических реакций и т.д. А также прикладное значение вышеуказанных закономерностей для классификации пожаров, определения средств пожаротушения и оптимизации действия пожаров и их последствия для людей и окружающей среды. В связи с этим в данном пособии рассматриваются общетеоретические основы курса, агрегатные состояния веществ, термодинамические законы, материальный и тепловой баланс процессов горения. А также явления, сопровождающие пожар, динамика развития пожара и опасные факторы пожара. ОБЩЕТЕОРЕТИЧЕСКИЕ ОСНОВЫ КУРСА Агрегатные состояния Состояние данной массы газа определяется тремя величинами (параметрами): давлением p, объемом V и температурой T. Эти величины связаны между собой функциональной зависимостью, которая может быть представлена соотношением f (p, V, T) = 0, называемым уравнением состояния. Уравнение состояния идеального газа выводится из трех законов – Бойля – Мариотта, Гей-Люссака и Авогадро. Реальные газы подчиняются этим законам тем точнее, чем меньше давление и выше температура [1]. Закон Бойля – Мариотта. При постоянной температуре объем данной массы обратно пропорционален давлению. Если V1 и V2 – объемы газа при давлении p1 и p2 соответственно, то
Из закона Бойля – Мариотта вытекает следствие: при постоянной температуре плотность газа ρ пропорционально его давлению:
Законы Гей-Люссака и Шарля. При постоянном давлении с повышением температуры на 1°С объем данной массы газа увеличивается на 1/273,15 его объема при 0°С:
где V – объем газа при температуре t °С, а V0 – объем газа при 0°С. При замене шкалы Цельсия абсолютной температурной шкалой (шкалой Кельвина), для которой T= 273,15+ t, этот закон можно сформулировать следующим образом: при постоянном давлении объем данной массы газа пропорционален его абсолютной температуре:
где V1 и V2 – объемы газа при абсолютных температурах T1 и T2 При постоянном объеме зависимость давления данной массы газа от температуры записывается уравнениями, аналогичными (1.2) и (1.3):
Объединенный закон Бойля – Мариотта – Гей-Люссака выражается уравнением:
где p1 – давление и V1 – объем данной массы газа при абсолютной температуре T1, p2 - давление и V2 – объем той же массы газа при абсолютной температуре T2. Закон Авогадро: в равных объемах различных газов при одинаковых условиях содержится равное число молекул. Число молекул (NA) в 1 моль вещества одинаково у всех веществ и равно 6,02·1023 (число Авогадро). Следовательно, количества веществ 1 моль, находящихся в газообразном состоянии при одинаковой температуре и одинаковом давлении, занимают равные объемы. При нормальных условиях (температура 0°С и давление = 1,01325·105 Па) объем 1 моль газа равен 22,414л. Уравнение состояния идеального газа – уравнение Менделеева – Клайперона для одного моля газа имеет вид:
а для любого количества газообразного вещества:
где R – универсальная газовая постоянная, числовое значение которой зависит от единиц измерения других величин. Величина ее выражается в единицах СИ Дж/(моль·К). Уравнение (1.8) может быть использовано для определения относительной молекулярной массы Мч. Заменяя в нем величину n отношением m/M, где m – масса газа, а M – молярная масса данного газа, и решая его относительно M, получим:
Закон Дальтона: общее давление смеси газов равно сумме парциальных давлений составных частей (компонентов):
где p об – общее давление смеси газов, p1, p2, pk – парциальные давления компонентов смеси. Парциальным давлением называется давление каждого компонента, если бы он один занимал объем, равный объему смеси той же температуре. Уравнения (1.8) и (1.9) применимы к смесям газов, химически не взаимодействующих друг с другом, а также к каждому компоненту смеси. В первом случае n – общее количество вещества компонентов (n=n1+n2+…+nk=∑ni, где i=1, 2, …, k), M – средняя «смешанная» молярная масса, во втором случае n – количество вещества каждого компонента, т.е. n1, n2, …, nk, p – парциальное давление компонента, V – общий объем смеси. Зависимость между парциальными давлениями и общим выражается уравнениями:
Отношения n1/∑ni, n2/∑ni, …, nk/∑ni, называют молярными долями данного компонента. Если молярную долю обозначить через x, то парциальное давление любого i -го компонента смеси (где i = 1, 2, …, k) будет равно:
Таким образом, парциальное давление каждого компонента равно произведению его молярной доли на общее давление смеси. Для идеальных газов молярная доля x равна объемной доле φ (V1/∑υi, V2/∑υi, …, Vk/∑υi). Если состав смеси выражен в объемных долях (%), то φ' φ1'/100 = x1, φ2'/100 = x2, …, φ k '/100 = xk, (1.12) Кинетическая теория газов. Основным уравнением кинетической теории газов для 1 моль является уравнение:
где ma – масса молекулы; ū – средняя квадратичная скорость молекул; NA – число молекул в 1 моль. Для любого количества вещества в уравнении вместо NA входит N. Из основного уравнения кинетической теории газов можно вывести изложенные выше газовые законы и некоторые новые положения. Сопоставляя уравнения (1.7) и (1.13) получим для 1 моль газа:
1. Отсюда находим среднюю квадратичную скорость молекул:
где M = NA·ma – молярная масса газа. Из этого уравнения следует, что для одного и того же газа средняя квадратичная скорость молекул прямо пропорциональна корню квадратному из абсолютной температуры:
где ū1 – средняя квадратичная скорость при температуре T1, а ū2 – то же самое при T2. Для различных газов при одинаковой температуре средняя квадратичная скорость молекул обратно пропорциональна корню квадратному из относительных молекулярных масс:
Здесь ū1 и 2. Из уравнения (1.14) находим:
Выражение, стоящее в левой части этого равенства, есть средняя кинетическая энергия поступательного движения молекул идеального газа в количестве вещества 1 моль. Обозначив ее через Е, получим:
Разделив обе части уравнения (1.18) на NA, найдем, что средняя кинетическая энергия поступательного движения одной молекулы газа равна:
где Следовательно, кинетическая энергия идеального газа пропорциональна абсолютной температуре. Примеры 1. В баллоне емкостью 20 л находится водород под давлением 162·105 Па. Сколько шаров-пилотов можно наполнить водородом, если объем шара равен 200 л и давление в нем должно быть равно 2·105 Па? Водород при этих условиях считать идеальным газом. Решение. Так как температура и масса газа остаются постоянными, то для решения задачи применим закон Бойля – Мариотта (1.1). После наполнения шаров-пилотов объем водорода (V2) буде равен:
где V3 – объем одного шара; n – число шаров; V1 – объем баллона, в котором водород после наполнения последнего шара находится под давлением 2·105 Па. Заменив в уравнении (1.1) V2 его значением, получим:
Отсюда
Находим, что водородом можно наполнить восемь шаров-пилотов. 2. При нормальных условиях плотность азота равна 1,25 г/л. Определить плотность газа при 0°С и давлении 5,065·105 Па. Решение. Требуется определить плотность азота при 0°С и давлении 5,065·105 Па. Из уравнения (I, 1а) находим ρ2 – плотность при давлении p2:
3. При постоянном давлении открытая двухлитровая колба охлаждается от 200 до 0°С. Насколько увеличится масса воздуха в колбе, если плотность воздуха при нормальных условиях равна 1,293 г/л? Изменением объема колбы вследствие охлаждения стекла пренебречь. Решение. Объем одного и того же количества газа согласно закону Гей-Люссака при 0°С должен быть меньше, чем при 200°С. Если при t2 = 0°С его объем V2 = 2 л, то при t1 = 200°Сон может быть определен из уравнения (1.3):
При 0°С масса газа в двухлитровой колбе равна 1,293x2=2,586 (г). При 200°С такую же массу будет иметь 3,465 л. Таким образом, если температура понизится с 200°С до 0°С, то в колбу войдет 3,465-2=1,465 (л) воздуха; соответствующая масса может быть определена из пропорции:
Следовательно, масса газа в колбе увеличится на 1,093 г. 4. Смесь эквивалентных количеств этана и кислорода находится в замкнутом сосуде при температуре 15°С и давлении 1·105 Па. Каково будет давление после взрыва смеси и приведения содержимого сосуда к первоначальной температуре? Решение. Напишем уравнение реакции горения этана: 2С2Н6 + 7О2 = 4СО2 + 6Н2О Вода при температуре 15°С будет в жидком состоянии, и при подсчета числа молекул не нужно учитывать образовавшихся молекул воды (так как объем жидкости по сравнению с объемом газа той же массы несоизмеримо мал). Из уравнения следует, что из 9 молекул исходных веществ образовалось 4 молекулы. Так как объем газов и температура остаются постоянными, то с уменьшением числа молекул в 9/4 раза и давление должно уменьшиться в такое же число раз, т.е. оно будет равно: 1·105:9/4=0,4·105 Па. 5. Для хлорирования питьевой воды хлор доставляется в баллонах под давлением. Давление в этих баллонах равно,722·105 Па при 0°С и 15,47·105 Па при 30°С. Можно ли считать хлор в этих условиях идеальным газом? Решение. Так как в баллоне объем постоянен, то для идеального газа, как следует из уравнения (I, 5), 6. При температуре 18°С и давлении 98,64 кПа объем газа равен 2 л. Привести объем газа к равным нормальным условиям. Решение. Из уравнения (1.6) находим V1 – объем при нормальном давлении 1,013·105 Па и температуре 273 К. Данные задачи переводим в единицы СИ:
7. Вычислить при нормальных условиях газовую постоянную R, выразив ее в: а) Па·м3/(моль·К); б) Дж/(моль·К). Решение. Из уравнения (1.7) находим: а) б) 8,314 Па·м3/(моль·К) = 8,314 Н/м2 · м3/(моль·К) = 8,314 Дж/(моль·К). 8. Какое количество вещества и какая масса кислорода находится в газометре емкостью 10 л при 20°С и под давлением 100 кПа? Решение. Решаем уравнение (1.8) относительно n:
m = nM; m = 0,41 · 32 = 13,12 (г) 9. По методу В. Майера определялась относительная молекулярная масса этилового эфира. При испарении эфира массой 0,0856 г его пары вытеснили в эвдиометрическую трубку воздух объемом 29,2 мл; высота водяного столба в эвдиометрической трубке 22,5 см, температура воздуха 17°С, атмосферное давление 1005 гПа. Давление насыщенного пара воды при 17°С равно 19,37гПа. Вычислить относительную молекулярную массу эфира и найти относительную ошибку опыта в процентах. Решение. Давление сухого воздуха, заключенного в эвдиометрической трубке, будет равно:
где 1 – значение плотности воды и 13,6 – значение плотности ртути. Подставляем в уравнение (I, 9) соответствующие значения, выразив их в единицах СИ, получаем:
Таким образом, относительная молекулярная масса эфира равна 72,94. Относительная ошибка в процентах равна: (74,08-72,94)·100:74,08-1,54 % где 74,08 – табличная величина относительной молекулярной массы эфира. 10. Смешаны водород объемом 3 л и под давлением 2·105 Па с кислородом объемом 2 л под давлением 1·105 Па. Общий объем смеси равен 4 л. Определить парциальные давления газов и общее давление смеси. Решение. Водород, занимавший объем V1, равный 3 л, при давлении p1 равном 2·105 Па, после смешивания с кислородом распространится в объеме V2, равном 4 л. Парциальное давление водорода, равное p2, находим из закона Бойля – Мариотта (1.1):
Парциальное давление кислорода находим аналогичным способом:
Общее давление p смеси равно: 1,5·105 + 0,5·105 = 2·105 (Па). 11. Смесь из 2 моль азота, 3 моль кислорода и некоторого количества вещества аммиака при 20°С и давлении 4·105 Па занимает объем 40 дм3. Вычислить количество аммиака в смеси и парциальное давление каждого из газов. Решение. Из уравнения (1.8) находим n – общее количество всех газообразных веществ, составляющих смесь, и подставляем R, равное 8,314 Дж/(моль·К), p = 4·105 Па, V = 4·10-2 м3, T =273+20 = 293 К:
Количество вещества аммиака n (NH3) = 6,57 – 2 – 3 = 1,57 (моль) Парциальное давление газов вычисляем по уравнению (1.11а): p (N2) = 4·105 · 2: 6,57 = 1,217·105 (Па); p (O2) = 4·105 · 3: 6,57 =1,826·105 (Па); p (NH3) = 4 · 105 · 1,57: 6,57 =0,956·105 (Па). 12. 0,5 моль водорода и 0,25 моль азота находятся в газометре вместимостью 5 л при 10°С. Вычислить парциальное давление каждого из газов и состав смеси в объемных долях. Решение. Парциальное давление каждого компонента находим из уравнения (1.8):
По формуле (1.12) вычисляем содержание водорода и азота в объемных долях:
13. Какое давление будет иметь при 0°С кислород объемом 10 л и количеством вещества 0,25 моль? Средняя квадратичная скорость молекул кислорода при этой температуре равна 461 м/с. Решение. Из формулы (1.13) находим давление, подставляя значения в единицах СИ: 10 л равны 0,01 м3, масса газа (N·ma) равна произведению молярной массы на количество вещества, т.е. 0,032 кг/моль · 0,25 моль = 0,008 кг:
14. При какой температуре средняя квадратичная скорость молекул хлора будет равна 500 м/с? Решение. Из формулы (1.14) находим T:
Подставляем значения, выражая их в СИ: ū в м/с, М в кг/моль, а R в Дж/(моль·К), и получаем:
Следовательно, температура t будет равна: 711,7 – 273 = 483,7 (°С) Химическая термодинамика Первый закон термодинамики Первый закон термодинамики есть закон сохранения энергии в применении его к термодинамическим процессам. Можно дать несколько, по существу равноценных, формулировок этого закона: а) общая энергия изолированной системы остается постоянной независимо от каких бы то ни было изменений, происходящих в этой системе; б) изменение внутренней энергии системы (∆U) равно разности между количеством сообщенной системе теплоты q и количеством работы А, совершенной системой. Математическое выражение первого закона термодинамики будет иметь вид: ∆U = q - A (2.1) q - считается положительной, если теплота поглощается системой, и отрицательной, если теплота выделяется [2]. Из первого закона термодинамики вытекает ряд следствий, имеющих большое значение для физической химии и решения различных технологических задач. Мы ограничимся применением первого закона термодинамики только для идеальных газов и рассмотрим важнейшие процессы: изохорический, изобарический, изотермический и адиабатический. Изохорический процесс Изохорический процесс протекает при постоянном объеме, поэтому система никакой работы не совершает. В этом случае вся теплота расходуется на увеличение внутренней энергии системы. Если V - соnst, то A=0, тогда qV = ∆U При изохорическом процессе количество теплоты, получаемое системой, можно вычислить по уравнениям: qV = пСV(Т2 – T1); (2.2) гдеn — количество вещества; р1 и р2 — соответственно начальное и конечное давление системы; — молярная теплоемкость при постоянном объеме; T1 — начальная температура; T2 — конечная температура. Изобарический процесс Если теплота поглощается системойпри постоянном давлении, то в системе соответственно увеличивается энтальпия. Если р = const, то Количество теплоты, получаемое системой в этих условиях, может быть вычислено по уравнениям: qр = nСр (Т2 – T1), (2.5) qp = где Ср — молярная теплоемкость при постоянном давлении; V1 и V2 -соответственно начальный и конечный объем системы. Работа при изобарическом процессе выражается уравнением: A=р(V2 - V1) (2.7) Изотермический процесс Если совершается изотермический процесс, то внутренняя энергия системы при этом не меняется. Вся сообщаемая теплота расходуется на работу по расширению системы. Если T = сonst, то ∆U = 0, тогда q = A. Работа изотермического расширения системы может быть вычислена по уравнениям: А = nRТ -2,3 lg A = nRТ -2,3 lg Адиабатический процесс При адиабатическом процессе теплообмен между данной системой и окружающей средой отсутствует, поэтому q = 0. При этом система может совершать работу только за счет убыли внутренней энергии: А = -∆U. Работа в этом случае может быть вычислена по одному из следующих уравнений: A= пСv (T1— T2), (2.10) A = A = ϒ = Связь между давлением, объемом и температурой в начале и конце адиабатического процесса выражается уравнениями: p1V1ϒ = p2V2ϒ; (2.14) T1V1ϒ-1 = T2V2ϒ-1; (2.15) Для одноатомных газов Cv = Следовательно,
Для двухатомных газов Cv = Отсюда
Примеры 1. Путем нагревания при постоянном давлении в 1,013∙105 Па газу сообщено 2093,4 Дж теплоты. Определить изменение внутренней энергии этого газа, если он при этом расширился от 0,01 до 0,02 м3. Решение: Согласно первому закону термодинамики ∆U = q - А. Работа, совершенная газом при изобарическом расширении, может быть вычислена по уравнению (2.7): А = р (V2 — V1); А = 1,013. 105 Па • (0,02 м3 - 0,01 м3) = 1013 Дж Отсюда ∆U = 2093,4 - 1013 = 1080,4 (Дж). 2. Гелий массой 75 г нагревали при температуре 100 °С и давлении 1,013 • 105 Па. Вычислить количество затраченной теплоты, если объем газа изменился от 3 до 15 л. Решение: Так как нагревание газа происходит изотермически и изобарически, то количество затраченной теплоты можно вычислить по уравнению (2.6), только дополнительно необходимо определить количество вещества п и молярную теплоемкость гелия при постоянном давлении: n (Не) = Гелий — одноатомный газ, поэтому согласно формуле (2.16) Ср = qp = qp = 18,75•20,79•373/3• (15 – 3) = 581600 (Дж) или 582 кДж 3. Определить работу, совершаемую азотом при изотермическом (20 ºС) расширении его от 0,015 до 0,1 м3, если начальное давление было 3,039 • 105 Па. Каково будет конечное давление? Решение. Для изотермического процесса работа расширения газа может быть вычислена по уравнению (2.8). Количество вещества азота находим из уравнения состояния идеального газа: pV = nRТ; n(N2) = n(N2) = А = пКТ • 2,3lg А= 1,875 • 8,314 • 293 • 2,3 lg Конечное давление газа при постоянной температуре и известном объеме находим по закону Бойля — Мариотта:
Отсюда p2 = p2 = 4. Сколько нужно затратить теплоты, чтобы изохорически нагреть кислород массой 25 г от 0 до 50 °С? Решение. При изохорическом процессе газ никакой работы не совершает, поэтому вся подводимая к газу теплота расходуется на его нагревание. Согласно уравнению (2.2) qv = nCv(T2 – T1); п (02) = Для двухатомного газа Cv = С = 2,5 • 8,314 = 20,79 (Дж); qv = 0,781 • 20,79 • (323 — 273) = 812 (Дж) 5. Навеску водорода массой 0,5 г, взятую при 25 °С, адиабатически сжимают от 6 до 2 л. Определить конечную температуру газа и работу, затраченную на его сжатие. Решение. Связь между объемом и температурой адиабатического процесса показывает уравнение (2.14): T1V1ϒ-1 = T2V1ϒ-1 Для двухатомного газа ϒ = 1,40. Из уравнения (2.14) находим Т2: Т2 = lgT2 = lg 298 + 0,4lg 6 – 0,4lg2 = 2,6651; T2 = 462,5K Для определения затраченной работы применим уравнение (2.10): А = пСv (T1 — T2); п (Н2) = Для двухатомного газа Сv = А = 0,25 • 20,79 • (298 — 462,5) = -855 (Дж) Термохимия Тепловым эффектом реакции называют теплоту, выделенную или поглощенную в ходе химической реакции, протекающей необратимо при постоянном давлении или постоянном объеме, причем температура исходных веществ (исх) и продуктов реакции (прод) одна и та же. В термодинамике положительной считают ту теплоту, которую подводят к системе (эта теплота поглощается системой), а отрицательной - ту, которую система выделяет. В термохимии приняты обратные обозначения. Тепловой эффект химической реакции относят обычно к 1 моль образовавшегося вещества (обр). С этой целью нередко в термохимических уравнениях коэффициенты следует брать дробными. Из первого закона термодинамики (2.1) следует: qv = ∆U; qv = ∆H. Таким образом, тепловой эффект химической реакции при постоянном объеме представляет собой изменение внутренней энергии системы ∆U, а при постоянном давлении — изменение энтальпии ∆H. Разница между∆H и ∆U мала, если реакция идет между жидкими или твердыми веществами. В случае реакций с участием газообразных веществ это различие заметно. Если в реакции участвует п1 моль, а получается п2 моль газообразных веществ, то ∆H = ∆U +RT (n2 — n1) (2.20) В термохимии чаще имеют дело с ∆Н. Основным законом термохимии является закон Гесса (1840) — частный случай первого закона термодинамики: если процесс идет при постоянном давлении или при постоянном объеме, то тепловой эффект химической реакции зависит только от начального и конечного состояния реагирующих веществ и не зависит от пути, по которому реакция протекает. Из закона Гесса вытекают следствия: 1. Тепловой эффект химической реакции равен разности между суммой теплот образования получающихся веществ и суммой теплот образования вступающих в реакцию веществ (с учетом их стехио- метрических коэффициентов): ∆Н реакц = ∑( ∆Нобр)прод - ∑( ∆Н обр)исх (2. 21) 2. Тепловой эффект химической реакции равен разности между суммой теплот сгорания (сгор) исходных веществ и суммой теплот сгорания продуктов реакции (с учетом их стехиометрических коэффициентов): ∆Н реакц = ∑(∆Hсгор)исх - ∑(∆Hсгор)прод (2.22) Величины стандартных теплот образования и теплот сгорания находят в справочниках. Значение закона Гесса состоит в том, что он позволяет определить тепловые эффекты таких реакций, которые или нереализуемы, или не могут быть проведены чисто, т. е. без побочных процессов [2]. При растворении кристаллогидратов наблюдается более низкий тепловой эффект, чем при растворении безводной соли. Разность между теплотой растворения безводной соли ∆Hбезв и теплотой растворения ее кристаллогидрата ∆Hкр есть теплота гидратации ∆Hгидр: ∆Нгидр = ∆Нбезв - ∆Нкр (2.23) Примеры 1. Реакция горения ацетилена при стандартных условиях выражается уравнением: С2Н2 + 2 Определить теплоту образования ацетилена при постоянном давлении. Решение. Для решения задачи данный химический процесс следует разбить на отдельные промежуточные стадии: 1) разложение ацетилена на углерод и водород: С2Н2 = 2С + Н2 + ∆ Нх 2) образование углекислого газа из углерода и кислорода: 2С + 202 = 2С02 - 2 • 393,77 кДж 3) образование жидкой воды из водорода и кислорода: Н2 + Сумма тепловых эффектов всех стадий этого процесса и должна равняться общему тепловому эффекту горения ацетилена: ∆ Нх - 787,54 - 285,96 = - 1300 ∆ Нх = -226,5 кДж, ∆ Нх - теплота разложения ацетилена; следовательно, теплота образования ацетилена при стандартных условиях ∆Нº298 равна 226,5 кДж. Теплоту образования ацетилена также можно определить, используя следствие из закона Гесса (2.21), т. е. теплота горения ацетилена будет равна сумме теплот образования 2 моль углекислого газа и 1 моль воды (жидкой) минус теплота образования 1 моль ацетилена: -2 • 393,77 - 285,96 - ∆Нº298 = -1300; ∆Нº298 = 226,5 кДж 2. Процесс алюминотермии выражается химическим уравнением: 8А1 + ЗFe304 = 4А1203 + 9Fe + ∆ Н Рассчитать, сколько выделится теплоты при сгорании 1 кг термита. Решение. По теплотам образования участвующих в реакции веществ определим тепловой эффект реакции в целом. Для этого рассмотрим отдельно каждую стадию процесса: 1) ЗFе304 = 9Fе + 602 + 3 • 1117,82 кДж; 2) 8А1 + 602 - 4А1203 - 4 • 1670,5 кДж. Алгебраическая сумма всех стадий процесса и будет составлять тепловой эффект реакции: ∆H = 3 • 1117,82 — 4 • 1670,5 = -3328,5 кДж Из уравнения реакции следует, что 3328, 5 кДж теплоты выделяется при взаимодействии алюминия массой 216 г (8 • 27) и магнетита массой 696 г (3 • 232), т. е. при сгорании термита массой 912 г. При сгорании термита массой 1000 г выделится х кДж: 912: 1000 = -3328,5: х; х = -365 (кДж) 3. Вычислить тепловой эффект при постоянном давлении и постоянном объеме в стандартных условиях реакции: С2Н5ОНж + 02 = СН3СООНж + Н2Ож Решение. Тепловой эффект реакции может быть рассчитан по теплотам образования участвующих в реакции веществ (2.21). Но в данном случае удобнее его рассчитать по тепловым эффектам сгорания (2.22). В справочнике находим тепловые эффекты полного сгорания всех реагирующих веществ в кислороде. Теплота сгорания этилового спирта равна — 1367,7 кДж. Теплота сгорания СН3СООНж равна — 872,1 кДж. Теплота сгорания Н2Ож равна нулю, так как она высший оксид, продукт полного сгорания водорода в кислороде: ∆Нреакц = - 1367,7 - (-872,1) = - 495,6 (кДж/моль) ∆Uº289 рассчитываем по уравнению (2.20), но предварительно килоджоули переведем в джоули: ∆Uº289 = -495600 – 8,314 • 298 • (0 - 1); ∆Uº289 = - 493 (кДж) 4. На сколько градусов повысится температура при растворении 0,5 моль серной кислоты в воде массой 400 г, если теплота растворения серной кислоты равна — 74,94 кДж, а удельная теплоемкость раствора равна 3,77 Дж/(г • К)? Реш
|
||||
|
Последнее изменение этой страницы: 2017-02-22; просмотров: 348; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.15.202.169 (0.012 с.) |


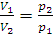
 , или
, или  (1.1)
(1.1)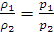 (1.1a)
(1.1a) (1.2)
(1.2) (1.3)
(1.3) (1.4)
(1.4) (1.5)
(1.5) (1.6)
(1.6) (1.7)
(1.7)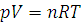 (1.8)
(1.8) (1.9)
(1.9)
 (1.10)
(1.10) ,
,  , …,
, …,  (1.11а)
(1.11а) (1.11б)
(1.11б)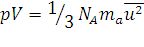 , (1.13)
, (1.13) , (1.14)
, (1.14) (1.15)
(1.15) (1.16)
(1.16) (1.17)
(1.17) относятся к первому газу, а ū2 и
относятся к первому газу, а ū2 и  - ко второму.
- ко второму. (1.18)
(1.18) (1.19)
(1.19) (1.20)
(1.20) , а
, а  - константа, называемая постоянной Больцмана.
- константа, называемая постоянной Больцмана.


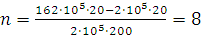
 ;
; 
 ;
; 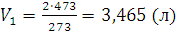
 ;
; 
 - величина постоянная. Вычисляем это отношение для хлора: при 0°С
- величина постоянная. Вычисляем это отношение для хлора: при 0°С  , а при 30°С
, а при 30°С  . Оно непостоянно. Следовательно, хлор в этих условиях считать идеальным газом нельзя.
. Оно непостоянно. Следовательно, хлор в этих условиях считать идеальным газом нельзя. ;
; 
 . Подставляем в эту формулу числовые значения: p= 1.01325·105Па, Т -273,15 К и Vm =2,2414·10-2 м3 (молярный объем газа):
. Подставляем в эту формулу числовые значения: p= 1.01325·105Па, Т -273,15 К и Vm =2,2414·10-2 м3 (молярный объем газа): ;
; . Данные задач подставляем в уравнение в единицах СИ: R =8,314 Дж/(моль·К), p =1·105 Па, Т =273+20=293 К, V =0,01 м3:
. Данные задач подставляем в уравнение в единицах СИ: R =8,314 Дж/(моль·К), p =1·105 Па, Т =273+20=293 К, V =0,01 м3:


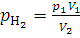 ;
;  .
.

 ;
;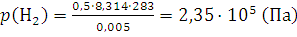

 ;
;
 ;
; 

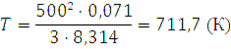
 (V2 –V1) (2.6)
(V2 –V1) (2.6) ; (2.8)
; (2.8) (2.9)
(2.9) , (2.11)
, (2.11) (T1 – T2), (2.12)
(T1 – T2), (2.12) (2.13)
(2.13) R, а Cp =
R, а Cp =  R (2.16)
R (2.16) = ϒ; ϒ = 1,67 (2.17)
= ϒ; ϒ = 1,67 (2.17) R (2.18)
R (2.18) = ϒ = 1,40 (2.19)
= ϒ = 1,40 (2.19) 18,75 (моль)
18,75 (моль) ;
; = 1,875 (моль)
= 1,875 (моль)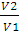 ;
; = 8657 (Дж)
= 8657 (Дж)
 ;
; = 45600 (Па)
= 45600 (Па) = 0,781 (моль)
= 0,781 (моль)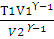 ; T2 =
; T2 = 
 = 0,25 (моль)
= 0,25 (моль) 8,314 = 20,79 (Дж);
8,314 = 20,79 (Дж); 02 = 2С02+ Н2Ож, ∆Н = -1300 кДж
02 = 2С02+ Н2Ож, ∆Н = -1300 кДж 02 = Н2Ож - 285,96 кДж
02 = Н2Ож - 285,96 кДж


