Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Химические процессы в тропосфереСодержание книги
Поиск на нашем сайте
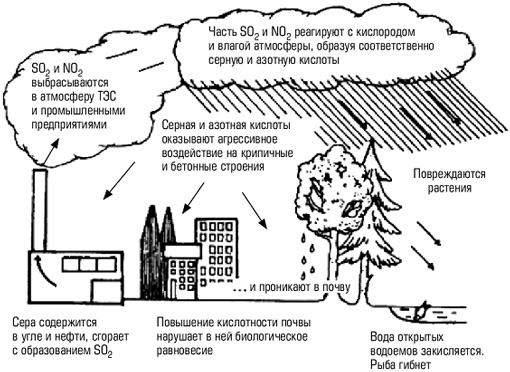
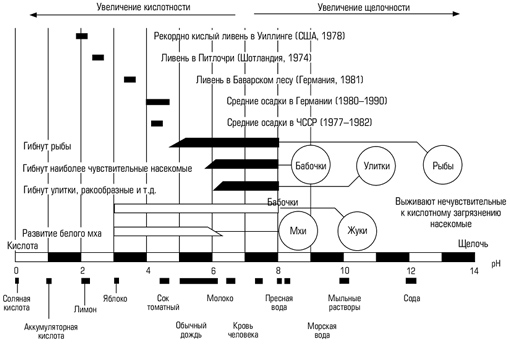
В химических превращениях различных загрязняющих веществ в тропосфере ключевое место занимает OH - радикал к образованию которого ведут несколько процессов. Основной вклад дают фотохимические реакции с участие озона: O3+h=O2+O O+H2O=OH+OH В образовании озона в тропосфере участвуют оксиды озона: NO2+ h (L<400нм) =NO+O O+O2=O3 О влиянии фотохимических реакций на содержание озона в тропосфере свидетельствует 50% уменьшение концентрации озона при солнечном затмении: O3+NO=NO2+O2 O3+NO2=NO3+O2 В образовании ОН радикалов на высоте 30 км. участвуют пары воды: Н2 О+h=H+OH H2 O+O=2OH Определённый вклад в образование ОН-групп в тропосфере могут давать реакции фоторазложения HNO2, HNO3, H2O2 HNO2+h (L<400нм) =NO+OH HNO3+h (L<330нм) =NO2+OH H2O2+h (L<330нм) =2OH В тропосферных процессах гидроксильный радикал играет ключевую роль в окислении углеводородов: RH+OH=HOH+R R+O2=RO2 RO2+HOH=ROOH+OH Наиболее типичным и основным по массе органическим загрязнителем атмосферы является CH4. Окисление CH4 под действием ОН протекает сопряженно с окисление NO. Соответствующий радикально-цепной механизм включает общую для всех тропосферных процессов стадию инициирования ОН и цикл экзотермических реакций продолжение цепи, характерных для реакции окисления органических соединений: ОН+СН4=Н2О +СН3 СН3+О2=СН3 О2 СН3 О2+NО=СН3 О+NО2 СН3 О+О2=СН2 О+НО2 В результате реакция окисления СН4 в присутствии NО как катализатора и при воздействии солнечного света с длиной волны 300-400нм запишется в виде: СН4+4О2=СН2 О+Н2 О+2О3 т.е. окисление метана (и других органических веществ) приводит к образованию тропосферного озона. Скорость этого процесса тем больше, чем выше концентрация NО. Расчеты показывают, что антропогенный выброс NО удваивает приземную концентрацию О3, а рост утечки СН4 многократно опережающий по темпам роста другие виды загрязнений тропосферы приводит к ещё большему увеличению концентрации О3 по сравнению с переносом О3 из стратосферы. Рост приземной концентрации озона представляет опасность для зеленой растительности и животного мира. Образующийся при окислении метана формальдегид окисляется далее радикалами ОН с образованием СО. Этот канал вторичного загрязнения атмосферы моноксидом углерода сравним с поступление СО от неполного сгорания ископаемого топлива. ОН+СН2 О=Н2 О+НСО НСО+О2=НО2+СО Причины образования “озоновой дыры” Летом и весной концентрация озона повышается; над полярными областями она всегда выше, чем над экваториальными. Кроме того, она меняется по 11-летнему циклу, совпадающему с циклом солнечной активности. Все это было уже хорошо известно, когда в 1980-х гг. наблюдения показали, что над Антарктикой год от года происходит медленное, но устойчивое снижение концентрации стратосферного озона. Это явление получило название "озоновая дыра" (хотя никакой дырки в собственном значении этого слова, конечно, не было) и стало внимательно исследоваться. Позднее, в 1990-е гг., такое же уменьшение стало происходить и над Арктикой. Феномен Антарктической “озоновой дыры” (рис.1) пока не понятен: то ли “дыра" возникла в результате антропогенного загрязнения атмосферы, то ли это естественный геоастрофизический процесс. Сначала предполагали, что на озон влияют частицы, выбрасываемые при атомных взрывах; пытались объяснить изменение концентрации озона полетами ракет и высотных самолетов. В конце концов было четко установлено, что причина нежелательного явления - реакции с озоном некоторых веществ, производимых химическими заводами. Это в первую очередь хлорированные углеводороды и особенно фреоны - хлорфторуглероды, или углеводороды, в которых все или большая часть атомов водорода, заменены атомами фтора и хлора. Хлорфторуглероды широко применяются в современных бытовых и промышленных холодильниках (в России их поэтому называют "хладонами"), в аэрозольных баллончиках, как средства химической чистки, а некоторые производные - для тушения пожаров на транспорте. Используются они и как пенообразователи, а также для синтеза полимеров. Мировое производство этих веществ достигло почти 1,5 млн. т. Будучи легколетучими и довольно устойчивыми к химическим воздействиям, хлорфторуглероды после использования попадают в атмосферу и могут находиться в ней до 75 лет, достигая высоты озонового слоя. Здесь под действием солнечного света они разлагаются, выделяя атомарный хлор, который и служит главным "нарушителем порядка" в озоновом слое. CF2 Cl2=CF2 Cl+Cl Последующие реакции CF2 Cl с О2 и h приводят к отщеплению второго атома хлора. Хлор "съедает" и озон, и атомарный кислород за счет протекания довольно быстрых реакций: О3 + Сl = О2 + ClO СlO + O = Cl + O2 Причем последняя реакция приводит к регенерации активного хлора. Хлор, таким образом, даже не расходуется, разрушая озоновый слой. Предполагается, что из-за разрушительного действия хлора и аналогично действующего брома к концу 1990-х гг. концентрация озона в стратосфере снизилась на 10%. Венская конвенция. В 1985 году британские ученые обнародовали данные, согласно которым в предшествующие восемь лет были обнаружены увеличивающиеся каждую весну озоновые дыры над Северным и Южным полюсами. Ученые предложили три теории, объяснявшие причины этого феномена: разрушение озонового слоя окисями азота - соединениями, образующимися естественным образом на солнечном свету; О3+NО NО3+О2 воздушные потоки из нижних слоев атмосферы при движении вверх расталкивают озон; разрушение озона соединениями хлора. В 1987 г. был принят Монреальский протокол, по которому определили перечень наиболее опасных хлорфторуглеродов, и страны-производители хлорфторуглеродов обязались снизить их выпуск. В июне 1990 г. в Лондоне в Монреальский протокол внесли уточнения: к 1995 г. снизить производство фреонов вдвое, а к 2000 г. прекратить его совсем. Сегодня уже разработаны и выпускаются экологически безопасные фреоны и их заменители, но озоновый слой продолжает находиться в критическом состоянии. Установлено, что на содержание озона оказывают влияние азотсодержащие загрязнители воздушной среды: 2NО+О2 = 2NО2 О2+NО2 = NО3+О2 NО3+NО2 = N2 О5 N2 О5+Н2 О = 2НNО3 Происхождение NО, ОН и Сl в стратосфере возможно, как в результате естественных процессов, так и в результате антропогенных загрязнений. Так, NО образуется в двигателях внутреннего сгорания. Соответственно запуск ракет и сверх звуковых самололетов приводит к разрушению озонового слоя. В любом двигателе внутреннего сгорания развиваются настоль высокие температуры, что из атмосферного кислорода и азота образуется NО: N2+О2 2NО. Источником NО в стратосфере служит также газ N2 О, который устойчив в тропосфере, а в стратосфере распадается под действием жесткого УФ-излучения: N2 О+h (230нм) = N2+О N2 O+O = 2NO Разрушение N2О в стратосфере осуществляется и по реакциям: N2 О+h (250нм) = N2+О N2 O+O = N2+O2 Пути решения проблем Чтобы начать глобальное восстановление нужно уменьшить доступ в атмосферу всех веществ, которые очень быстро уничтожают озон и долго там хранятся. Также мы - все люди должны это понимать и помочь природе включить процесс восстановления озонового слоя, нужны новые посадки лесов, хватит вырубать лес для других стран, которые почему-то не хотят вырубать свой, а делают на нашем лесе деньги. Для восстановления озонового слоя его нужно подпитывать. Сначала с этой целью предполагалось создать несколько наземных озоновых фабрик и на грузовых самолетах "забрасывать" озон в верхние слои атмосферы. Однако этот проект (вероятно, он был первым проектом "лечения" планеты) не осуществлен. Иной путь предлагает российский консорциум "Интерозон": производить озон непосредственно в атмосфере. Уже в ближайшее время совместно с немецкой фирмой "Даза" планируется поднять на высоту 15 км аэростаты с инфракрасными лазерами, с помощью которых получать озон из двухатомного кислорода. Если этот эксперимент окажется удачным, в дальнейшем предполагается использовать опыт российской орбитальной станции "Мир" и создать на высоте 400 км несколько космических платформ с источниками энергии и лазерами. Лучи лазеров будут направлены в центральную часть озонового слоя и станут постоянно подпитывать его. Источником энергии могут быть солнечные батареи. Космонавты на этих платформах потребуются лишь для периодических осмотров и ремонта. У этого проекта был предшественник - американская СОИ (стратегическая оборонная инициатива) с планом использования мощных лазеров для "звездных войн". Осуществится ли грандиозный мирный проект, покажет время. Но и физическая химия, и космонавтика уже готовы к тому, чтобы начать восстанавливать комфортное для жизни химическое равновесие на нашей планете. Принимая во внимание чрезвычайность ситуации, необходимо: расширить комплекс теоретических и экспериментальных исследований по проблеме сохранения озонового слоя; провести первую Международную научную конференцию по проблемам сохранения озонового слоя активными способами; создать Международный фонд сохранения озонового слоя активными способами; провести Международный телемост на тему сохранения озонового слоя с участием ведущих ученых, политических, религиозных и общественных деятелей; организовать Международный комитет для выработки стратегии выживания человечества в экстремальных условиях. Причины кислотных дождей Основная причина выпадения кислотных дождей — наличие в атмосфере за счет промышленных выбросов оксидов серы и азота, хлористого водорода и других кислотообразующих соединений. В результате дождь и снег оказываются подкисленными. Образование кислотных дождей и их воздействие на окружающую среду показано на рис. 1 и 2. Присутствие в воздухе заметных количеств, например, аммиака или ионов кальция приводит к выпадению не кислых, а щелочных осадков. Однако их также принято называть кислотными, поскольку они при попадании на почву или в водоем меняют их кислотность. Максимальная зарегистрированная кислотность осадков в Западной Европе — с рН = 2,3, в Китае — с РН = 2,25. Автором учебного пособия на экспериментальной базе Экологического центра РАН в Подмосковье в 1990 г. был зарегистрирован дождь с рН = 2,15. Подкисление природной среды отрицательно отражается на состоянии экосистем. В этом случае из почвы выщелачиваются не только питательные вещества, но и токсичные металлы, например свинец, алюминий и др. В подкисленной воде увеличивается растворимость алюминия. В озерах это приводит к заболеванию и гибели рыб, к замедлению развития фитопланктона и водорослей. Кислотные дожди разрушают облицовочные материалы (мрамор, известняки др.), значительно снижают срок службы железобетонных конструкций. Таким образом, окисление природной среды — одна из важнейших экологических проблем, требующая решения в ближайшем будущем.
Рис. 1. Образование кислотных дождей и их воздействие на окружающую среду
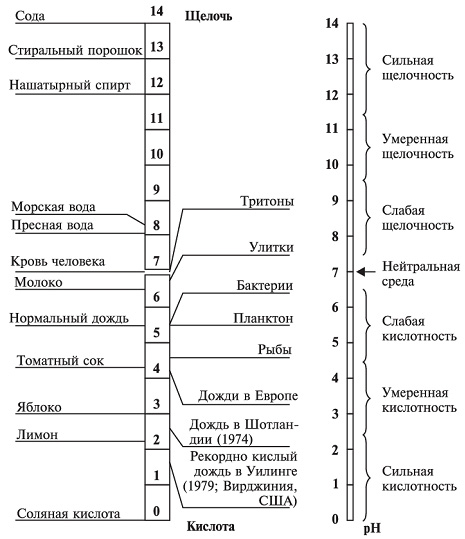
Рис. 2. Ориентировочная кислотность дождевой воды и некоторых веществ в единицах рН Проблема кислотных осадков
Скрыть рекламу:Не интересуюсь этой темойНавязчивое и надоелоСомнительного содержания или спамМешает просмотру контентаЯндекс.Директ Развитие промышленности, транспорта, освоение новых источников энергии приводят к тому, что количество промышленных выбросов постоянно увеличивается. Это связано главным образом с использованием горючих ископаемых на тепловых электростанциях, промышленных предприятиях, в двигателях автомобилей и в системах отопления жилых домов. В результате сжигания ископаемого топлива в атмосферу Земли поступают соединения азота, серы, хлора, других элементов. Среди них преобладают оксиды серы — S02 и азота — NOx (N20, N02). Соединяясь с частицами воды, оксиды серы и азота образуют серную (H2SO4) и азотную (HNO3) кислоты различной концентрации. В 1883 г. шведский ученый С. Аррениус ввел в обращение два термина — «кислота» и «основание». Он назвал кислотами вещества, которые при растворении в воде образуют свободные положительно заряженные ионы водорода (Н+), а основаниями — вещества, которые при растворении в воде образуют свободные отрицательно заряженные гидроксид-ионы (ОН-). Водные растворы могут иметь рН (показатель кислотности воды, или показатель степени концентрации ионов водорода) от 0 до 14. Нейтральные растворы имеют рН 7,0, кислая среда характеризуется значениями рН меньше 7,0, щелочная — больше 7,0 (рис. 3). В среде с рН 6,0 гибнут такие виды рыб, как лосось, форель, плотва и пресноводные креветки. При рН 5,5 погибают лонные бактерии, которые разлагают органические вещества и листья, и органический мусор начинает скапливаться на дне. Затем гибнет планктон — крошечные одноклеточные водоросли и простейшие беспозвоночные, которые составляют основу пищевой цепи водоема. Когда кислотность достигает рН 4,5, погибает вся рыба, большинство лягушек и насекомых, выживают только некоторые виды пресноводных беспозвоночных.
Рис. 3. Шкала кислотности (рН) Установлено, что на долю техногенных выбросов, связанных со сжиганием ископаемого угля, приходится около 60-70 % их общего количества, на долю нефтепродуктов — 20-30 %, на остальные производственные процессы — 10 %. 40 % выбросов NOx составляют выхлопные газы автомобилей.
|
|||||
|
Последнее изменение этой страницы: 2017-02-22; просмотров: 1078; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.21.248.105 (0.008 с.) |

 Android TV от 2990 рубБольшой выбор Android TV приставок. Техподдержка. Гарантия 1 год!somebox.ruАдрес и телефон
Android TV от 2990 рубБольшой выбор Android TV приставок. Техподдержка. Гарантия 1 год!somebox.ruАдрес и телефон