
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Основы строения и свойств материалов. Фазовые превращенияСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
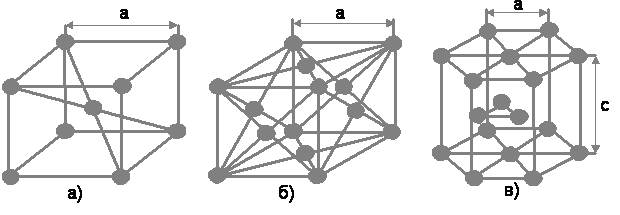
Конструкционные материалы Основы строения и свойств материалов. Фазовые превращения Структура материала Теория к этому разделу Кристаллическое строение металлов Металлы являются телами кристаллическими. Кристаллическая решетка – регулярное расположение в кристаллах частиц (атомов, ионов), характеризующееся периодической повторяемостью в трех измерениях. Если соединить атомы воображаемыми линиями в трех взаимно-перпендикулярных направлениях, то получится пространственная кристаллическая решетка. Ее наименьшим структурным образованием является элементарная ячейка, контур которой представляет геометрическое тело, например куб или шестигранную призму. Ещё в 1890 – 1891 гг. русский минералог Е. С. Федоров систематизировал все известные кристаллы и выделил 230 пространственных групп. Металлы имеют кристаллические решетки различных типов, наиболее типичными из которых являются: - объемно-центрированная кубическая (ОЦК); - гранецентрированная кубическая (ГЦК); - гексагональная плотноупакованная (ГПУ)
Рис. 2.1.1. Основные типы кристаллических решеток металлов: а) ОЦК; б) ГЦК; в) ГПУ. Некоторые металлы, например железо, титан, олово и другие, способны изменять свое кристаллическое строение, перестраивая тип элементарной ячейки. Так железо до температуры 911°С имеет ОЦК решетку, а при превышении этой температуры перестраивается в ГЦК решетку, которая сохраняется до температуры 1392°С. После чего решетка вновь перестраивается и приобретает ОЦК строение, сохраняя его плоть до температуры плавления 1539°С. Именно благодаря полиморфизму сплавы на основе железа, титана и других металлов можно подвергать термической обработке для целенаправленного изменения их свойств. В кристаллической решетке по различным направлениям находится разное число атомов. Из-за различной плотности расположения атомов в разных плоскостях некоторые свойства кристалла зависят от направления. Зависимость свойств от направления в кристалле называется анизотропией. Если свойства тела не зависят от направления, то такие тела называют изотропными.
Вопросы, отнесенные к этому разделу
Механические свойства, определяемые при статическом нагружении Испытание на растяжение Испытание на растяжение относится к числу наиболее распространенных статических испытаний, позволяющих определить основные характеристики механических свойств металла.
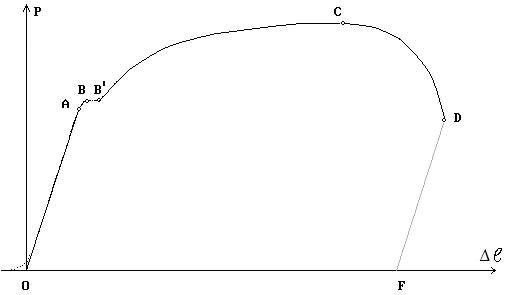
Рис.2.1.4.. Принципиальная схема испытательной машины: 1 – собственно машина; 2 – винт грузовой; 3 – нижний захват (активный); 4 – образец; 5 – верхний захват (пассивный); 6 – силоизмерительный датчик; 7 – пульт управления с электроприводной аппаратурой; 8 – индикатор нагрузок; 9 – рукоятки управления; 10 – диаграммный механизм; 11 – кабель. На диаграмме растяжения (рис.2.1.5) материалов можно выделить несколько характерных участков.
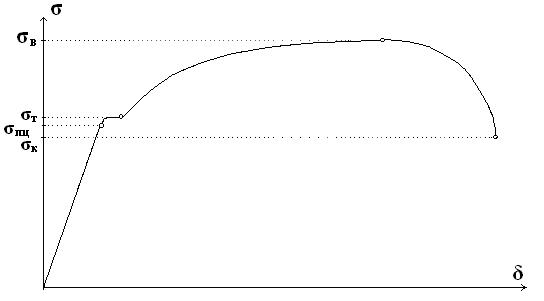
Рис. 2.1.5. Машинная (первичная) диаграмма растяжения пластичного материала с площадкой текучести Прямолинейный участок OA соответствует упругой деформации образца. Дальнейшее возрастание нагрузки (участок AB) приводит к появлению пластической (остаточной) деформации. Причем на участке BB' наблюдается интенсивная пластическая деформация при неизменной нагрузке. Этот участок диаграммы называется площадкой текучести. Однако многие металлы и сплавы деформируются при растяжении без площадки текучести. До максимальной нагрузки (точка C) происходит равномерная деформация образца по всей его рабочей части. А затем образец в наиболее слабом месте утончается (это место называется шейкой) и на участке CD идет пластическая деформация при снижении нагрузки. В точке D происходит окончательное разрушение образца с разделением его на две части. По диаграмме растяжения определяют следующие характеристики механических свойств металла. Показатели прочности Прочность – это свойство материала сопротивляться деформации или разрушению. Показатели прочности характеризуются не прилагаемой нагрузкой P, а удельной величиной – условным напряжением σ, определяемым отношением нагрузки к площади начального поперечного сечения образца F0 (σ = P/F0). Соответствующие напряжениию σ относительные деформации δ вычисляют как частное от деления абсолютной деформации Δ В области упругой деформации (участок OA, рис. 2.1.5) зависимость между напряжением σ и относительной деформацией δ пропорциональна и известна под названием закона Гука:
где E – модуль Юнга или модуль нормальной упругости измеряется в МПа и характеризует жесткость материала. Чем выше E, тем материал жестче, т.е. меньшую упругую деформацию вызывает одна и та же нагрузка.
Рис. 2.1.6. Определение основных характеристик прочности Показатели пластичности Пластичностью называют свойство материалов необратимо изменять свою форму и размеры под действием внешней нагрузки. Под ее действием материал деформируется. Различают следующие виды деформации: растяжение (сжатие), изгиб, кручение, срез. Выше уже была рассмотрена абсолютная Δℓ и относительная δ деформация под действием нагрузки. Если к материалу приложена небольшая нагрузка (σ<σпц), то возникает только упругая деформация и после снятия нагрузки образец восстанавливает свою первоначальную длину ℓ0. А если напряжение σ>σпц, то после снятия нагрузки разгрузка образца идет по линии DF (рис.2.1.5), параллельной упругой деформации OA. Остаточное удлинение в этом случае определяется как Δℓост = ℓ – ℓ 0, а относительное остаточное удлинение как
здесь ℓ – длина образца перед снятием нагрузки.
Испытание на твердость Твердость – это свойство материала оказывать сопротивление деформации или хрупкому разрушению при внедрении индентора в его поверхность. Под индентором понимается твердосплавный наконечник (в виде шара, пирамиды или конуса), твердость которого существенно превосходит твердость испытуемого материала. . Испытание на твердость – самый простой вид механических испытаний. Наибольшее распространение получили статические методы испытания на твердость при вдавливании индентора: методы Бринелля, Виккерса и Роквелла. При испытании на твердость по методу Бринелля (ГОСТ 9012-59) в поверхность материала вдавливается твердосплавный шарик диаметром D под действием нагрузки P и после снятия нагрузки измеряется диаметр отпечатка d (рис.2.1.8).
Рис. 2.1.8. Определение твердости металла методом Бринелля: а) схема испытания; б) отпечаток шарика.
Число твердости по Бринеллю (HB) определяется как отношение нагрузки P к площади поверхности сферического отпечатка M:
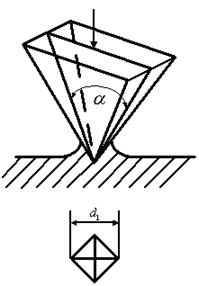
Твердость по Бринеллю обозначается символом HB с указанием числа твердости. При этом размерность (кгс/мм²) не ставится, например 200HB. Преимущество метода Бринелля заключается в простоте испытания и точности получаемых результатов. Метод Бринелля не рекомендуется применять для материалов с твердостью более 450HB, так как стальной шарик заметно деформируется, что вносит погрешность в результаты испытаний. Для испытания твердых материалов применяют методы Роквелла и Виккерса. При испытании на твердость по методу Виккерса (ГОСТ 2999-75) в поверхность материала вдавливается алмазная четырехгранная пирамида с углом при вершине α = 136º (рис.2.1.9). После снятия нагрузки вдавливания измеряется диагональ отпечатка d1. Число твердости по Виккерсу HV определяется как отношение нагрузки P к площади пирамидального отпечатка M.
Твердость по Виккерсу обозначается символом HV, при этом размерность не ставится (кгс/мм²).
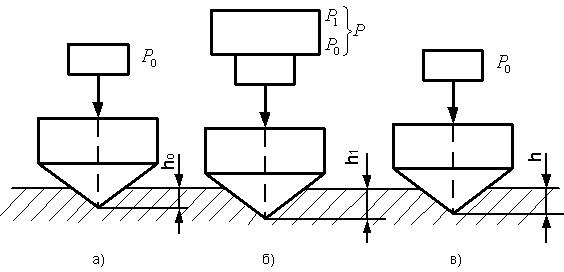
Рис.2.1.9. Определение твердости металла методом Виккерса: а) схема испытаний; б) отпечаток пирамиды Преимущество метода Виккерса по сравнению с методом Бринелля заключается в том, что методом Виккерса можно испытывать материалы более высокой твердости из-за применения алмазной пирамиды. При испытании на твердость по методу Роквелла (ГОСТ 9013-59) в поверхность материала вдавливается алмазный конус с углом 120º при вершине или стальной шарик диаметром 1,588 мм. Однако, согласно этому методу, за условную меру твердости принимается глубина отпечатка. Рассмотрим схему испытаний по методу Роквелла на примере вдавливания алмазного конуса (рис.2.1.10).
Рис.2.1.10. Схема испытаний на твердость методом Роквелла При испытании мягких металлов методом Роквелла в качестве индентора применяется стальной шарик. Последовательность операций такая же, как и при испытании алмазным конусом. Число твердости, определенное методом Роквелла, обозначается символом HR и выражается в условных безразмерных единицах. В зависимости от формы индентора и значений нагрузок вдавливания к этому символу добавляются буквы A, C или B, указывающие соответствующую шкалу измерений. Обозначения твердости и значения нагрузок вдавливания для разных шкал измерений методом Роквелла приведены в таблице 2.1.1 Различие в нагрузке Р1 для шкал объясняется тем, что по шкале A измеряют твердость особо твердых материалов и в этом случае во избежание повреждений алмазного конуса рекомендуется меньшая нагрузка вдавливания. Число твердости по Роквеллу подсчитывается по формулам:
где 100 и 130 - предельно заданное число деления индикатора часового типа с ценой деления 0,002мм. Например, 50 HRC означает, что твердость, определенная методом Роквелла по шкале C при вдавливании алмазного конуса, равна 50 (размерность не ставится). Преимущество метода Роквелла по сравнению с методами Бринелля и Виккерса заключается в том, что значение твердости по методу Роквелла фиксируется непосредственно стрелкой индикатора, при этом отпадает необходимость в оптическом измерении размеров отпечатка. Таблица 2.1.1 Обозначения твердости и значения нагрузок вдавливания для разных шкал измерений методом Роквелла
Для измерения твердости тонких слоев материалов и даже их отдельных структурных составляющих применяют метод микротвердости (ГОСТ 9450-76). Этот метод по существу не отличается от метода Виккерса, однако при этом используются малые нагрузки вдавливания: 0,005; 0,01; 0,02; 0,05; 0,1; 0,5 кгс.
Испытание на усталость Большинство разрушений деталей и конструкций при эксплуатации происходит в результате циклического нагружения. Металл, подверженный такому нагружению, может разрушаться при более низких напряжениях, чем при однократном плавном нагружении. Процесс постепенного накопления повреждений в материале при действии циклических нагрузок, приводящий к образованию трещин и разрушений, называют усталостью. Свойство материалов противостоять усталости называют выносливостью. На рис.2.3.1 приведена типичная схема испытаний на усталость с соответствующими циклами напряжений. Согласно схеме, циклическое напряжение осуществляется подвешенным на подшипнике неподвижным грузом при вращении консольно закрепленного образца. В результате у образца верхняя поверхность (в) работает на растяжении (σmax), а нижняя (н) на сжатии (σmin). За один оборот образца каждая поверхность проходит полный цикл напряжения, от максимального до минимального. Рассмотренный цикл называется симметричным, так как у него |σmax| = |σmin|
Рис. 2.3.1. Испытание на усталость: а) – схема нагруженного образца (1 – вращающийся шпиндель; 2 – образец; 3 – нагружающий подшипник); б) циклическое изменение напряжения σ в образце.
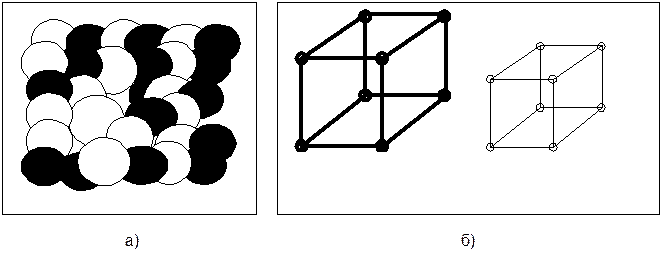
Основы теории сплавов Понятие о сплавах Сплавы – это сложные вещества, получаемые сплавлением или спеканием двух или нескольких простых веществ, называемых компонентами (при сплавлении компоненты доводят до плавления, а при спекании их порошки смешивают и подвергают давлению при высокой температуре). Виды двойных сплавов В технике большинство сплавов получают взаимным растворением их составляющих в жидком состоянии, т.е. доводят компоненты до плавления. При этом образуется жидкий раствор – однородная смесь двух или более компонентов, которые равномерно распределены в виде отдельных атомов, ионов или молекул (рис. 4.2.1). Расплавленные компоненты при охлаждении и кристаллизации могут образовывать твердые металлические сплавы с различным строением: - смеси; - твердые растворы; - химические соединения. Смеси чистых металлов образуются, когда разнородные атомы компонентов не входят в общую кристаллическую решетку сплава. Каждый компонент образует самостоятельные кристаллы (зерна), сохраняя присущую ему кристаллическую решетку (рис. 4.2.2)
Рис. 4.2.1. Жидкий раствор двух металлов.
Рис. 4.2.2. Механическая смесь двух металлов (а) и их кристаллические решетки (б) Твердые растворы образуются в результате перехода в твердое состояние однородных жидких растворов. Рассмотрим твердый раствор двух компонентов. Один из компонентов, который сохраняет свою кристаллическую решетку, является растворителем. Тогда другой компонент (растворимый) распределяется в решетке растворителя, не изменяя ее типов. Твердые растворы бывают двух типов: - замещения; - внедрения. В твердых растворах замещения часть атомов в кристаллической решетке растворителя замещена атомами другого компонента (рис. 4.2.3,а). Такие растворы образуют компоненты с аналогическими типами кристаллических решеток при небольшой разнице их параметров, например, в сплавах железа с хромом, никелем и т.д. В твердых растворах внедрения атомы растворенного компонента располагаются между атомами растворителя (рис. 4.2.3,б). Это возможно, если растворимый компонент имеет очень малый атомный диаметр и может разместиться между узлами кристаллической решетки растворителя, не вытесняя атомов растворителя из узлов решетки. Твердые растворы внедрения образуются, например, в сплавах железа с водородом, азотом, бором. В обоих случаях твердого раствора исходные размеры кристаллической решетки растворителя изменяются, а это приводит к изменению свойств сплавов по сравнению со свойствами исходных компонентов: увеличивается электрическое сопротивление, как правило, снижается пластичность и вязкость.
Рис. 4.2.3. Виды твердых растворов: а) замещения; б) внедрения. Здесь: ○ - атомы растворителя; ● - атомы растворимого компонента
При образовании твердых растворов компоненты могут растворяться в друг друге неограниченно или ограниченно. Ограниченная растворимость характеризуется тем, что в решетке растворителя может растворяться лишь определенное количество атомов растворимого элемента. Остальные атомы растворимого элемента могут сами стать растворителями или вступить со вторым компонентом в химическое взаимодействие. При сплавлении двух компонентов могут также образовываться химические соединения, которые имеют характерные особенности: 1) их кристаллическая решетка отличается от кристаллических решеток образующих элементов и имеют более сложное строение; 2) соотношение элементов в сплавах кратно целым числам (они имеют формулу АnВm, например и FeO, CuO и т.д.) 3) их свойства отличны от свойств образующих элементов. У химических соединений связь между атомами, как правило, сильнее и жестче металлической, поэтому они являются очень твердыми и хрупкими. Химические соединения имеют постоянную температуру плавления.
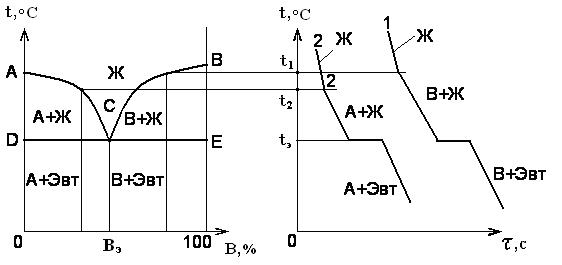
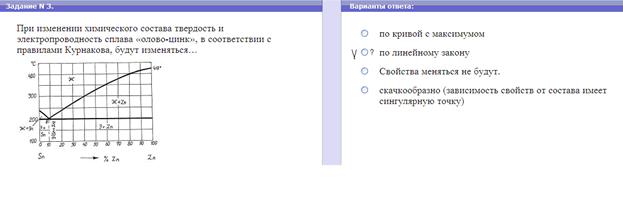
Диаграмма состояния I рода (Сплавы, образующие гетерогенные структуры) Данная диаграмма (рис.4.3.1,a) охватывает сплавы, компоненты которых образуют смеси своих практически чистых зерен при ничтожной взаимной растворимости. На оси абсцисс отложена процентная доля компонента B в сплаве. Процентная доля компонента A увеличивается в противоположном направлении оси абсцисс (она не показана, но подразумевается).
Рис.4.3.1. Диаграмма состояния I рода (а) и кривые охлаждения сплава (б)
Компоненты A и B для этого типа диаграмм взаимно растворяются только в жидком состоянии, а в твердом – не растворяются и не образуют химических соединений. Линия диаграммы ACB, выше которой сплавы находятся в жидком состоянии, называется линией ликвидус (от лат. «ликвидус» - жидкий, текучий). Линия диаграммы DCE, ниже которой сплавы находятся в твердом состоянии, называется линией солидус (от лат. «солидус» - твердый). Между линиями ликвидус и солидус сплавы переходят из жидкого состояния в твердое. Сплав двух компонентов, который плавится при минимальной температуре, называется эвтектическим или эвтектикой (от греч. «эвтектика» - легко плавящийся). Эвтектика представляет собой топкую смесь компонентов A и B в виде мелких зерен. Состав сплава можно определить, спроецировав точку C на ось абсцисс (точка Вэ). У такого состава одновременно плавятся или кристаллизуются оба компонента при температуре tэ – эвтектической температуре. Такой состав имеет самую высокую прочность. Левее точки сплавы называются доэвтектическими, а правее – заэвтектическими. При этом из каждого сплава по мере снижения температуры в твердую фазу переходит в начале тот компонент, количество которого превышает эвтектическую концентрацию. Причем он кристаллизуется в виде крупных зерен, имеющих меньшую прочность, по сравнению с мелкозернистой эвтектикой. Кривые охлаждения сплавов приведены на рис. 1.3.4,б. Рассмотрим охлаждение сплава, имеющего избыток компонента A – кривая 2. До температуры T2 сплав находится в жидкой фазе. По мере снижения температуры в твердую фазу сначала начинает выпадать компонент A. Двухфазная область ACD содержит твердую фазу компонента A и жидкую фазу Ж, состоящую из обоих компонентов. По мере приближения температуры к Тэ состав незакристаллизовавшейся фазы приближается к эвтектическому. После температуры Тэ сплав состоит из крупных зерен компонента a и мелких зерен эвтектики (A+B). При охлаждении заэвтектических сплавов (кривая I) сначала в твердую фазу выпадает компонент B. После температуры Тэ сплав состоит из крупных зерен компонента B и мелких зерен эвтектики (A+B).
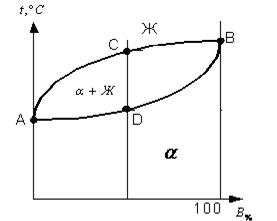
Диаграмма состояний II рода Диаграмма состояния II рода (рис.4.3.2) характерна для сплавов с неограниченной растворимостью компонентов друг в друге, имеющих одинаковые типы решеток и сходное строение наружных электронных оболочек.
Рис. 4.3.2. Диаграмма состояния II рода (а) и кривые охлаждения сплава (б). На диаграмме различают три фазовые области (рис.4.3.2,а): Выше линии ликвидуса ABC находится область жидкой фазы Ж; 1. Ниже линии солидуса ADB находится твердый раствор компонентов A и B (α). Зерна этой фазы имеют единую кристаллическую решетку, однако у сплавов разного состава число атомов компонентов А и В элементарных ячейках различно. 2. Между линиями ликвидуса и солидуса расположена двухфазная область Имеются также диаграммы III и IV рода. Однако они очень сложны и из-за недостатка времени в данном курсе не рассматривается. Знание диаграммы сплава позволяет создавать сплавы различного назначения, целенаправленно закладывать необходимые свойства. Этому способствуют сведения, которые можно получить из анализа диаграмм состояния. В связи с этим особую ценность представляют такие сведения, как поведение сплавов при наличии или отсутствии в них переменной растворимости компонентов или аллотропических превращений при изменении температуры. Особенно важно подчеркнуть положение, согласно которому в кристаллических решетках твердых растворов интенсивность межатомного взаимодействия значительно выше, чем в решетках составляющих их компонентов. В связи образуются высокостабильные фазы с повышенной прочностью, более высоким сопротивлением коррозии и т.д.
Строение и свойства железа Железо при обычных температурах имеет о.ц.к. решетку и его называют α-Fe.
При нагреве до температуры 910°С Fe сохраняет решетку объемноцентрированного куба. Однако, начиная с температуры 770˚С и выше, Fe становится немагнитным (парамагнетиком). Это Fe часто называют β-Fe. При температуре 910°С происходит перегруппировка атомов, и решетка становится г.ц.к.; такое железо называют γ-Fe. При температуре 1400°С вновь происходит перегруппировка атомов Fe, и образуется решетка о.ц.к. Это высокотемпературное α-Fe нередко называют δ-Fe. При температуре 1539°С Критическая температура превращения γ-Fe ↔ α-Fe (δ-Fe) при 1400°С (1392°С) обозначают точкой Ac4 (Ar4 ), температуру превращения α-Fe (β -Fe) ↔ γ -Fe при 910°C (898°C) - точкой Ac3 (Ar3). Температуру Кюри, равную 770°С (768°С), обозначают точкой Ас2(Аr2). При переходе α -Fe в γ -Fe кристаллическая решетка перестраивается из о.ц.к. в г.ц.к., при этом происходит ее объемное сжатие.
4.4.2. Компоненты и фазы в сплавах системы железо − углерод Основными компонентами сплавов системы Fe − С является железо и углерод. Углерод − неметаллический элемент. Его плотность — 2,5 Мг/м3, Тпл = 3500°С. Он полиморфен и в обычных условиях находится в виде графита. Графит имеет решетку гексагональную, слоистую; обладает низкой прочностью и относительно невысокой электропроводностью. Углерод растворяется в Fe, образуя жидкие и твердые растворы, а также образует с Fe химическое соединение − цементит (карбид железа Fe3C). В высокоуглеродистых сплавах (в чугунах) углерод может находиться еще и в виде свободного графита. Основными фазами и структурными составляющими сплавов системы Fe − С, от которых зависят свойства и поведение сплавов при механических и тепловых нагрузках, являются: феррит Ф, аустенит А, цементит Ц и продукты их эвтектического и эвтектоидного превращения: ледебурит Л и перлит П. Феррит (от лат. ferrum − железо) − это твердый раствор углерода в α-железе. Различают низкотемпературный а-Ф с растворимостью углерода до 0,02% и высокотемпературный δ-Ф с предельной растворимостью углерода 0,1%. Атомы растворенного углерода в Ф располагаются в центре граней о.ц.к. решетки, а также в вакансиях, на дислокациях и других дефектах. Феррит имеет невысокие твердость (НВ Аустенит (по имени английского ученого Аустена) − это твердый раствор углерода (и других элементов) в γ-Fe. Атомы растворенного в аустените углерода располагаются в центре элементарных ячеек г.ц.к. решетки. В зависимости от температуры, в А углерода может раствориться до 2,14% (при Т= 1147°С), т.е. больше, чем в Ф. Аустенит обычно существует только при Т> 727°С. При комнатной температуре он иногда в небольшом количестве сохраняется только в закаленной стали. Аустенит пластичен, его твердость НВ=160-200 кгс/мм2, прочность σ=1600—2000 МПа, δ = 40—50%. А − парамагнетик, хуже проводит электрический ток и тепло, чем Ф. Способность α- и γ-Fe растворять неодинаковое количество углерода играет важную роль при термической и химико-термической обработке стали. Цементит (указывает на твердость этой фазы) — это химическое соединение Fe с С − карбид железа Fe3C. Содержание углерода в Ц 6,67%, температура плавления точно не установлена в связи с возможностью его распада и принимается равной примерно 1550°С (в литературе встречается и 1600°, и 1250°С). Цементит при определенных условиях может распадаться на феррит и графит. До температуры 210°С (точка Ао) Ц слабо магнитен, выше − становится практически немагнитным. Цементит является самой твердой и хрупкой фазой в сплавах Fe − С. Его твердость составляет НВ=800 кгс/мм2, прочность σ=8000 МПа, а пластичность практически равна нулю, поэтому он способен только к небольшим упругим деформациям. Чем больше Ц в сплавах Fe − С, тем большей твердостью и меньшей пластичностью они обладают (например, чугуны). Различают цементит Ц первичный ЦI, − кристаллизуется непосредственно из жидкого раствора системы Fe − С, вторичный ЦII − продукт распада аустенита и третичный ЦIII − продукт распада феррита. Ледебурит (по имени немецкого ученого Ледебура) имеет эвтектическую структуру (колониального типа), состоящую из аустенита и цементита, одновременно кристаллизующихся из жидкого раствора при постоянной температуре, равной 1147°С. Ледебурит содержит углерода 4,3%. Он присутствует во всех затвердевших сплавах, содержащих углерод от 2,14 до 6,67%, называемых чугунами (в сталях его нет). Образование Л идет из жидкого раствора по схеме
(цифры в этой схеме и в схеме, приведенной ниже, указывают содержание углерода в данной фазе). Таким образом, при 1147°С имеет место эвтектическое превращение, в результате которого образуется ледебурит. При температурах выше 727°С ледебурит представляет собой аустенитно-цементитную эвтектику и обозначается через Ла. При температурах, равной и ниже 727°С, аустенит превращается в перлит (см. ниже) и образуется структура, содержащая перлит и цементит. Эта структура обозначается буквой Лп. Ледебурит − твердая и хрупкая структурная составляющая чугунов. При обычных температурах его твердость НВ=650 кгс/мм2, прочность σ=6500 МПа. Перлит (от франц. perle — жемчуг, указывает на перламутровый отлив шлифа) − представляет собой эвтектоидную структуру, состоящую из смеси зерен (пластинок) феррита и цементита, образующуюся при постоянной температуре, равной 727°С в результате распада аустенита. При остывании Л до 727°С содержание в нем углерода становится равным 0,8%. Распад происходит по схеме
Распад Л называют эвтектоидным превращением, а образующуюся смесь тонких пластинок цементита и расположенных между ними более толстых пластинок феррита − эвтектоидной. Вообще эвтектоидным превращением называют процесс, когда твердый раствор определенного состава (в данном случае аустенит) при постоянной температуре трансформируется в структуру, состоящую из новых твердых фаз (в данном случае Ф и Ц). Перлит образуется как в сталях, так и в чугунах и играет важную роль в формировании их механических характеристик. Механические свойства П определяются формой и размером частиц цементитной фазы; чем мельче смесь, тем лучше свойства. Пластинчатый перлит имеет НВ=180-220 кгс/мм2, σ=1800—2200 МПа, δ = 20%.
4.4.3. Диаграмма состояния сплавов системы железо−углерод Диаграмма состояния сплавов железа с углеродом дает возможность определить строении углеродистых сталей и чугунов в зависимости от содержания углерода и температуры, выбрать режимы термической и других видов обработки. На рис. 4.4.2 представлена упрощенная диаграмма состояния сплавов системы Fe − С (Fe − Fe3C). Диаграмма построена по содержанию углерода в количестве от 0 до 6,67% или по содержанию цементита от 0 до 100%. На диаграмме точка A (1539°С) соответствует Тпл (Тзат) Fe, а точка D (~1550°С) − Тпл (Тзат) цементита. Линия ACD − это линия ликвидуса, которая показывает температуру начала затвердевания (конца плавления) сталей и белых чугунов. Выше линии ACD сплавы находятся в жидком состоянии. Линия AECF- это линия солидуса, которая показывает температуру конца затвердевания (начала плавления) всех сплавов системы Fe − С.
Рис. 4.4.2. Упрощенная диаграмма состояний соединения «железо-цементит» По линии ликвидуса АС при температурах, соответствующих этой линии, из жидкого раствора кристаллизуется аустенит, а на линии CD − первичный цементит ЦI. В точке С при температуре 1147°С и содержании углерода 4,3% из жидкого раствора одновременно кристаллизуются А и ЦI, образуя эвтектику, называемую ледебуритом. На линии солидуса АЕ при температурах, соответствующих этой линии, окончательно затвердевают сплавы Fe-С с содержанием углерода до 2,14% и образуется структура аустенита. Сплавы Fe с содержанием углерода до 2,14% называют сталями. Стали - это сплавы железа Fe с углеродом С, в которых в результате первичной кристаллизации в равновесных условиях образуется аустенитная структура. На линии солидуса ЕС (температура 1147°С) окончательно затвердевают сплавы Fe − С с содержанием углерода от 2,14 до 4,3%, и образуется эвтектика ледебурита. Поскольку при более высоких температурах из жидкого раствора выделяется аустенит, такие сплавы после затвердевания имеют структуру, представляющую смесь аустенита и ледебурита (А + Ла). На линии солидуса CF (1147°С) окончательно затвердевают сплавы Fe − С с содержанием углерода от 4,3 до 6,6%. При этом также образуется структура ледебурита. Вследствие того, что при более высоких температурах из жидкого раствора выделяется цементит (первичный), такие сплавы после затвердевания (при 1147°С) имеют структуру, представляющую смесь первичного цементита и ледебурита (ЦI + Ла). Таким образом, на линии ECF жидкие сплавы эвтектического состава кристаллизуются с образованием ледебурита, поэтому линию температур ECF называют линией эвтектического равновесия. Ледебурит присутствует во всех затвердевших сплавах, содержащих углерод от 2,14 до 6,67%. Такие сплавы называют чугунами.Если цвет излома чугуна серебристо-белый, такой чугун называют белым; в нем практически весь углерод находится в связанном состоянии в виде цементита. Чугуны с включениями графита называют серыми. В области АСЕ находится смесь двух фаз - жидкого раствора и кристаллов аустенита. В области CDF находится смесь, также состоящая из двух фаз - жидкого раствора и кристаллов цементита (первичного). В области AGSE в результате первичной кристаллизации образуется однофазная структура - аустенит. При охлаждении твердых сплавов в них происходят фазовые и структурные изменения, связанные с аллотропическими превращениями Fe и изменением растворимости в нем углерода. Эти изменения (фазовые превращения) в сплавах Fe − С характеризуют линии GSE, PSK, GPQ. Линия GS показывает начало превращения аустенита в феррит, а линия GP - конец этого превращения, имеющего место при охлаждении. Поэтому в области GSP будет двухфазная структура, состоящая из аустенита и феррита. Критические точки А3 лежат на линии GS. Линия SE показывает, что с понижением температуры твердых растворов растворимость углерода в аустените уменьшается. Если при 1147°С в аустените углерода содержится 2,14%, то при 727°С − 0,8%. В сталях с содержанием углерода от 0,8 до 2,14% с понижением температуры из аустенита выделяется избыточный углерод, который образует вторичный цементит ЦII. Следовательно, ниже линии SE (до температуры 727°С) сталь имеет структуру, состоящую из А и ЦII. Критические точки, лежащие на линии SE, обозначают Аст. В чугунах с содержанием углерода от 2,14 до 4,3% при 1147°С, как уже отмечалось выше, структура состоит из А и Л. С понижением температуры из аустенита также начнет выделяться вторичный цементит. Поэтому ниже линии ЕС до температуры 727°С белые чугуны имеют структуру, состоящую из А, Л и ЦII. На «стальном» участке диаграммы «железо-цементит» точка S (углерода 0,8%) называется эвтектоидной точкой, а линия PSK - эвтектоидной линией. В связи с этим углеродистые стали в зависимости от содержания углерода подразделяются относительно эвтектоидной точки S на эвтектоидные
|
|||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2017-02-19; просмотров: 880; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.41 (0.016 с.) |







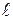 на ℓ0
на ℓ0 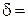
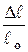 или
или 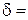
 . Зависимость σ = f(δ) приведена на рис.2.1.6.
. Зависимость σ = f(δ) приведена на рис.2.1.6.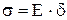
 ,
,




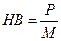 .
.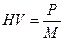 .
.
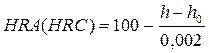 ;
;  ,
,


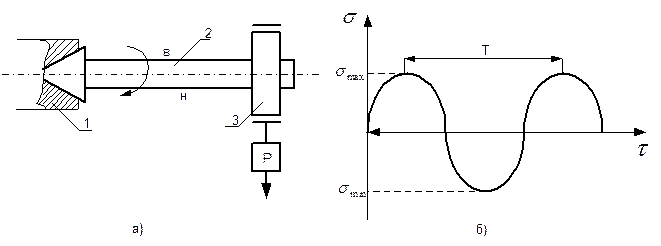





 , в которой по мере снижения температуры содержании жидкой фазы постоянно уменьшается.
, в которой по мере снижения температуры содержании жидкой фазы постоянно уменьшается.
 5°С Fе плавится.
5°С Fе плавится.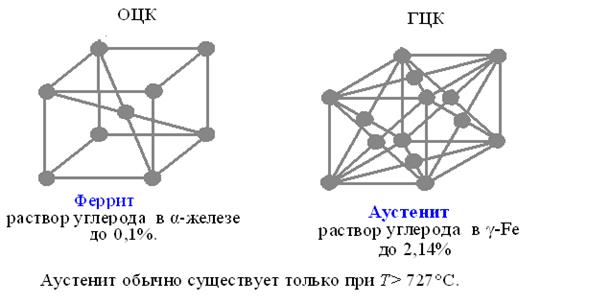
 80 кгс/мм2) и прочностью (σв= 250 МПа) и высокую пластичность: его относительное удлинение перед разрывом δ = 50%. Поэтому технически чистое Fe (применяется в электротехнике), структуру которого представляют зерна феррита, хорошо подвергается холодной деформации, т.е. хорошо штампуется, прокатывается, протягивается в холодном состоянии. Чем больше феррита в Fe − C сплавах, тем они более пластичны.
80 кгс/мм2) и прочностью (σв= 250 МПа) и высокую пластичность: его относительное удлинение перед разрывом δ = 50%. Поэтому технически чистое Fe (применяется в электротехнике), структуру которого представляют зерна феррита, хорошо подвергается холодной деформации, т.е. хорошо штампуется, прокатывается, протягивается в холодном состоянии. Чем больше феррита в Fe − C сплавах, тем они более пластичны.








