Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Механизм сопряжения окисления и фосфорилированияСодержание книги
Поиск на нашем сайте
Каким же образом осуществляется сопряжение этих двух процессов? Наиболее обоснованный ответ на этот вопрос даёт хемиосмотическая теория Митчелла, предложенная им в 1961 г. Основные положения были подтверждены и разработаны детально совместными усилиями многих исследователей в последующие годы. 1. Протонный градиент и электрохимический потенциал Перенос электронов по дыхательной цепи от NADH к кислороду сопровождается выкачиванием протонов из матрикса митохондрий через внутреннюю мембрану в межмембранное пространство. На эту работу затрачивается часть энергии электронов, переносимых по ЦПЭ. Протоны, перенесённые из матрикса в межмембранное пространство, не могут вернуться обратно в матрикс, так как внутренняя мембрана непроницаема для протонов. Таким образом, создаётся протонный градиент, при котором концентрация протонов в межмембранном пространстве больше, а рН меньше, чем в матриксе. Кроме того, каждый протон несёт положительный заряд, и вследствие этого появляется разность потенциалов по обе стороны мембраны: отрицательный заряд на внутренней стороне и положительный - на внешней. В совокупности электрический и концентрационный градиенты составляют электрохимический потенциал ΔμН+ - источник энергии для синтеза АТФ. Так как наиболее активный транспорт протонов в межмембранное пространство, необходимый для образования ΔμН+, происходит на участках ЦПЭ, соответствующих расположению комплексов I, III и IV, эти участки называют пунктами сопряжения дыхания и фосфорилирования.Механизм транспорта протонов через мито-хондриальную мембрану в пунктах сопряжения недостаточно ясен. Однако установлено, что важную роль в этом процессе играет KoQ. Наиболее детально механизм переноса протонов при участии KoQ изучен на уровне комплекса III.KoQ переносит электроны от комплекса I к комплексу III и протоны из матрикса в межмембранное пространство, совершая своеобразные циклические превращения, называемые Q-циклами. Донором электронов для комплекса III служит восстановленный убихинон (QH2), а акцептором - цитохром с. Цитохром с находится с внешней стороны внутренней мембраны митохондрий; там же располагается активный центр цитохрома с1 с которого электроны переносятся на цитохром с.В мембране существует стационарный общий фонд Q/QH2, из которого каждая молекула QH2 в одном цикле обеспечивает перенос протонов из матрикса в межмембранное пространство и электронов, которые в конечном итоге поступают на кислород. На работу, совершаемую при выкачивании протонов, расходуется часть свободной энергии, которая освобождается при переносе электронов по градиенту редокс-потенциала. Энергия электрохимического потенциала (∆μH+) используется для синтеза АТФ, если протоны возвращаются в матрикс через ионные каналы АТФ-синтазы.
2. Строение АТФ-синтазы и синтез АТФ АТФ-синтаза (Н+-АТФ-аза) - интегральный белок внутренней мембраны митохондрий. Он расположен в непосредственной близости к дыхательной цепи. АТФ-синтаза состоит из 2 белковых комплексов, обозначаемых как F0 и F1.Гидрофобный комплекс F0 погружён в мембрану. Он служит основанием, которое фиксирует АТФ-синтазу в мембране. Комплекс F0 состоит из нескольких субъединиц, образующих канал, по которому протоны переносятся в матрикс.Комплекс F1 выступает в митоховдриальный матрикс. Он состоит из 9 субъединиц (Зα, 3β, γ, ε, δ). Субъединицы аир уложены попарно, образуя "головку"; между α- и β-субъединицами располагаются 3 активных центра, в которых происходит синтез АТФ; γ-, ε-, δ- субъединицы связывают комплекс F1 с F0.Повышение концентрации протонов в межмембранном пространстве активирует АТФ-синтазу. Электрохимический потенциал ΔμH+ заставляет протоны двигаться по каналу АТФ-синтазы в матрикс. Параллельно под действием ΔμH+ происходят конформационные изменения в парах α, β-субъединиц белка F1, в результате чего из АДФ и неорганического фосфата образуется АТФ. Электрохимический потенциал, генерируемый в каждом из 3 пунктов сопряжения в ЦПЭ, используют для синтеза одной молекулы АТФ. 3.Коэффициент окислительногофосфорилирования Окисление молекулы NADH в ЦПЭ сопровождается образованием 3 молекул АТФ; электроны от FAD-зависимых дегидрогеназ поступают в ЦПЭ на KoQ, минуя первый пункт сопряжения. Поэтому образуются только 2 молекулы АТФ. Отношение количества фосфорной кислоты (Р), использованной на фосфорилирование АДФ, к атому кислорода (О), поглощённого в процессе дыхания, называют коэффициентом окислительного фосфорилирования и обозначают Р/О. Следовательно, для NADH Р/О = 3, для сукцината Р/О - 2. Эти величины отражают теоретический максимум синтеза АТФ, фактически эта величина меньше.
4.Дыхательный контроль Окисление субстратов и фосфорилирование АДФ в митохондриях прочно сопряжены. Скорость использования АТФ регулирует скорость потока электронов в ЦПЭ. Если АТФ не используется и его концентрация в клетках возрастает, то прекращается и поток электронов к кислороду. С другой стороны, расход АТФ и превращение его в АДФ увеличивает окисление субстратов и поглощение кислорода. Зависимость интенсивности дыхания митохондрий от концентрации АДФ называют дыхательным контролем. Механизм дыхательного контроля характеризуется высокой точностью и имеет важное значение, так как в результате его действия скорость синтеза АТФ соответствует потребностям клетки в энергии. Запасов АТФ в клетке не существует. Относительные концентрации АТФ/АДФ в тканях изменяются в узких пределах, в то время как потребление энергии клеткой, т.е. частота оборотов цикла АТФ и АДФ, может меняться в десятки раз. Общее содержание АТФ в организме 30-50 г, но каждая молекула АТФ в клетке "живёт" меньше минуты. В сутки у человека синтезируется 40-60 кг АТФ и столько же распадается. Увеличение концентрации АДФ немедленно приводит к ускорению дыхания и фосфорилирования.
17) Установлено, что окисление жирных кислот протекает в печени, почках, скелетных и сердечной мышцах, в жировой ткани. В мозговой ткани скорость окисления жирных кислот весьма незначительна; основным источником энергии в мозговой ткани служит глюкоза. В 1904 г. Ф. Кнооп (F.Knoop) выдвинул гипотезу Р-окисления жирных кислот на основании опытов по скармливанию собакам различных жирных кислот, в которых один атом водорода в концевой метильной группе (ш-углеродного атома) был замещен радикалом (С6Н5—). Ф. Кнооп высказал предположение, что окисление молекулы жирной кислоты в тканях организма происходит в Р-положении. В результате от молекулы жирной кислоты последовательно отщепляются двууглеродные фрагменты со стороны карбоксильной группы. Жирные кислоты, входящие в состав естественных жиров животных и растений, имеют четное число углеродных атомов. Любая такая кислота, от которой отщепляется по паре углеродных атомов, в конце концов проходит через стадию масляной кислоты. После очередного Р-окисления масляная кислота становится ацетоуксусной. Последняя затем гидроли-зуется до двух молекул уксусной кислоты. Теория Р-окисления жирных кислот, предложенная Ф. Кноопом, в значительной мере послужила основой современных представлений о механизме окисления жирных кислот. Доставка жирных кислот к месту их окисления—к митохондриям — происходит сложным путем: при участии альбумина осуществляется транспорт жирной кислоты в клетку; при участии специальных белков (fatty acid binding proteins, FABP) — транспорт в пределах цитозоля; при участии карнитина — транспорт жирной кислоты из цитозоля в митохондрии. Процесс окисления жирных кислот складывается из следующих основных этапов. Активация жирных кислот. Свободная жирная кислота независимо от длины углеводородной цепи является метаболически инертной и не может подвергаться никаким биохимическим превращениям, в том числе окислению, пока не будет активирована. Активация жирной кислоты протекает на наружной поверхности мембраны митохондрий при участии АТФ, коэнзима A (HS-KoA) и ионов Mg2+. Реакция катализируется ферментом ацил-КоА-синтетазой:
В результате реакции образуется ацил-КоА, являющийся активной формой жирной кислоты.
Считают, что активация жирной кислоты протекает в 2 этапа. Сначала жирная кислота реагирует с АТФ с образованием ациладенилата, представляющим собой эфир жирной кислоты и АМФ. Далее сульфгидрильная группа КоА действует на прочно связанный с ферментом ациладенилат с образованием ацил-КоА и АМФ.Транспорт жирных кислот внутрь митохондрий. Коэнзимная форма жирной кислоты, в равной мере как и свободные жирные кислоты, не обладает способностью проникать внутрь митохондрий, где, собственно, и протекает их окисление. Переносчиком активированных жирных кислотРеакция протекает при участии специфического цитоплазматического фермента карнитин-ацилтрансферазы. Уже на той стороне мембраны, которая обращена к матриксу, ацильная группа переносится обратно на КоА, что термодинамически выгодно, поскольку О-ацильная связь в кар-нитине обладает высоким потенциалом переноса группы. Иными словами, после прохождения ацилкарнитина через мембрану митохондрий происходит обратная реакция—расщепление ацилкарнитина при участии HS-KoA и митохондриальной карнитин-ацилтрансферазы:
Внутримитохондриальное окисление жирных кислот. Процесс окисления жирной кислоты в митохондриях клетки включает несколько последовательных энзиматических реакций. Первая стадия дегидрирования. Ацил-КоА в митохондриях прежде всего подвергается ферментативному дегидрированию, при этом ацил-КоА теряет 2 атома водорода в а – и в-положениях, превращаясь в КоА-эфир ненасыщенной кислоты. Таким образом, первой реакцией в каждом цикле распада ацил-КоА является его окисление ацил-КоА-де-гидрогеназой, приводящее к образованию еноил-КоА с двойной связью между С-2 и С-3:
Существует несколько ФАД-содержащих ацил-КоА-дегидрогеназ, каждая из которых обладает специфичностью по отношению к ацил-КоА с определенной длиной углеродной цепи. Стадия гидратации. Ненасыщенный ацил-КоА (еноил-КоА) при участии фермента еноил-КоА-гидратазы присоединяет молекулу воды. В результате образуется в-оксиацил-КоА (или 3-гидроксиацил-КоА):
Заметим, что гидратация еноил-КоА стереоспецифична, подобно гидратации фумарата и аконитата (см. с. 348). В результате гидратации транс-А2-двойной связи образуется только L-изомер 3-гидроксиацил-КоА.Вторая стадия дегидрирования. Образовавшийся в-оксиацил-КоА (3-гидроксиацил-КоА) затем дегидрируется. Эту реакцию катализируют НАД+-зависимые дегидрогеназы:
Тиолазная реакция. В ходе предыдущих реакций происходило окисление метиленовой группы при С-3 в оксогруппу. Тиолазная реакция представляет собой расщепление 3-оксоацил-КоА с помощью тиоловой группы второй молекулы КоА. В результате образуется укороченный на два углеродных атома ацил-КоА и двууглеродный фрагмент в виде ацетил-КоА. Данная реакция катализируется ацетил-КоА-ацилтрансферазой (в-ке-тотиолазой):
Образовавшийся ацетил-КоА подвергается окислению в цикле трикар-боновых кислот, а ацил-КоА, укоротившийся на два углеродных атома, снова многократно проходит весь путь в-окисления вплоть до образования бутирил-КоА (4-углеродное соединение), который в свою очередь окисляется до 2 молекул ацетил-КоА (рис. 11.2). Например, при окислении пальмитиновой кислоты (С16) повторяется 7 циклов в-окисления. Запомним, что при окислении жирной кислоты, содержащей п углеродных атомов, происходит n/2—1 цикл в-окисления (т. е. на один цикл меньше, чем n/2, так как при окислении бутирил-КоА сразу происходит образование 2 молекул ацетил-КоА) и всего получится п/2 молекул ацетил-КоА.
18) С17Н35СООН + [O] = 18CO2 +18H2O При метаболизме жир ных кислот выход энергии составляет 8 молекул АТФ на 1 атом углерода. Например, при окислении 1 молекулы стеариновой кислоты образуется 104 атома Н и 148 молекул АТФ.Стеариновая кислота относится к насыщенным жирным кислотам CH3-(CH2)16-СООН 1)активация(Ацил-КоА-синтетаза)
2. Ацил-S-КоА не способен проходить через митохондриальную мембрану, поэтому существует способ его переноса в комплексе с витаминоподобным веществом карнитином. На наружной мембране митохондрий имеется фермент карнитин-ацилтрансфераза I.
3. После связывания с карнитином жирная кислота переносится через мембрану транслоказой. Здесь на внутренней стороне мембраны фермент карнитин-ацилтрансфераза II вновь образует ацил-S-КоА который вступает на путь β-окисления. 4. Процесс собственно β-окисления состоит из 4-х реакций, повторяющихся циклически. В них последовательно происходит окисление (ацил-SКоА-дегидрогеназа), гидратирование (еноил-SКоА-гидратаза) и вновь окисление 3-го атома углерода (гидроксиацил-SКоА-дегидрогеназа). В последней, трансферазной, реакции от жирной кислоты отщепляется ацетил-SКоА. К оставшейся (укороченной на два углерода) жирной кислоте присоединяется HS-КоА, и она возвращается к первой реакции. Все повторяется до тех пор, пока в последнем цикле не образуются два ацетил-SКоА. Реакции бета-окисления жирных кислот
Окисление стеариновой кислоты так как имеется 18 атомов углерода, то при β-окислении образуется 9 молекул ацетил-SКоА. Последний поступает в ЦТК, при его окислении в одном обороте цикла образуется 3 молекулы НАДН, 1 молекула ФАДН2 и 1 молекула ГТФ, что эквивалентно 12 молекулам АТФ. Итак, 9 молекул ацетил-S-КоА обеспечат образование 9×12=108 молекул АТФ.
для стеариновой кислоты число циклов β-окисления равно 8. В каждом цикле образуется 1 молекула ФАДН2 и 1 молекула НАДН. Поступая в дыхательную цепь, в сумме они "дадут" 5 молекул АТФ. Таким образом, в 8 циклах образуется 8×5=40 молекул АТФ. двойных связей в стеариновой кислоте нет. ∑148 АТФ на активацию жирной кислоты идет 1 молекула АТФ, которая, однако, гидролизуется до АМФ, то есть тратятся 2 макроэргические связи или две АТФ. 148-2(или 1 надо уточнить)=146(147)
С17Н35СООН + 26 О2 = 18 СО2 + 18 Н2О. Молекул АТФ 19, 20,21??? Жирные кислоты во многих тканях (в первую очередь в скелетных мышцах и миокарде) вовлекаются в специфический процесс – -окисление, протекающее в митохондриях. Все превращения ЖК начинаются с их активации — образования ацил-КоА. Мембрана митохондрий непроницаема для жирных кислот, в том числе и в форме ацил-КоА. Их перенос обеспечивается карнитином. В митохондриях на митохондриальном матриксе происходит окисление жирных кислот, сопряженное с окислительным фосфорилированием (с синтезом АТФ). -окисление протекает по следующей схеме: В первой реакции происходит дегидрирование при участии ФАД-зависимой дегидрогеназы. Затем присоединение воды (гидроксил – в -положение) с образованием -гидроксиацил-КоА. Дегидрирование НАД-зависимой дегидрогеназой у -углеродного атома приводит к образованию -кетоацил-КоА. Заключительный этап катализирует тиолаза, расщепляющая тиосвязь с участием HS-Коэнзима-А, что приводит к образованию ацетил-КоА и ацил-КоА с укороченной на два углеродных атома цепью. Ацетильный остаток ацетил-КоА окисляется в цикле Кребса, укороченная жирная кислота вовлекается в повторный цикл -окисления. В конечном счете, она распадается на такое количество остатков ацетила, которое в два раза меньше числа атомов углерода в ней. При окислении жирных кислот с нечетным количеством углеродных атомов на последнем цикле -окисления образуется ацетил-КоА и активная форма пропионовой кислоты (пропионил-КоА). Пропионил-КоА карбоксилируется до метилмалонил-КоА и изомеризуется в сукцинил-КоА. Последний поступает в ЦТК.
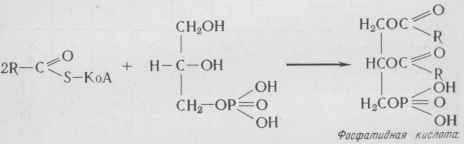
Синтез триацилглицеринов Для синтеза триацилглицеринов необходимы глицерол-3- фосфат и КоА - производное жирной кислоты. Глицерол-3-=фосфат может образоваться двумя путями: 1) из диоксиацетонфосфата: Диоксиацетонфосфат 2) из глицерина и АТФ: Глицерин-]-АТФ -г- Глицерол -3 -фосфат-]- АДФ. Образование триацилглицеринов начинается с ацилирова-ния свободных гидроксильных групп глицерофосфата двумя молекулами КоА - производного жирной кислоты с образованием фосфатидных кислот:
Затем фосфатидные кислоты гидролизуются с образованием диацилглицеринов, которые, реагируя с третьей молекулой КоА - производного жирной кислоты, образуют триацилглице-рины:
Образование триацилглицеринов в созревающих семенах может быть прослежено по изменению содержания в них свободных жирных кислот, легко определяемому по величине кислотного числа масла в семенах. Кислотное число масла в семенах - количество миллиграммов КОН, необходимое для нейтрализации свободных жирных кислот в 1 г липидов, - для всех масличных культур по мере созревания понижается. У семян подсолнечника, например, наблюдается хорошо выраженная зависимость кислотного числа масла в семенах от степени зрелости их и местоположения в соцветии. Кислотное число масла в семенах увеличивается от периферии соцветия к его центру. Снижение кислотного числа масла в созревающих семенах идет очень быстро и к концу созревания приобретает минимальные значения (менее единицы) (см. рис. 22). Штумпфом (1962) и Стайном (1972) были высказаны положения о том, что синтез триацилглицеринов происходит в митохондриях и микросомах. Это положение базировалось прежде всего на том, что ферменты, ответственные за их синтез, наивысшую активность проявляли именно в микросомальных фракциях. Затем эти ферменты были найдены на мембранах митохондрий и эндоплазматическом ретикулуме. Эти интересные наблюдения не могут дать, к сожалению, ответа на многие вопросы. Если молекулы триацилглицеринов, не способные проникать через мембраны митохондрий, синтезируются только внутри митохондрий, то количество триацилглицеринов в клетке должно лимитироваться объемом митохондрий. В то же время известно, что у масличных растений запасы триацилглицеринов занимают основную часть объема клетки. И. И. Свешниковой (1967) было показано, что в клетках созревающих масличных семян жир появляется первоначально в пластидах эндосперма. Изучение клеток алейронового слоя зерновки риса в электронном микроскопе показало, что капли синтезируемого жира неизменно связываются с пузырьками эндоплазматической сети (ретикулума), занимающей основной объем клетки алейронового слоя. Можно поэтому предполагать, что в митохондриях происходит лишь синтез жирных кислот. А. Г. Верещагин (1972) также считает митохондриальный синтез триацилглицеринов маловероятным и полагает, что образование триацилглицеринов связано с мембранами эндоплазмати-ческого ретикулума, усеянными рибосомами.
|
|||||||||
|
Последнее изменение этой страницы: 2017-02-21; просмотров: 385; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 13.59.96.255 (0.014 с.) |








 CH3-(CH2)16-СООН+HS-KoA+АТФCH3-(CH2)16-СО-S-КоА+АМФ+ФФн
CH3-(CH2)16-СООН+HS-KoA+АТФCH3-(CH2)16-СО-S-КоА+АМФ+ФФн