
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Тема 11. Гальванический элемент ⇐ ПредыдущаяСтр 4 из 4
231. Какую информацию содержит электрохимический ряд стандартных электродных потенциалов о сравнительной активности восстановленной и окисленной форм металлов? Почему он даёт возможность оценить ЭДС гальванических элементов, составленных из любых пар металлов? Рассчитайте ЭДС медно-кадмиевого гальванического элемента, металлические пластины в котором опущены в растворы соответствующих солей с молярной концентрацией 1 моль/дм3. 232. Что называют стандартным водородным электродом? Для каких целей используют его? Вычислите ЭДС гальванического элемента, состоящего из стандартного водородного электрода и кадмиевого электрода, погружённого в раствор с молярной концентрацией CdSO4 0,1 моль/дм3. 233. Какие процессы происходят на электродах гальванического элемента, образованного железной пластиной, погружённой в раствор с [Fe2+] = 0,001 моль/дм3, и серебряной, погружённой в раствор соли серебра. Определите концентрацию ионов Ag+ в растворе его соли, если ЭДС элемента 1,152 В. 234. В чём отличие аккумуляторов от гальванических элементов? Какие химические процессы протекают на электродах при зарядке и разрядке свинцового аккумулятора? 235. Что называется электродным потенциалом? Вычислите ЭДС гальванического элемента, образованного цинковым электродом, погруженным в раствор с молярной концентрацией ZnSO4 0,1 моль/дм3 и никелевым электродом, погружённым в раствор с молярной концентрацией NiSO4 0,1 моль/дм3. 236. От каких факторов зависит величина электродных потенциалов? Составьте электронные уравнения процессов, протекающих на электродах гальванического элемента: (-) Zn | ZnCl2 || CdCl2 | Cd (+). Вычислите ЭДС этого элемента зная, что [ Zn2+] и [ Cd2+] соответственно равны 0,01 и 0,1 моль/дм3. 237. Что представляет собой водородный электрод? Вычислите ЭДС гальванического элемента: (-) Mg | MgSO4 || NiSO4 | Ni (+) зная, что [Mg2+] = [Ni2+] = 1 моль/дм3. Изменится ли величина ЭДС, если [Mg2+] и [Ni2+] понизить до 0,01 моль/дм3. 238. Что такое стандартный электродный потенциал? Что является восстановителем, а что окислителем в гальваническом элементе, составленном из меди, погружённой в раствор CuSO4 и серебра, погружённого в раствор АgNO3? Составьте схему этого элемента и напишите электронные уравнения процессов, протекающих на электродах.
239. По какому принципу построен ряд напряжений металлов? Составьте схемы двух гальванических элементов, в одном из которых кадмий является катодом, а в другом - анодом. Напишите электронные уравнения процессов, происходящих на электродах. 240. Почему водородный электрод в паре с медным является анодом, а в паре с цинковым - катодом? Вычислите ЭДС гальванического элемента: (-) Cd | Cd(NO3)2 || AgNO3 | Ag (+) зная, что [Cd2+] и [Ag+] соответственно равны 0,001 и 0,01 моль/дм3. 241. Какие электродные потенциалы называют стандартными? В какой последовательности их принято располагать? Составьте схему гальванического элемента, при работе которого протекает реакция: Ni + Pb(NO3)2 = Ni(NO3)2 + Pb, и электронные уравнения процессов, происходящих на электродах. 242. Во всех ли случаях характеристика металлов по значению их ионизационных и электродных потенциалов совпадает? Приведите примеры. Составьте схемы двух гальванических элементов, в одном из которых никель является анодом, в другом - катодом, выразив электронными уравнениями процессы, протекающие на электродах. 243. Чем определяется направленность движения электронов во внешней и ионов во внутренней цепи гальванического элемента? Процессы, проходящие на электродах при работе гальванического элемента, выражаются электронными уравнениями: А: Znо - 2e = Zn+2, К: Pb+2 +2e = Pbо. Составьте схему этого элемента и напишите уравнение происходящей реакции. 244. Что называют стандартным водородным электродом? Для каких целей его используют? Чему равна ЭДС медно-цинкового гальванического элемента, если молярные концентрации растворов ZnSO4 и CuSO4 соответственно равны 0,1 и 0,01 моль/дм3? 245. Как можно найти электродный потенциал металла (Е) при любых значениях температуры и концентрации раствора его соли, если для него известен стандартный электродный потенциал Ео? При каких условиях Е = Ео? Напишите уравнение реакции, протекающей в гальваническом элементе, схема которого: (-) Fe | Fe+3 || Ag+ | Ag (+). Рассчитайте ЭДС этого гальванического элемента при стандартных условиях. 246. Какие изменения концентраций растворов солей на электроде - окислителе и электроде - восстановителе приводят к увеличению и уменьшению ЭДС? Вычислите ЭДС гальванического элемента, составленного из стандартного водородного электрода и цинкового электрода, погружённого в раствор с молярной концентрацией ZnSO4 0,01 моль/дм3.
247. Какие электродные потенциалы называют стандартными? В какой последовательности их принято располагать? Вычислите ЭДС гальванического элемента, состоящего из двух свинцовых пластин, одна из которых погружена в раствор с молярной концентрацией Pb(NO3)2 1 моль/дм3, а вторая - в раствор с молярной концентрацией этой же соли 0,001 моль/дм3. 248. Как можно выровнять электродные потенциалы двух металлов при небольшом их различии, меняя концентрацию растворов солей? Какой концентрации следует взять раствор CdSO4 для того, чтобы электродный потенциал кадмия стал равным стандартному электродному потенциалу железа? 249. Как осуществляется взаимодействие двух окислительно-восстановитель-ных систем при работе гальванического элемента и что называют его ЭДС? Процессы, протекающие на электродах при работе гальванического элемента, выражаются электронными уравнениями: А: Cu + 2e = Cu+2, К: Ag++ e = Ag. Составьте схему этого элемента и напишите уравнение происходящей реакции. 250. Какой эксперимент позволяет быстро определить, имеет ли данный металл положительное или отрицательное значение электродного потенциала? Электродами гальванического элемента являются две серебряные пластины, опущенные в раствор AgNO3 с молярными концентрациями 0,1 моль/дм3 и 0,0001 моль/дм3. Вычислите ЭДС гальванического элемента.
Тема 12. Электролиз
251. Как называют процесс, при котором электрическая энергия превращается в химическую, в каких устройствах это осуществляется? Какая масса меди выделится на катоде, если через раствор CuSO4 пропускать ток силой 4А в течение 1-го часа? 252. Чем обусловлено направление движения ионов электролита в процессе электролиза, какую роль играет внешний источник тока? Сколько времени надо пропускать ток силой 8А, чтобы из раствора AgNO3 выделилось 5,3935 г серебра? 253. Чем отличается электролиз водных растворов электролитов от электролиза их расплавов? Вычислите молярную массу эквивалентов металла, если при пропускании через раствор хлорида этого металла 3880 Кл электричества на катоде выделяется 11,742 г металла. 254. Какие ионы и молекулы, находящиеся в водных растворах солей, могут восстанавливаться на катоде и окисляться на аноде? Составьте уравнения соответствующих реакций. Какой силы ток следует пропускать через раствор NaCl в течение 1 часа 40 мин 25 сек, чтобы на катоде выделилось 1,4 дм3 водорода, измеренного при нормальных условиях. 255. Какое вещество выделяется на аноде при электролизе расплавов щелочей? Какая масса Н2О разложилась при пропускании через раствор K2SO4 тока силой 4А в течение 3 час? 256. На чём основан метод очистки металлов электролизом? Через раствор NaCl пропущен ток силой 15А в течение 16 мин 5 сек. Какой объём водорода (н.у.) выделился на катоде? 257. Какими катодными процессами характеризуется электролиз водных растворов солей металлов, стоящих в начале ряда напряжений и в средней его части? Чем это определяется? Сколько времени пропускали ток силой 8А через раствор сульфата никеля, если масса никелевого анода стала меньше на 0,8805 г?
258. Приведите формулировку закона Фарадея? Каковы его математические выражения? Что называют числом Фарадея? Составьте электронные уравнения процессов, происходящих на инертных электродах при электролизе растворов CdCl2 и CdSO4. 259. В чём различие катодных реакций, происходящих при электролизе растворов сульфата меди (II) и cульфата калия на инертных электродах? Ток силой 10А пропускали в течение 20 мин через раствор сульфата меди (II) на медном аноде. На сколько граммов уменьшилась масса анода? 260. Из каких процессов слагается общая реакция электрохимического разложения вещества? Составьте электронные уравнения процессов, происходящих на электродах при электролизе раствора MgCl2. Вычислите массы веществ, которые выделятся из раствора при пропускании тока силой 5А в течение 32 мин 10 сек. 261. Что называется электрохимическим эквивалентом? Каким соотношением он связан с молярной массой химических эквивалентов вещества и числом Фарадея? За 10 мин из раствора платиновой соли ток силой 5А выделил 1,517 г платины. Определите молярную массу эквивалентов платины. 262. Почему катоды при электролизе и в гальваническом элементе имеют разные знаки? Какая масса серебра и какой объём газа (н.у.) выделились на электродах при электролизе раствора AgNO3 в течение 35 мин, при силе тока 2,5А. 263. Что называют анодным растворением металла и при каких условиях возможен этот процесс? При электролизе раствора CuCl2 на аноде выделилось 0,56 дм3 хлора (н.у.). Найдите массу меди, выделившейся на катоде. 264. Какой газ выделяется при электролизе растворов хлоридов солей на аноде? Через раствор NaCl пропускали ток силой 15А в течение 16 мин 15 сек. Какой объём водорода (н.у.) выделился на катоде? Какая масса NaOH образовалось у катода? 265. Какое различие катодных реакций, происходящих при электролизе расплавов и водных растворов солей металлов, стоящих в начале электрохимического ряда металлов? Какой объём кислорода (н.у.) выделится при пропускании тока силой 6А в течение 30 мин через водный раствор КОН? 266. Какие электрохимические процессы протекают на электродах при электролизе расплава электролитов? Приведите примеры. Какое количество электричества потребуется для полного электрохимического разложения 0,2 дм3 раствора с молярной концентрацией сульфата кадмия 0,25 моль/дм3. 267. Из каких процессов слагается общая реакция электрохимического разложения вещества? Какое количество электричества в А.ч потребуется для получения чистой меди из 1-го кг черновой меди, содержащей 5 % примесей.
268. Если на электродах могут протекать несколько электрохимических процессов, то какой из них реализуется? что является критерием, определяющим преимущество? При электролизе раствора хлорида меди (II) масса катода увеличилась на 3,2 г. Какой объём газа (н.у.) выделится за это время на угольном аноде? 269. Какова последовательность электродных процессов на аноде электролизёра? Составьте электронные уравнения процессов, происходящих на инертных электродах при электролизе растворов Cd(NO3)2 и CdCl2. Одинаковый ли объём газов выделится на аноде, если через электролизёр пропустить ток силой 20А в течение часа? 270. Всегда ли масса выделившегося на электроде вещества соответствует количеству электричества, прошедшего через электролит? Что называется выходом по току? Через раствор AgNO3 пропускали ток силой 5А в течение 15 мин. Какая масса серебра выделилась, если выход по току составил 85 %? Тема 13. Коррозия металлов 271. С чем связано, что слой цинка на оцинкованном железе называют «жертвенным анодом»? Составьте электронные уравнения анодного и катодного процессов коррозии оцинкованного железа при нарушении покрытия во влажном воздухе и в кислой среде. 272. В чем сущность химической коррозии металлов? Составьте электронные уравнения коррозии железа при высокой температуре в атмосфере сухого воздуха. 273. Чем отличается электрохимическая коррозия от химической? Составьте электронные уравнения коррозии железа во влажном воздухе. 274. Что такое легирование? Для чего оно применяется? Составьте электронные уравнения катодного и анодного процессов коррозии стального изделия с алюминиевыми клеммами в сернокислой среде. 275. Что такое коррозия металлов? Составьте электронные уравнения коррозии железа, изделие из которого обмотано медной проволокой, во влажном воздухе и растворе хлороводородной кислоты. 276. В чем суть протекторной защиты металлов от коррозии? Приведите примеры металлов, которые можно использовать для протекторной защиты железа от коррозии. Составьте электронные уравнения соответствующих процессов. 277. Какова сущность электрохимической катодной защиты металлов? Приведите примеры и покажите на одном из них процессы окисления и восстановления. 278. Какие покрытия называют анодными, а какие - катодными? Составьте электронные уравнения катодных и анодных процессов атмосферной коррозии лужёного и оцинкованного железа. 279. Какое покрытие - анодное или катодное - более эффективно? Составьте электронные уравнения катодных и анодных процессов коррозии луженого железа и луженой меди во влажном воздухе и кислой среде. 280. Почему в природе в самородном виде встречаются только благородные металлы? В каком случае процесс коррозии цинка будет проходить интенсивнее, если в раствор хлороводородной кислоты поместить цинковую пластинку и цинковую пластинку, частично покрытую медью? Составьте электронные уравнения соответствующих процессов.
281. Как влияет на атмосферную коррозию стали состав атмосферы, продукты коррозии, температура и время года? Какие процессы происходят при работе стальной детали в контакте с оловом во влажном воздухе? 282. Какое влияние на скорость коррозии оказывает скорость движения раствора электролита? Объясните бурное выделение водорода на медной пластине в растворе HCl, которое наблюдается при прикосновении к ней цинковой пластины. Составьте электронные уравнения катодного и анодного процессов и напишите уравнение реакции. 283. Каким способом наносятся металлические покрытия? Железное изделие покрыто свинцом. Составьте электронные уравнения анодного и катодного процессов коррозии этого изделия при нарушении покрытия во влажном воздухе и серной кислоте. 284. Что такое ингибиторы? В каком случае их применяют? Какой из металлов будет корродировать, если в щелочную среду поместить оловянное изделие с серебряным кольцом? Напишите уравнение реакции. 285. В чем отличие неметаллических покрытий от металлических? Какой из металлов будет окисляться в случае нарушения покрытия хромированного железа во влажном воздухе, содержащем оксид углерода (IV) и оксид серы (VI). Составьте уравнения протекающих химических реакций. 286. Какое явление называется пассивацией металла? Если гвоздь вбить во влажное дерево, то ржавчиной покрывается та часть, которая находится внутри дерева, анодом или катодом она является? Составьте электронные уравнения протекающих процессов. Как изменится процесс коррозии гвоздя, если предварительно его обработать в концентрированной серной кислоте? 287. Как изменяют коррозионную среду для снижения скорости коррозионного процесса? Какой металл будет корродировать, если в раствор серной кислоты поместить изделие из алюминия с медными заклепками. Напишите уравнения протекающих реакций в растворе. 288. Какие вещества называют ингибиторами коррозии? Две железные пластинки, частично покрытые, одна - оловом, другая - медью, находятся во влажном воздухе. На какой из этих пластинок быстрее образуется ржавчина? Почему? Составьте электронные уравнения протекающих процессов. 289. На чем основана электрохимическая защита металлов и какие разновидности её известны? Поясните, чем определяется выбор другого металла в одном случае и какова роль электрического тока от внешнего источника - в другом. 290. В чем заключается сущность катодной защиты металлов? В раствор сульфата меди (II) поместили цинковую и железную пластины. Составьте электронные и ионные уравнения реакций, происходящих на каждой из этих пластин. Какие процессы будут проходить на пластинах, если наружные концы их соединить проводником? Приложение
Таблица 1
Термодинамические свойства веществ
Продолжение приложения
Таблица 2
Стандартные электродные потенциалы Ео некоторых металлов (ряд напряжений)
Окончание приложения
Таблица 3
Константы диссоциации некоторых слабых электролитов
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2017-02-19; просмотров: 319; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 13.58.112.1 (0.036 с.) |
 кДж/
моль
кДж/
моль
 Дж/
моль.К
Дж/
моль.К
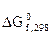 кДж/моль
кДж/моль
 /2Hg
/2Hg



