Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Дози І тип введення препаратів в циклі оpраСодержание книги
Поиск на нашем сайте
Дози і тип введення препаратів в циклі ОЕРА
Дози і тип введення препаратів в циклі СОРР
* Разом вводиться 200 мг/м2 MESNA (Уромітексан) у 0, 4, 8, годин по відношенню до початку інфузії Циклофосфаміду.
Схема блоку ВЕАСОРР
Схема блоку ВЕАСОРР + Г-КСФ (“підсилений”)
Ризик-фактори: а – велика (bulky) медиастинальна пухлина (>1/3 максимального поперечного діаметру грудної клітини) В – ураження екстралімфатичних зон с – ШОЕ >= 50 мм/год для „А”-стадій та >=30 мм/год для „В”-стадій d - 3 або більше уражених лімфатичних зон (не плутати з „лімфатичними регіонами” за класифікацією “Ann Arbor”!)
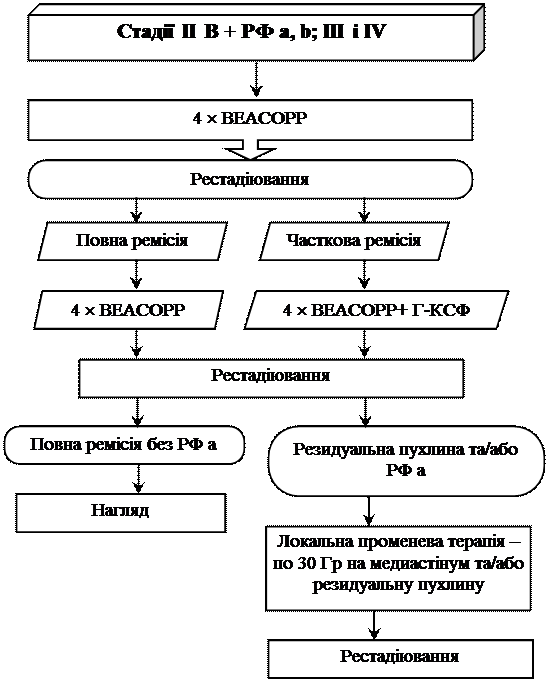
Схема лікування ЛГМ у дітей у відповідності до стадії захворювання (0 – 15 років)
* При значній резидуальній пухлині доза опромінення підвищується до 35 Гр.
Схема лікування хворих з продвиненими стадіями захворювання (15 – 18 років) (HD 12)
Схема лікування хворих з непродвиненими стадіями захворювання (15 – 18 років) (HD 11)
ПРОТОКОЛ ЛІКУВАННЯ ДІТЕЙ З ГОСТРИМИ МІЄЛОЇДНИМИ ЛЕЙКОЗАМИ Шифри МКХ-10: С 92.0, С 93.0, С 94.0 Гострі мієлоїдні лейкози відносяться до досить поширених у дитячому віці онкологічних захворювань: частота їх в середньому становить 0,7 випадки на 100 000 дитячого населення на рік. Поняття „гострих мієлолейкозів” об’єднує групу захворювань, які за ВООЗ-класифікацією (сучасна модернізована ФАБ-класифікаційна система) розділяються на 8 варіантів: - М0 (гострий недиференційований мієлоїдний лейкоз); - М1 (гострий мієлобластний лейкоз без ознак диференціонування); - М2 (гострий мієлобластний лейкоз з ознаками диференціонування); - М3 (гострий промієлоцитарний лейкоз); - М4 (гострий мієломоноцитарний лейкоз); - М5 (гострий монобластний лейкоз); - М6 (гострий еритроцитарний лейкоз); - М7 (гострий мегакаріоцитарний лейкоз). В основі цих захворювань лежить неконтрольоване розмноження малігнізованих (лейкемічних) клітин-попередників мієлоїдного ряду у кістковому мозку з наступним їх розповсюдженням гематогенним шляхом. Найбільш характерною ознакою гострих мієлолейкозів є недостатність кістковомозкового кровотворення внаслідок витіснення нормальних кровотворних клітин малігнізованими, що проявляється розвиком анемії, тромбоцитопенії та нейропенії з відповідною клінічною симптоматикою. Проліферативний синдром є характерним лише для деяких варіантів захворювання (монобластний лейкоз, мієломонобластний лейкоз) і проявляється частіше у вигляді гепато/спленомегалії, ніж збільшенні лімфатичних вузлів, оскільки малігнізовані лейкемічні клітини мають тропність не до лімфатичної, а до ретикулоендотеліальної системи. З цим також пов’язані також такі характерні для гострих мієлолейкозів ознаки, як інфільтрація нирок, шкіри, ясен, тощо. Ургентні ситуації під час діагностики гострих мієлолейкозів можуть бути найчастіше пов’язані з неконтрольованими кровотечами та/або крововиливами у життєво важливі органи, а також з тяжкими інфекціями (сепсис з загрозою або навіть реалізацією сепсис-шоку). Обов’язковими діагностичними заходами є пункція кісткового мозку з наступними цитологічним, цитохімічним, імуноцитологічними і цитогенетичним/молекулярно-генетичними дослідженнями лейкемічних (бластних) клітин (паралельно морфологічні дослідження також проводяться на бластних клітинах периферичної крові). Абсолютно необхідною є також здійснення діагностичної люмбальної пункції з вивченням ліквору на присутність лейкемічних клітин (бажано здійснення морфологічного дослідження клітин ліквору у цитоцентрифугаті, може проводитись також їх імуноцитологічний або цито/молекулярно-генетичний аналіз). Достатнім для діагнозу гострого мієлоїдного лейкозу є визначення у пункт аті кісткового мозку більше 20% лейкемічних клітин. Враховуючи складності у визначенні природи клітин, які мають морфологію „незрілих”, а також велику різноманітність морфологічних ознак лейкемічних клітин при різних варіантах гострих мієлолейкозів обов’язковим є проведення референції діагностичних морфологічних матеріалів у лабораторії, яка має значний досвід встановлення діагнозів гострих лейкозів. Прогностичне значення має визначення варіанту захворювання на основі морфо-цитохімічних даних і імуноцитологічних характеристик (варіанти М0 і М7 визначаються тільки на основі імуноцитологічного аналізу бластних клітин), наявність прогностично сприятливих чи, навпаки, несприятливих цитогенетичних аномалій, а також оцінка відповіді на терапію за швидкістю редукції бластних клітин в кістковому мозку при виконанні інтенсивного індукційного лікування. Лікування гострих мієлоїдних лейкозів є дуже складною лікувальною технологією, оскільки пов’язане з використанням інтенсивних програм поліхіміотерапії та необхідністю постійної профілактики і лікування викликаних як хворобою, так і терапією, небезпечних для життя хворого ускладнень (рівень летальності під час виконання протокольної хіміотерапії гострих лейкозів може становити 10%). Тому повноцінне куративне лікування хворих на гострий лейкоз повинно проводитись найбільш досвідченим медичним персоналом і тільки у відділеннях, які мають відповідну інфраструктуру (при цих умовах рівень безподійного виживання хворих може сягати 50 і більше %). За основу запропонованого лікувального протоколу прийнята остання версія німецького протоколу Групи BFM, в якій використовуються тільки елементи терапії, які вже довели свою максимальну ефективність у межах цієї терапевтичної стратегії і складається з одного (двох для пацієнтів групи високого ризику) індукційного курсів (AIE, HAM) консолідації ремісії двома блоками (AI, hAM), а також інтенсифікації (HD-AraC/VP-16,HAM). Особливості (зменшення загальної інтенсивності Протоколу і застосування цис-ретіноівої кислоти і індукційному періоді) має лікування хворих на гострий промієлоцитарний лейкоз (варіант М3), а також пацієнти з синдромом Дауна (виключення 2-ї індукції HAM з обсягу терапії, редукція дози Ідарубіцину, виключення краніального опромінення). Терапія супроводу при виконанні інтенсивної фази хіміотерапевтичного протоколу є дуже масивною і передбачає тотальну деконтамінацію кишковика, постійні трансфузії тромбоконцентрату і еритроцитарної маси, профілактичне та лікувальне застосування антибіотиків широкого спектру дії, антимікотичних препаратів, противірусних медикаментів, гепатопротекторів, кардиотропних ліків і ферментів, при необхідності – проведення часткового або тотального парентерального харчування. По закінченні інтенсивної фази поліхіміотерапії передбачається проведення опромінення головного мозку з чотирма інтратекальніми введеннями Цитарабіну і підтримуюча терапія 6-тіогуаніном щоденно з чотириденними блоками цитарабіну щомісяця. Пацієнтам групи високого ризику, які мають несприятливі цитогенетичні аномалії (моносомія (5), моносомія (7), інверсія (3), комплексні аномалії) та/або не досягли ремісії по закінченні 1-ї індукції пропонується виконання алогенної (при наявності HLA-сумісного донора) або аутологічної трансплантації стовбурових гемопоетичних клітин у першій ремісії захворювання. Хворим, які не досягли ремісії по закінченні 2-ї індукції, показаний перехід на сальваджну хіміотерапію з наступним виконанням процедури алогенної (при наявності донора) або аутологічної трансплантації стовбурових гемопоетичних клітин.
Лікування рецидивів гострих мієлоїдних лейкозів: - при ранньому рецидиві (менш ніж 1 рік після встановлення діалізу захворювання) показана протирецидивна терапія за схемою FLAG (Ida-FLAG, Mito-FLAG) або режими на базі використання низькодозового Цитарабіну з наступною алогенною трансплантацією стовбурових гемопоетичних клітин, (в окремих випадках може також розглядатися аутологічна трансплантація); - при пізньому рецидиві (1 рік та більше, з моменту встановлення діалізу захворювання) після здійснення протирецидивної терапії за однією з модифікацій схеми FLAG(або на базі використання низькодозового цитарабіну) та при наявності HLA-сумісного сімейного донора показане проведення алогенної трансплантації стовбурових гемопоетичних клітин, при відсутності сімейного донора після досягнення другої ремісії показане проведення аутологічної трансплантації стовбурових гемопоетичних клітин. Додаток до протоколу лікування дітей з гострими мієлоїдними лейкозами
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2017-02-16; просмотров: 229; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.119 (0.011 с.) |