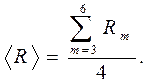Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Изучение работы спектроскопа и наблюдения оптических спектровСодержание книги
Поиск на нашем сайте
Цель работы: знакомство с элементами теории строения и излучения атомов, знакомство со строением и работой спектроскопа, градуировка шкалы спектроскопа и определения длины волны излучения натрия, проверка закономерностей в спектре излучения атомарного водорода и знакомство с видом спектров инертных газов.
5.1 Короткие теоретические сведения
Элементы теории атомов изложены во вступительной части «Методических указаний» в пп. 1.2, …, 1.6 [7] или в соответствующих параграфах учебников [1], [2], [3], [4]. Прежде чем знакомиться с последующим материалом, необходимо детально изучить теорию атомов. По современным представлениям, созданным квантовой механикой (см. п. 1.3), электроны в атомах могут находиться в стационарных состояниях с энергией (см. п. 1.5):
где n – главное квантовое число; постоянная величина; Z- зарядное число ядра атома; s - постоянная экранирования. Переход атомов из одного состояния с n = к в другого из n = m сопровождается излучением, или поглощением кванта энергии:
где R – постоянная величина; к = 1, 2, 3, …; m = k+1, k+2, k+3, …- соответствующие значения главного квантового числа. Для атомов водорода Z = 1; s = 0, поэтому формула (5.1) принимает очень простую форму:
где R = 1,097×107 м‑ 1 » 1,1×107 м‑1 – постоянная Ридберга; с = 3×108 м/с –скорость света в вакууме. Таким образом, излучение атомов состоит из отдельных, характерных только для данного атома, спектральных линий с частотами nmk и длинами волн lmk, которые сопровождают соответствующие переходы в них. Необходимо отметить, что и переходы возможны только при условии выполнения так называемых правил отбора, которые разрешают переходы между состояниями электронов, где изменение орбитального квантового числа Dl = ±1. Набор частот (длин волн), которые может излучать атом, называется его спектром. Он определяет спектральный состав излучения. Под понятием “спектр”, в том числе и оптический спектр, чаще понимают совокупность пространственно разделенных спектральных линий. Устройства, что позволяют получить пространственно разделенный спектр, называются спектроскопами, спектрометрами, спектрографами. _Когда речь идет об излучении вещества, а только это излучение может наблюдаться, потому что излучение отдельного атома слишком слабо, то его спектры могут значительно усложняться в зависимости от агрегатного состояния вещества - соседние атомы могут существенно изменять энергетику электронов. Опыт учит, что только спектры разреженных атомарных газов и паров металлов подобны атомным, и состоят из отдельных цветных узких линий на темном фоне. Такие спектры называются линейчатыми. Линейчатые спектры являются характеристическими, потому что они характерны для атомов данной природы – водорода, кислорода, гелия и так далее. Разреженные молекулярные газы дают полосатый спектр, то есть спектр, что представляет собой цветные полосы на темном фоне. Полосы состоят из близко расположенных спектральных линий, которые в спектрах не очень высокого разрешения практически сливаются в сплошную полосу. Спектры излучения конденсируемых сред и сжатых газов имеют сплошной спектр в виде радужной полосы. Если излучение со сплошным спектром пропустить через поглощающее среду, на выходе из него получим излучение, спектр которого содержит линии поглощения. По закону Кирхгофа-Бунзена спектры поглощения являются обратными к спектрам излучения. Спектр поглощения разреженными атомарными газами представляет собой совокупность темных линий поглощения, так называемых темных фраунгоферовых линий, на фоне радужной полосы. Положение этих линий в точности отвечает положению линий излучения данного газа и для водорода, например, подчиняется закону (5.2). _Формула (5.2), описывающие спектр атомов водорода называется сериальной формулой по той причине, что спектральные линии образуют серии линий в разных участках спектра. Номер серии определяется главным квантовым числом n = к, то есть числом, что определяет энергию состояния электрона, в которое он переходит излучая кванты света, отвечающие спектральным линиям данной серии. Для к = 1 имеем серию линий в диапазоне ультрафиолетового излучения – серия Лаймана. Серия Бальмера – это серия линий с к = 2 расположенных в видимом диапазоне. Излучение с к = 3, 4, … отвечает сериям инфракрасного диапазона.
5.2 Экспериментальные исследования
5.2.1 Изучение строения и градуировка шкалы спектроскопа
Спектроскоп является одним из спектральных приборов – оптических приборов для разложения в спектр за длинами волн (частотами) электромагнитного излучения оптического диапазона и для изучения этих спектров. По способам разложения в спектр приборы делятся на несколько классов [5]. 1) Спектральные приборы с пространственным разложением, где излучение разных частот разделяется по направлениям распространения. 2) Спектральные приборы с амплитудной модуляцией, основанной на явлении дифракции света, где анализ спектрального состава излучения выполняется за счет изменения длины волны и, как следствие, изменения оптической разности хода лучей и изменения интенсивности излучения этой длины волны в результате интерференции и другие. Мы изучаем спектроскоп, то есть прибор для наблюдения оптических спектров, с пространственным разложением. Принципиальная схема прибора УМ – 2 приведенная на рис. 5.1.Прибор имеет три основные части: входной коллиматор – 1; диспергирующий элемент – 2; выходной коллиматор – 3. Входной коллиматор состоит из диафрагмы со щелью Щ, которая находится в фокальной плоскости (расстояние F1) линзы Л1. Он создает параллельный пучок неразделенного излучения, которое направляется на диспергирующий элемент. Диспергирующий элемент - это устройство, в котором пространственное разложение света в спектр происходит благодаря явлению дисперсии, которое заключается в зависимости скорости света V и показателя преломления
Исходный коллиматор фокусирует с помощью линзы Л2 параллельные пучки и создает в фокальной ее плоскости (на расстоянии F2), совпадающей с плоскостью наблюдения ПС (см. рис 5.1), систему изображений входной щели Щ в разных цветах, которые имеют разные длины волн. Таким образом происходит пространственное разложение сложного света в спектр.
Внешний вид спектроскопа изображен на рис. 5.3. Элементы 1, 2, 3 помечают, как и на рис. 5.1, входной коллиматор, диспергирующий элемент и исходный коллиматор. Размеры щели Щ входного коллиматора регулируются с помощью микрометрического винта В. Диспергирующий элемент расположен в корпусе 2 на столике, положение которого регулируется червячной парой с помощью барабана Б. Поворот барабана обеспечивает наблюдение необходимой части спектра и фиксируется по шкале, нанесенной на его поверхности. Спектральные линии наблюдаются с помощью выходного коллиматора, в котором есть визирный штырь, а четкое изображение штыря и линий достигается перемещением окуляра Ок и объектива О коллиматора.
С помощью спектрометра можно определить длину волны неизвестного излучения, как это показано на рис. 5.5 пунктирными линиями: по измерениям угла поворота барабана a проводится линия к пересечению с графиком, после чего проводится горизонтальная линия до пересечения с осью ординат, что определяет измеренную длину волны l.
5.2.2 Порядок выполнения работы
1 Изучить строение спектроскопа. Указать на расположение основных элементов прибора в соответствии с рисунками. 5.1, 5.2 и 5.3. Познакомиться с механизмами управления положением спектра и размерами щели входного коллиматора. 2 Подготовить и включить ртутную лампу. Настроить наилучшую видимость спектра, удостовериться во влиянии размеров щели входного коллиматора на качество спектра. Добиться четкого изображения визирного штыря с помощью перемещения окуляра исходного коллиматора. Изменяя положение объектива исходного коллиматора, добиться четкого изображения спектральных линий. 3 Ввести в поле зрения начало спектра и установить, например, желтую линию ІІ из табл. 5.1 против визирного штыря с помощью поворота барабана. Зафиксировать значение угла поворота барабана. Результат занести в табл. 5.1.
Таблица 5.1
4 Установить против визира желтую линию І. Зафиксировать отсчет угла поворота барабана и занести его к табл. 5.1. Провести соответствующие измерения остальных спектральных линий спектра паров ртути. 5 Заменить с помощью преподавателя или лаборанта ртутную лампу на неоновую, имеющей более широкий диапазон спектра, линии которого приведены в табл. 5.2. Таблица 5.2
6 Построить градуировочный график по данным табл. 5.1 и 5.2. Примечание. Для построения графика необходимо использовать, как минимум, возможности целой страницы вашего протокола работы. Обратите внимание на отсчеты на осях графика, который приведен на рис. 5.5. На осях отложите соответствующие масштабы только в пределах измеренных величин таким образом, чтобы построенный график занимал практически все отведенное поле.
5.2.3 Определение длины волны желтой линии натрия
Экспериментальная установка и метод
Натрий при комнатной температуре есть металл в твердом состоянии. Если его поместить в пламя, например, твердого спирта, он испаряется и, как это указано в теоретической части работы, дает линейчатый спектр. В видимом диапазоне очень хорошо наблюдается желтый дубль – желтая двойная линия с длинами волн 589,0 нм и 589,6 нм, которые в не очень качественном спектроскопе наблюдаются как одна широкая линия с длиной волны 589,3 нм. Заданием этого упражнения является наблюдение желтой линии (или линий) натрия и определения длины соответствующей ей волны с помощью проградуированного вами спектрометра. Натрий используется из его соединения с хлором NaCl (то есть используется обычная кухонная соль).
Порядок выполнения упражнения
1 Настройте спектрометр на наблюдение желтой части спектра. 2 Зажгите полученный у лаборанта сухой спирт и посыпайте сверху кухонную соль, которая находится в коробочке, где разгорается спирт. 3 Проведите измерения желтых линий и занесите результат к табл. 5.2. Теоретическое значение длины волны lТ возьмите из приведенного выше материала п 5.2.2.
Таблица 5.3
Примечание. Если видная одна линия, используйте только первую строку табл. 5.2.
Обработка результатов измерений
1 Определите измеренную вами длину волны с помощью градуировочного графика, манипулируя так, как это показано на рис. 5.5, пунктирной линией. 2 Попробуйте оценить погрешность определения длины волны с помощью градуировочного графика. С этой целью выделите полоску шириной Da = ±1° до пересечения с графиком. Вы получите точки пересечения с графиком предельных линий полосы. Проведите соответствующую горизонтальную полосу к ее пересечению с осью ординат и определите длины волн l1 и l2. Погрешность измерения Dl =l2 - l1. 3 Определите относительную погрешность и запишите результат измерения в стандартной форме. 4 Сопоставьте полученный результат с теоретическим значением и сделайте вывод относительно надежности вашего спектрометра.
5.2.3 Изучение спектров инертных газов
Экспериментальная установка и метод
Инертные газы: гелий, неон, аргон, криптон не создают молекул, поэтому под низким давлением электрический разряд в них дает линейчатый спектр. Заданием упражнения является наблюдение спектров названных инертных газов и их сравнительное описание. Трубки с разреженными инертными газами установлены на специальном стенде и питаются от генератора высокочастотного напряжения. Устройство с трубками может быть установленным перед входным коллиматором спектроскопа.
Порядок выполнения упражнения
1 Установить против щели входного коллиматора трубку с гелием и включить питание. Изучить спектр излучения гелия и сделать его рисунок в протоколе исследования. 2 Повторить действия п. 1 для других газов. 3 Сделать сравнительный вывод для изученных спектров. Отметить подавляющие цвета линий, их яркость, количество и прочее.
5.2.4 Изучение спектра атомов водорода
Экспериментальная установка и метод
Газоразрядная трубка с водородом может быть установленной перед щелью входного коллиматора спектроскопа. Во время прохождения тока молекулы водорода диссоциируют на отдельные атомы, и в трубке наблюдается атомарный спектр водорода на фоне полосатого спектра молекул водорода. В видимой части спектральные линии водорода подчиняются формуле Бальмера:
Заданием упражнения является определение длин волн соответствующих линий и определения постоянной Ридберга R.
Порядок выполнения упражнения
1 Установить водородную лампу против щели входного коллиматора и включить ее питание (воспользуйтесь помощью лаборанта или преподавателя). 2 Познакомьтесь со спектром водорода и дайте объяснение, почему он имеет сложное строение. 3 Найдите все линии атома водорода, которые указаны в табл. 5.4. Внимание: фиолетовая линия может быть невидимой.
Таблица 5.4
4 Поворотом барабана установите фиолетовую линию против визира. Соответствующий отсчет угла поворота барабана занесите в табл. 5.4. Если фиолетовая линия невидимая начните с фиолетово-синей. 5 Измеряйте углы поворота барабана для остальных линий и занесите результаты в табл. 5.4.
Обработка результатов измерений
1 Воспользуйтесь градуировочным графиком и определите длины соответствующих волн. Результаты занесите в табл. 5.4. 2 По формуле 3 По формуле 4 Определите среднее значение постоянной Ридберга
Результат занесите в табл. 5.4. Примечание. Если фиолетовая линия невидима и не измерялась, отсчет начинается с m = 4 и в знаменателе будет 3. То есть будут измерены всего три линии. 5 Определите абсолютные погрешности и их среднее значение. Результаты занесите в табл. 5.4. 6 Определите абсолютную погрешность и запишите результат измерения постоянной Ридберга в стандартной форме. 7 Сопоставьте полученный результат с теоретическим значением постоянной Ридберга R = (10973730,9 ±1,2) 1/м и сделайте вывод.
5.3 Контрольные вопросы
1 Что такое атом и каково его строение? 2 Как определяется поведение электронов в атомах? Что такое квантовая механика и как она решает проблему исследования движения микрообъектов? 3 Как квантовая механика исследует поведение электронов в атомах водорода и водородоподобных ионах? 4 Какой вид имеет стационарное уравнение Шредингера для исследования динамических характеристик атомов водорода и водородоподобных ионов? 5 Что такое квантовые числа и каково их физическое содержание? Какие значения может принимать главное квантовое число? По какой формулой вычисляется энергия атомов водорода и водородоподобных ионов? Что такое вырожденные состояния электронов в атомах и чему равняется кратность их вырождения? 6 Как квантовая механика объясняет процесс излучения атомов? Запишите формулу для определения энергии кванта излучения водорода в видимой части спектра. 7 Что такое оптический спектр? Какие разновидности спектров вы знаете и от чего зависит вид спектра? Почему линейчатые спектры называются характеристическими? 8 Что такое спектроскоп? Каков принцип его действия и какое строение спектроскопа с пространственным разложением? 9 В чем заключается процесс градуировки спектроскопа? 10 Какие источники линейчатых спектров используются в данной работе?
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2017-02-10; просмотров: 730; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.119.117.122 (0.015 с.) |


 (5.1)
(5.1) (5.2)
(5.2)
 где с – скорость света в вакууме, от длины волны. Угол отклонения световых лучей трехгранной призмой зависит от показателя преломления, поэтому прохождение света через трехгранную призму сопровождается его разложением в спектр.
где с – скорость света в вакууме, от длины волны. Угол отклонения световых лучей трехгранной призмой зависит от показателя преломления, поэтому прохождение света через трехгранную призму сопровождается его разложением в спектр. Диспергирующий элемент в спектроскопе УМ – 2 - это трехгранные призмы из прозрачного материала (рис. 5.2), угол отклонения лучей d = f[n(l)] в которых зависит от показателя преломления n и от длины волны l. Он превращает пучок лучей, которые падают на него, в систему параллельных пучков, идущих под разными углами j(l) (см. рис 5.1).
Диспергирующий элемент в спектроскопе УМ – 2 - это трехгранные призмы из прозрачного материала (рис. 5.2), угол отклонения лучей d = f[n(l)] в которых зависит от показателя преломления n и от длины волны l. Он превращает пучок лучей, которые падают на него, в систему параллельных пучков, идущих под разными углами j(l) (см. рис 5.1).

 Для превращения спектроскопа в спектрометр необходимо проградуировать шкалу спектроскопа, то есть поставить в соответствие делениям шкалы спектроскопа соответствующие значения длин волн. Это соответствие, как правило, представляется в виде графика зависимости длины волны l от угла поворота a барабана (см. рис 5.3). Типичная форма градуировочного графика представлена на рис. 5.4. Чтобы построить такой график необходимо иметь излучение с известным линейчатым спектром.
Для превращения спектроскопа в спектрометр необходимо проградуировать шкалу спектроскопа, то есть поставить в соответствие делениям шкалы спектроскопа соответствующие значения длин волн. Это соответствие, как правило, представляется в виде графика зависимости длины волны l от угла поворота a барабана (см. рис 5.3). Типичная форма градуировочного графика представлена на рис. 5.4. Чтобы построить такой график необходимо иметь излучение с известным линейчатым спектром.
 определите соответствующие частоты спектральных линий водорода. Результаты занесите в табл. 5.4.
определите соответствующие частоты спектральных линий водорода. Результаты занесите в табл. 5.4. определите постоянную Ридберга для каждой из длин волн табл. 5.4. Результаты занесите в табл. 5.4.
определите постоянную Ридберга для каждой из длин волн табл. 5.4. Результаты занесите в табл. 5.4.