
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Тепловой эффект реакции при стандартных условияхСодержание книги
Поиск на нашем сайте
По закону Гесса тепловой эффект реакции равен сумме теплот образования продуктов за вычетом суммы теплот образования исходных веществ с учетом стехиометрических коэффициентов. Тепловые эффекты реакций часто выражают через изменение энтальпии. Тепловой эффект DН считают положительным для эндотермических процессов и отрицательным для экзотермических. Значение DН относят к числу молей веществ, участвующих в реакции, которое указывают стехиометрическими коэффициентами. 1) величины теплот образования веществ DНобрСаСО3 = 1190000 кДж/кмоль DНобрH2SO4(р-р) = 267000 кДж/кмоль DНобрСaSO4 = 1392000 кДж/кмоль DНобрСО2 = 285500 кДж/кмоль DНобрН2О(Ж) = 286000 кДж/кмоль 2) тепловой эффект реакции (изменение энтальпии реакции) при стандартных условиях (250С) DН298 = 1392000+285500+286000–1190000–267000 = 506500 кДж/кмоль Изменение энтальпии экзотермической реакции показывается со знаком «-» DН298 = - 506500 кДж
3) величина теплового эффекта реакции при стандартных условиях, приходящаяся на 7,35 кмоль СаSO4 (см. таб. Материального баланса) åDН298 = - 506500*7,35 = - 3722775 кДж
Тепловой эффект реакции при температуре в зоне реакции
В дальнейшем, при необходимости, тепловой эффект реакции пересчитывается на конкретную (более высокую) температуру (Т) в зоне реакции по формуле: DНТ = DН298 + a(Т - 298) + b(Т2 - 2982) + g(Т3 - 2983) где a - алгебраическая сумма коэффициентов «а», из выражений температурной зависимости теплоемкостей веществ (с = а + в∙Т + с∙Т2), участвующих в данной реакции, т.е. a = (n1∙а1 + n2∙а2) – (n3∙а3 + n4∙а4). b - то же, сумма коэффициентов «в», деленная по полам b = 1/2[(n1∙в1 + n2∙в2) – (n3∙в3 + n4∙в4)] g - то же, сумма коэффициентов «с», деленная на три, т.е. g = 1/3[(n1∙с1 + n2∙с2) – (n3∙с3 + n4∙с4)] n1, n2, n3, n4 – стехиометрические коэффициенты в уравнении реакции. При отсутствии данных для расчета с достаточной точностью принимается, что с повышением температуры на каждые 100° тепловой эффект реакции уменьшается на 1,0 – 1,2 %. В практике расчетов производственных процессов может быть использован метод подсчета тепловых эффектов реакций при помощи значений теплосодержаний (см. вариант 2). В рамках данного задания при малом значении теплового эффекта реакции, при котором не происходит значительного повышения температуры, пересчет величины теплового эффекта к конкретной температуре в зоне реакции принято не производить
Физическое тепло реагентов Физическое тепло реагентов может быть найдено по одной из формул: QФ = n*c*t; QФ = m*c*t; QФ = v*c*t; QФ = n*DH где n – количество вещества, кмоль; m – масса вещества, кг; v – объем вещества (газа), м3; с – теплоемкость вещества при соответствующей температуре, (кДж/кмоль*град, кДж/кг*град, кДж/м3*град) DH – теплосодержание продуктов при данной температуре, кДж/кмоль; t – температура реагентов (обычно 0С). Количество реагентов берется по данным материального баланса. Температура реагентов приводится в задании или принимается на основании литературных данных. Теплоемкости веществ берутся по справочным данным
Физическое тепло реагентов
Общее количество физического тепла на входе в аппарат составляет 318248,4 кДж
|
|||||
|
Последнее изменение этой страницы: 2017-02-09; просмотров: 175; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.145.103.119 (0.009 с.) |

 = 81,85 Дж/моль∙град
= 81,85 Дж/моль∙град = 231,6 Дж/моль∙град
= 231,6 Дж/моль∙град = 67,03 Дж/моль∙град
= 67,03 Дж/моль∙град = 79, 0 Дж/моль∙град
= 79, 0 Дж/моль∙град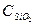 = 44,5 Дж/моль∙град
= 44,5 Дж/моль∙град = 137,57 Дж/моль∙град
= 137,57 Дж/моль∙град = 75,31 Дж/моль∙град
= 75,31 Дж/моль∙град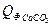 = 9,19∙81,57∙20 = 14992,56 кДж
= 9,19∙81,57∙20 = 14992,56 кДж =1,89∙231,6∙20 = 8754,48 кДж
=1,89∙231,6∙20 = 8754,48 кДж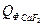 = 0,75∙67,03∙20 = 1005,45 кДж
= 0,75∙67,03∙20 = 1005,45 кДж = 1,92∙79,0∙20 = 3033,60 кДж
= 1,92∙79,0∙20 = 3033,60 кДж = 3,26∙44,5∙20 = 2901,40 кДж
= 3,26∙44,5∙20 = 2901,40 кДж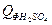 = 8,09∙137,57∙20 = 22258,83 кДж
= 8,09∙137,57∙20 = 22258,83 кДж = 176,14*75,31*20 = 265302,06 кДж
= 176,14*75,31*20 = 265302,06 кДж


