
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Схема движения материальных потоковСодержание книги Поиск на нашем сайте
УДК 66:011 (075.8) ББК 35.115 Э72
ЭповаТ.И., Пономарева Н.Н. Методические указания к выполнению курсовой работы по общей химической технологии – Тольятти, ТГУ, 2006. – 98 с.
Методические указания предназначены для студентов специальности 170500 «Машины и аппараты химических производств» заочной формы обучения. Показано основные расчеты по заданиям, отличающимся изменением свободной энергии рассматриваемых систем
Прилож.7. Библиогр.23 назв.
Составители: к.т.н., доцент Эпова Т.И., к.х.н., доцент Пономарева Н.Н. Научный редактор д.х.н., профессор Щукин В.П.
Утверждено редакционно-методической секцией методического совета факультета
УДК 66:011 (075.8) ББК 35.115 Э72
©Тольяттинский государственный университет, 2006
Общие указания В данном пособии рассмотрено выполнение расчетов по процессам, отличающимся изменением энергии Гиббса. Более подробно показано выполнение первого варианта. В остальных приведена возможность решения другими способами или отличия в решении по сравнению с первым вариантом. Для подготовки обзора по свойствам реагентов и продуктов, как правило, может быть использована самая разнообразная литература – учебники, справочники, монографии по отдельным процессам и др. Для подготовки к выполнению расчетной части работы могут быть рекомендованы источники [1-5]. Изучение кинетики, механизма реакции и выбор технологической схемы процесса требуют специальной литературы; в качестве примера приведены источники [6-23]. Курсовая работа оформляется в виде записки и двух листов графического материала (технологическая схема процесса и общий вид основного аппарата). По работе готовится доклад и проводится защита. оценка по курсовой работе определяется защитой.
2. Выполнение расчетов по заданию первого варианта Задание: Дать обзор по свойствам реагентов и продуктов, по кинетике и механизму реакции. Определить количественный состав продуктов, тепловой эффект реакции, температуру в зоне реакции, изменение энергии Гиббса системы. Представить материальный и тепловой балансы системы. Обосновать выбор реактора и технологической схемы процесса. Дать экологический анализ.
Состав руды: СаСО3 – 47%; Ca3(PO4)2 – 30%; CaF2 – 3%; Al2O3 – 10%; SiO2 – 10%. СаСО3 превращается на 80%, Н2SO4 берется с избытком в 1,1 в виде 20%-ного раствора. Принять, что 75% Н2О выводится со шламом, а 25% переходит в газовую фазу. Температуру реагентов принять 200С. Расчет вести на 1т СаSO4.
Тепловой эффект реакции при стандартных условиях По закону Гесса тепловой эффект реакции равен сумме теплот образования продуктов за вычетом суммы теплот образования исходных веществ с учетом стехиометрических коэффициентов. Тепловые эффекты реакций часто выражают через изменение энтальпии. Тепловой эффект DН считают положительным для эндотермических процессов и отрицательным для экзотермических. Значение DН относят к числу молей веществ, участвующих в реакции, которое указывают стехиометрическими коэффициентами. 1) величины теплот образования веществ DНобрСаСО3 = 1190000 кДж/кмоль DНобрH2SO4(р-р) = 267000 кДж/кмоль DНобрСaSO4 = 1392000 кДж/кмоль DНобрСО2 = 285500 кДж/кмоль DНобрН2О(Ж) = 286000 кДж/кмоль 2) тепловой эффект реакции (изменение энтальпии реакции) при стандартных условиях (250С) DН298 = 1392000+285500+286000–1190000–267000 = 506500 кДж/кмоль Изменение энтальпии экзотермической реакции показывается со знаком «-» DН298 = - 506500 кДж
3) величина теплового эффекта реакции при стандартных условиях, приходящаяся на 7,35 кмоль СаSO4 (см. таб. Материального баланса) åDН298 = - 506500*7,35 = - 3722775 кДж
Физическое тепло реагентов Физическое тепло реагентов может быть найдено по одной из формул: QФ = n*c*t; QФ = m*c*t; QФ = v*c*t; QФ = n*DH где n – количество вещества, кмоль; m – масса вещества, кг; v – объем вещества (газа), м3; с – теплоемкость вещества при соответствующей температуре, (кДж/кмоль*град, кДж/кг*град, кДж/м3*град) DH – теплосодержание продуктов при данной температуре, кДж/кмоль; t – температура реагентов (обычно 0С). Количество реагентов берется по данным материального баланса. Температура реагентов приводится в задании или принимается на основании литературных данных. Теплоемкости веществ берутся по справочным данным
Физическое тепло реагентов
Общее количество физического тепла на входе в аппарат составляет 318248,4 кДж Температура в зоне реакции Тепло, поступающее в аппарат, идет на нагрев продуктов (без учета потерь в окружающую среду) и равно энергосодержанию продуктов. Максимальная температура в зоне реакции может быть найдена по формуле:
Поскольку теплоемкость веществ зависит от температуры, а температура не известна, то при ориентировочном определении температуры приходится брать значение теплоемкости продуктов при ожидаемой, предлагаемой температуре. Допустим, в данном случае это 150,00С. По справочным данным при 150,00С теплоемкости продуктов следующие:
1) среднее значение теплоемкости продуктов
2) теплота испарения воды [1,5]
3) температура в зоне реакции
Физическое тепло продуктов 1) физическое тепло компонентов материального потока на выходе из аппарата
ИТОГО 2081269,5 кДж Тепловой баланс процесса Полученные расчетные данные представляются в таблице
Потери тепла в данном случае составляет 2,2 % от прихода. В подобных расчетах не следует допускать больших значений статей потерь тепла. Если баланс по теплу не может быть сведен, поиск температуры в зоне реакции следует повторить. Физическое тепло реагентов 1) теплоемкость веществ по справочным данным СH2S = 34,04 кДж/кмоль*град СH2О(Г) = 34,04 кДж/кмоль*град CN2 = 28,76 кДж/кмоль*град 2) физическое тепло компонентов материального потока на входе в аппарат QФ = n*c*t QфH2S = 0,589*34,04*20 = 400,99 кДж QфH2О(Г) = 0,067*34,04*20 = 45,61 кДж QфN2 = 7,009*28,76*20 = 4031,577 кДж Общее количество физического тепла составляет 4478,182 кДж
Температура в зоне реакции 1) предполагая, что температура в зоне реакции 10000С, находим соответствующие значения теплоемкостей продуктов СH2S = 38,6 кДж/кмоль*град СH2О = 38,6 кДж/кмоль*град СО2 = 33,0 кДж/кмоль*град CN2 = 31,4 кДж/кмоль*град СSO2 = 50,6 кДж/кмоль*град 2) среднее значение теплоемкости продуктов
3) температура в зоне реакции
Физическое тепло продуктов
QфH2S = 0,07*38,6*1000 = 2702 кДж QфH2О(Г) = 0,585*38,6*1000 = 22581 кДж QфN2 = 7,01*31,4*1000 = 220114 кДж QфO2 = 0,813*33,0*1000 = 26829 кДж
2984368,8 кДж
Тепловой баланс процесса Полученные расчетные данные представляются в виде таблицы
Потери тепла в данном расчете составляет 0,26 % от прихода. Практически, потери тепла от печи могут составлять до 20%. Если баланс по теплу не может быть сведен, поиск температуры в зоне реакции следует повторить. Схема материальных потоков СаО SiO2 Al2O3 C
CaC2 SiO2 Al2O3 CaO C
Физическое тепло реагентов 1) теплоемкости реагентов при 250С
СС = 8,53 Дж/моль*град 2) физическое тепло реагентов QФ = n*c*t
QФС = 53,03*8,53*25 = 11308,65 кДж Общее количество физического тепла реагентов составляет 30411,01 кДж Физическое тепло продуктов 1) теплоемкости продуктов при 20000С
СС = 8,531 Дж/моль*град
ССО = 33,800 кДж/кмоль*град 2) физическое тепло продуктов QФ = n*c*t
QФС = 11,57*8,531*2000 = 197407,34 кДж
ИТОГО = 3199989,70 кДж Тепловой баланс процесса Полученные расчетные данные представляются в таблице
Расход электроэнергии 1) недостающее количество энергии 9583447,7– 30411,01 = 9553036,7 кДж 2) расход электроэнергии (без учета потерь) 3,6*103 кДж – 1 кВт*ч 9553036,7 кДж – х х = 2653,6 кВт*ч
Схема материальных потоков
С3Н8 CO2, H2O, N2
N2
Тепловой эффект реакции 1) теплоты образования веществ DНобрС3Н8 = -103,9 кДж/моль DНобрН2О(Г) = -241,84 кДж/моль DНобрСО = -110,5 кДж/моль 2) тепловой эффект реакции при стандартных условиях DН293 = 3*(-110,5) – (-103,9 – 3*241,84) = 497,920 кДж/моль DН293 = 497920 кДж/кмоль Реакция эндотермична 3) тепловой эффект реакции, приходящийся на 4,46 кмоль С3Н8 åDН293 = 497920*4,46 = 2220723,2 кДж Физическое тепло реагентов 1) теплоемкости реагентов при 3500С
2) физическое тепло пропана и водяного пара на входе в аппарат QФ = n*c*t
åQФ = 67903,5 + 163090,2 = 230993,7 кДж Физическое тепло продуктов 1) теплоемкости продуктов при 6500С ССО = 30,6 кДж/кмоль*град
2) физическое тепло оксида углерода и водорода на выходе из аппарата QФСО = 13,39*30,6*650 = 266327,1 кДж
åQФ = 266327,1 + 597187,5 = 863514,6 кДж
Состав продуктов
Состав продуктов СО – 10,6%об Н2 – 24,8%об СО2 – 18,0%об Н2О(Г) - 24,0%об N2 – 22.6%об Библиографический список 1. Бесков С.Д. Технохимические расчеты. - М.: Высшая школа, 1966-520с. 2. Туболкин А.Ф., Тумаркина Е.С., Тарат Э.Я. и др. Расчеты химико-технологических процессов. - Л.: Химия, 1982-248с. 3. Позин М.Е., Копылев Б.А., Бельченко и др. Расчеты по технологии неорганических веществ. – М.: Химия, 1966-640с. 4. Дыбина П.В., Соловьева А.С., Вишняк Ю.И. Расчеты по технологии неорганических веществ. – М.: Высшая школа, 1967-523с. 5. Краткий справочник физико-химических величин / под ред. К.П. Мищенко. – Л.: Химия, 1967-184с. 6. Мухленов И.П., Горштейн А.Е., Тумаркина Е.С и др. Основы химической технологии. – М.: Высшая школа, 1991-335с. 7. Кутепов А.М., Бондарева Т.И., Беренгартен М.Г. Общая химическая технология. – М.: Высшая школа, 1990-448с. 8. Юкельсон И.И. Технология основного органического синтеза. – М.: Химия, 1968-577с. 9. Зыков Д.Д., Деревицкая В.А., Тростянская Е.Б. и др. Общая химическая технология органических веществ. – М.: Химия, 1966-608с. 10. Соколовский А.А., Яшке Е.В. Технология минеральных удобрений и кислот. – М.: Химия, 1971-456с. 11. Андреев М.В., Бродский А.А., Забелешиниский Ю.А. и др. Технология фосфорных и комплексных удобрений. – М.: Химия, 1987-320с. 12. Амелин А.Г. Производство серной кислоты. – М.: Химия, 1967-280с. 13. Амелин А.Г. Производство серной кислоты из сероводорода по методу мокрого катализа. – М.: Госхимиздат, 1960-270с. 14. Производство аммиака / под ред. В.П. Семенова.– М.:Химия,1985-377с. 15. Справочник азотчика / под ред. Е.Я. Мельникова.–М.: Химия, 1986-512с. 16. Атрощенко В.И., Каргин С.И. Технология азотной кислоты.-М.: Химия, 1970-496с. 17. Атрощенко В.И., Алексеев А.М., Засорин А.П. и др. Курс технологии связанного азота, - М.: Химия, 1969-384с. 18. Крючков А.П. Общая технология синтетических каучуков, - М.: Химия, 1969-557с. 19. Айнштейн В.Г., Захаров М.К., Носов Г.А. и др. Общий курс процессов и аппаратов химической технологии: Учебник для вузов. – М.: Химия, 2000-1759с. 20. Мазур И.И., Молдаванов О.И. Курс инженерной экологии. – М.: Высшая школа, 1999-448с. 21. Махлай В.Н., Афанасьев С.В. Введение в химию карбомидоформальдегидного концентрата.- Тольятти: ТГУ, 2000-115с. 22. Луканин В.Н., Трофименко Ю.В. Промышленно-транспортная экология. – М.: Высшая школа, 2001-296с. 23. Махлай В.Н., Афанасьев С.В., Колнин Н.Г. Технологические процессы производств, пожарная опасность и меры профилактики. – Тольятти: Тольяттинский филиал Военного инженерно-технологического университета, 2002-220с. СОДЕРЖАНИЕ стр. 1. Общие указания…………………………………………………………… 3 2. Выполнение расчетов по заданию первого варианта……………………. 3 2.1. Схема движения материальных потоков………………………………… 3 2.2. Материальный баланс процесса …………………………………………. 2.3. Количественный состав продуктов………………………………………. 2.4. Тепловой эффект реакции при стандартных условиях …………………. 2.5. Тепловой эффект реакции при температуре в зоне реакции……………. 2.6. Физическое тепло реагентов………………………………………………. 2.7. Суммарная величина статей прихода тепла……………………………… 2.8. Температура в зоне реакции………………………………………………... 2.9. Физическое тепло продуктов ………….…………………………………… 2.10. Тепловой баланс процесса…………………………………………………. 2.11. Изменение свободной энергии системы………………………………….. 3. Выполнение расчетов по заданию второго варианта………………………. 3.1. Схема движения материальных потоков…………………………………… 3.2. Материальный баланс процесса …………………………………………. 3.3. Количественный состав продуктов………………………………………. 3.4. Тепловой эффект реакции при стандартных условиях …………………. 3.5. Тепловой эффект реакции при температуре в зоне реакции……………. 3.6. Физическое тепло реагентов………………………………………………. 3.7. Суммарная величина статей прихода тепла……………………………… 3.8. Температура в зоне реакции………………………………………………... 3.9. Физическое тепло продуктов ………….…………………………………… 3.10. Тепловой баланс процесса…………………………………………………. 3.11. Изменение свободной энергии системы………………………………….. 4. Выполнение расчетов по заданию третьего варианта………………………. 4.1. Схема движения материальных потоков…………………………………… 4.2. Материальный баланс процесса …………………………………………. 4.3. Количественный состав продуктов………………………………………. 4.4. Тепловой эффект реакции при стандартных условиях …………………. 4.5. Физическое тепло реагентов………………………………………………. 4.6. Физическое тепло продуктов ………….…………………………………… 4.7. Тепловой баланс процесса…………………………………………………. 4.8. Расход электроэнергии………………….………………………………….. 4.9. Изменение свободной энергии системы………………………………….. 5. Выполнение расчетов по заданию четвертого варианта…………………… 5.1. Схема движения материальных потоков…………………………………… 5.2. Материальный баланс основной реакции…………………………………. 5.3. Тепловой эффект реакции…………………………………..………………. 5.4. Физическое тепло реагентов………………………………………………. 5.5. Физическое тепло продуктов ………….…………………………………… 5.6. Тепловой баланс процесса основной реакции………………………….…. 5.7. Требуемое количество пропана на сжигание………………….………….. 5.8. Состав продуктов…………………………………………………………… 5.9. Изменение свободной энергии системы………………………………….. Приложение 1. Некоторые константы наиболее употребляемых газов. Приложение 2. Температурная зависимость истинной мольной и объемной теплоемкости газов и паров при нормальном давлении. Приложение 3. Средняя мольная теплоемкость газов от 0 до t°С при нормальном давлении. Приложение 4. Средняя мольная теплоемкость газов от 0 до t°С при постоянном объеме. Приложение 5. Истинная удельная теплоемкость, температура и теплота плавления некоторых твердых веществ. Приложение 6. Теплосодержание газов при различных температурах и нормальном давлении (по отношению к 0 °С). Приложение 7. Термодинамические величины. Библиографический список
УДК 66:011 (075.8) ББК 35.115 Э72
ЭповаТ.И., Пономарева Н.Н. Методические указания к выполнению курсовой работы по общей химической технологии – Тольятти, ТГУ, 2006. – 98 с.
Методические указания предназначены для студентов специальности 170500 «Машины и аппараты химических производств» заочной формы обучения. Показано основные расчеты по заданиям, отличающимся изменением свободной энергии рассматриваемых систем
Прилож.7. Библиогр.23 назв.
Составители: к.т.н., доцент Эпова Т.И., к.х.н., доцент Пономарева Н.Н. Научный редактор д.х.н., профессор Щукин В.П.
Утверждено редакционно-методической секцией методического совета факультета
УДК 66:011 (075.8) ББК 35.115 Э72
©Тольяттинский государственный университет, 2006
Общие указания В данном пособии рассмотрено выполнение расчетов по процессам, отличающимся изменением энергии Гиббса. Более подробно показано выполнение первого варианта. В остальных приведена возможность решения другими способами или отличия в решении по сравнению с первым вариантом. Для подготовки обзора по свойствам реагентов и продуктов, как правило, может быть использована самая разнообразная литература – учебники, справочники, монографии по отдельным процессам и др. Для подготовки к выполнению расчетной части работы могут быть рекомендованы источники [1-5]. Изучение кинетики, механизма реакции и выбор технологической схемы процесса требуют специальной литературы; в качестве примера приведены источники [6-23]. Курсовая работа оформляется в виде записки и двух листов графического материала (технологическая схема процесса и общий вид основного аппарата). По работе готовится доклад и проводится защита. оценка по курсовой работе определяется защитой.
2. Выполнение расчетов по заданию первого варианта Задание: Дать обзор по свойствам реагентов и продуктов, по кинетике и механизму реакции. Определить количественный состав продуктов, тепловой эффект реакции, температуру в зоне реакции, изменение энергии Гиббса системы. Представить материальный и тепловой балансы системы. Обосновать выбор реактора и технологической схемы процесса. Дать экологический анализ.
Состав руды: СаСО3 – 47%; Ca3(PO4)2 – 30%; CaF2 – 3%; Al2O3 – 10%; SiO2 – 10%. СаСО3 превращается на 80%, Н2SO4 берется с избытком в 1,1 в виде 20%-ного раствора. Принять, что 75% Н2О выводится со шламом, а 25% переходит в газовую фазу. Температуру реагентов принять 200С. Расчет вести на 1т СаSO4.
Схема движения материальных потоков
Производство простого суперфосфата заключается в сернокислотном разложении фтораппатита. Процесс гетерогенный, многофазный, осуществляемый согласно общему уравнению реакции
В действительности процесс разложения значительно более сложен, протекает в две стадии и сопровождается рядом побочных реакций. Так, карбонаты кальция, всегда присутствующие в осадочных фосфоритных рудах, разлагаются серной кислотой с выделением диоксида углерода. Именно эта реакция принята в качестве задания на курсовую работу.
Схема материальных потоков
СаСО3Н2SO4 Ca3(PO4)2 H2O
Al2O3 CO2
Реактор
Шлам СaSO4 Ca3(PO4)2 CaF2 Al2O3 SiO2 CaCO3 H2O(Ж)
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2017-02-09; просмотров: 243; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.17.175.191 (0.01 с.) |

 СаСО3 + Н2SO4 CaSO4 + CO2 + H2O - DH
СаСО3 + Н2SO4 CaSO4 + CO2 + H2O - DH = 81,85 Дж/моль∙град
= 81,85 Дж/моль∙град = 231,6 Дж/моль∙град
= 231,6 Дж/моль∙град = 67,03 Дж/моль∙град
= 67,03 Дж/моль∙град = 79, 0 Дж/моль∙град
= 79, 0 Дж/моль∙град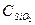 = 44,5 Дж/моль∙град
= 44,5 Дж/моль∙град = 137,57 Дж/моль∙град
= 137,57 Дж/моль∙град = 75,31 Дж/моль∙град
= 75,31 Дж/моль∙град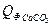 = 9,19∙81,57∙20 = 14992,56 кДж
= 9,19∙81,57∙20 = 14992,56 кДж =1,89∙231,6∙20 = 8754,48 кДж
=1,89∙231,6∙20 = 8754,48 кДж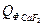 = 0,75∙67,03∙20 = 1005,45 кДж
= 0,75∙67,03∙20 = 1005,45 кДж = 1,92∙79,0∙20 = 3033,60 кДж
= 1,92∙79,0∙20 = 3033,60 кДж = 3,26∙44,5∙20 = 2901,40 кДж
= 3,26∙44,5∙20 = 2901,40 кДж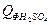 = 8,09∙137,57∙20 = 22258,83 кДж
= 8,09∙137,57∙20 = 22258,83 кДж = 176,14*75,31*20 = 265302,06 кДж
= 176,14*75,31*20 = 265302,06 кДж
 = 81,85 Дж/моль*град
= 81,85 Дж/моль*град = 27,05 Дж/моль*град
= 27,05 Дж/моль*град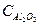 = 79,06 Дж/моль*град
= 79,06 Дж/моль*град = 44,508 Дж/моль*град
= 44,508 Дж/моль*град = 33,94 Дж/моль*град
= 33,94 Дж/моль*град = 75,4 Дж/моль*град
= 75,4 Дж/моль*град =99,7 Дж/моль*град
=99,7 Дж/моль*град = 39,9 Дж/моль*град
= 39,9 Дж/моль*град = 33,6 Дж/моль*град
= 33,6 Дж/моль*град =(1,84*81,85+1,89*231,6+0,75*27,05+1,92*79,06+3,26*44,508+0,73*33,94+137,62*75,4+7,35*99,7+7,35*39,9+45,9*33,6)/208,58=66,52 кДж/кмоль*град
=(1,84*81,85+1,89*231,6+0,75*27,05+1,92*79,06+3,26*44,508+0,73*33,94+137,62*75,4+7,35*99,7+7,35*39,9+45,9*33,6)/208,58=66,52 кДж/кмоль*град = 40680,0 кДж/кмоль
= 40680,0 кДж/кмоль = 45,9*40680,0 = 1867212 кДж
= 45,9*40680,0 = 1867212 кДж
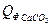 = 1,84*81,85*150 = 22590,60 кДж
= 1,84*81,85*150 = 22590,60 кДж = 1,89*231,6*150 = 65658,6 кДж
= 1,89*231,6*150 = 65658,6 кДж = 137,62*75,4*150 = 1556482,2 кДж
= 137,62*75,4*150 = 1556482,2 кДж = 7,35*99,7*150 = 109919,25 кДж
= 7,35*99,7*150 = 109919,25 кДж = 7,35*39,9*150 = 43989,75 кДж
= 7,35*39,9*150 = 43989,75 кДж = 45,9*33,6*150 = 231336,0 кДж
= 45,9*33,6*150 = 231336,0 кДж = (10,07*38,6 + 0,585*38,6 + 0,813*33,0 + 5,982*31,4 + 0,518*50,6)/8,995 = = 29,59 кДж/кмоль*град
= (10,07*38,6 + 0,585*38,6 + 0,813*33,0 + 5,982*31,4 + 0,518*50,6)/8,995 = = 29,59 кДж/кмоль*град
 QфSO2 = 0,518*50,6*1000 = 26210,8 кДж
QфSO2 = 0,518*50,6*1000 = 26210,8 кДж




 CO
CO
 CaO + 3C CaC2 + CO + DH
CaO + 3C CaC2 + CO + DH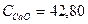 Дж/моль*град
Дж/моль*град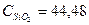 Дж/моль*град
Дж/моль*град Дж/моль*град
Дж/моль*град 16,07*42,80*25 = 17194,9 кДж
16,07*42,80*25 = 17194,9 кДж 0,33*44,48*25 = 366,96 кДж
0,33*44,48*25 = 366,96 кДж 0,78*79,00*25 = 1540,5 кДж
0,78*79,00*25 = 1540,5 кДж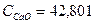 Дж/моль*град
Дж/моль*град Дж/моль*град
Дж/моль*град Дж/моль*град
Дж/моль*град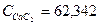 Дж/моль*град
Дж/моль*град 13,82*62,342*2000 = 1723132,80 кДж
13,82*62,342*2000 = 1723132,80 кДж QФСО = 13,82*33,800*2000 = 934232,00 кДж
QФСО = 13,82*33,800*2000 = 934232,00 кДж С3Н8 СО, Н2
С3Н8 СО, Н2 Н2О(Г)
Н2О(Г)
 О2
О2 C3Н8 + 3Н2О 3СО + 7Н2 +DН
C3Н8 + 3Н2О 3СО + 7Н2 +DН (С3Н8 + 5О2 3СО2 + 4Н2О - DН)
(С3Н8 + 5О2 3СО2 + 4Н2О - DН) = 43,5 кДж/кмоль*град
= 43,5 кДж/кмоль*град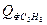 = 4,46*43,5*350 = 67903,5 кДж
= 4,46*43,5*350 = 67903,5 кДж = 13,39*34,8*350 = 163090,2 кДж
= 13,39*34,8*350 = 163090,2 кДж = 29,4 кДж/кмоль*град
= 29,4 кДж/кмоль*град = 31,25*29,4*650 = 597187,5 кДж
= 31,25*29,4*650 = 597187,5 кДж

 CaF2
CaF2
 CaCO3 + H2SO4 CaSO4 + CO2 + H2O -DH
CaCO3 + H2SO4 CaSO4 + CO2 + H2O -DH


