
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Электродный потенциал. Стандартный электродный потенциал. Ряд стандартных электродных потенциаловСодержание книги
Поиск на нашем сайте
Между положительными ионами и электронами возникает скачок потенциала, который называется электродным потенциалом. Потенциал, возникающий в условиях равновесия электродной реакции, называется равновесным электродным потенциалом. Значение электродного потенциала, возникающего на границе металл-раствор, зависит от природы металла, активности ионов этого металла и от температуры. Абсолютное значение электродного потенциала в настоящее время измерить или рассчитать невозможно. Но можно определить значение электродного потенциала относительно какого-либо электрода, выбранного в качестве стандарта. Согласно международному соглашению таким стандартом служит стандартный (нормальный) водородный электрод, потенциал которого условно принят за нуль: Стандартный водородный электрод представляет собой платиновую пластинку, покрытую платиновой чернью и опущенную в раствор Н2SO4 или HCI с
Рисунок 2 – Водородный электрод
Платина, отличающаяся высокой химической стойкостью, в электродном процессе не участвует. Ее роль сводится к адсорбции на своей поверхности водорода и переносу электронов. На поверхности платины протекает процесс: H2 ⇄ 2Н+ + 2 Если пластинку любого металла соединить со стандартным водородным электродом, то получим значение стандартного электродного потенциала данного металла. Располагая металлы в порядке увеличения стандартных электродных потенциалов, получают электрохимический ряд напряжений металлов. Металлы, стоящие в ряду напряжений после водорода, не способны вытеснять водород из кислот. Вытеснение металла из солей другим металлом осуществляется только в том случае, если вытесняющий металл расположен в ряду напряжений до вытесняемого. Чем дальше друг от друга удалены металлы в электрохимическом ряду напряжений (т.е. чем больше разница между стандартными потенциалами металлов), тем больше ЭДС гальванического элемента, в котором эти металлы использованы. Стандартные потенциалы являются количественной мерой окислительно-восстановительной способности системы. Чем выше значение φ0, тем большей окислительной способностью обладает окисленная форма данной пары. Восстановительные свойства сильнее выражены у восстановленной формы в паре с меньшим значением φ0. Все металлы в ряду напряжений делятся на: активные (литий – алюминий), средней активности (до водорода), неактивные.
|
||||
|
Последнее изменение этой страницы: 2017-02-09; просмотров: 189; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.221.90.184 (0.008 с.) |

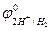 = 0.0 В.
= 0.0 В. = 1 моль/л, через который все время пропускается газообразный Н2 под давлением 101.3 кПа при 298 К (рис. 2).
= 1 моль/л, через который все время пропускается газообразный Н2 под давлением 101.3 кПа при 298 К (рис. 2).
 .
.


