
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Какие процессы называются электрохимическими?
Все электрохимические процессы можно разделить на две противоположные группы: процессы электролиза, при которых под действием внешнего источника электроэнергии происходят химические реакции, и процессы возникновения электродвижущей силы и электрического тока вследствие определенных химических реакций. В первой группе процессов электрическая энергия превращается в химическую, во второй ‒ наоборот, химическая ‒ в электрическую. Все электрохимические реакции происходят при протекании электрического тока в цепи. Этот круг обязательно состоит из последовательно соединенных металлических проводников и раствора (или расплава) электролита. В металлических проводниках ток переносят электроны, в растворе электролитов ‒ ионы. Непрерывность протекания тока в цепи обеспечивается только тогда, когда происходят процессы на электродах, т.е. на границе металл ‒ электролит. На одном электроде происходит процесс приема электронов ‒ восстановление, на втором электроде - процесс отдачи электронов, т.е. окисления. Особенностью электрохимических процессов, в отличие от обычных химических, является пространственное разделение процессов окисления и восстановления. Из этих процессов, которые не могут происходить друг без друга, и состоит в целом химический процесс в электрохимической системе.
1.2 В чем заключается сущность механизма образования электродного потенциала?
Гальванический элемент (химический источник тока) – это устройство, в котором химическая энергия окислительно-восстановительной реакции превращается в электрическую. Гальванический элемент состоит из двух электродов (полуэлементов). Система, в которой металл погружен в раствор собственной соли, называется электродом или полуэлементом. При погружении металлической пластинки в раствор собственной соли имеют место два основных процесса. Первый процесс – это ионизация металла пластинки, где в узлах кристаллической решетки находятся ионы – атомы:
Ионизация происходит под действием полярных молекул растворителя (воды). Образующиеся при этом электроны концентрируются на пластинке, заряжая ее отрицательно, а образующиеся катионы металла переходят с пластинки в раствор и концентрируются возле пластинки (рис. 1).
Рисунок1 – Схема металлического электрода
Второй процесс – это взаимодействие молекул растворителя с ионами металла, т.е. сольватация образующихся ионов:
При погружении пластинки металла в раствор вначале преобладает процесс ионизации металла, но со временем скорость прямой реакции уменьшается, а растет скорость обратной реакции, пока между этими процессами не установится динамическое равновесие
При этом на границе металл-раствор (твердая фаза — жидкость) устанавливается равновесный двойной электрический слой (ДЭС), состоящий из положительных ионов и электронов. Условное обозначение системы металл-раствор – Ме/Меn+, где вертикальной чертой отмечена граница раздела твердая фаза-раствор.
|
|||||
|
Последнее изменение этой страницы: 2017-02-09; просмотров: 170; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.12.36.30 (0.005 с.) |
 .
.
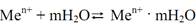 .
.



